Wartość opałowa Wd jest to ciepło spalania Wg pomniejszone o ciepło parowania wody wydzielonej z paliwa podczas jego spalania. Wartość opałową oblicza się doświadczalnie z ciepła spalania tj. ilości ciepła spalania w kcal / kg lub cal / g wydzielonego w bombie kalometrycznej pomniejszonego o ciepło skraplania się wody w paliwie, które uwalnia się w postaci pary.
Ciepło spalania Wg jest to ilość ciepła wyrażona w kcal / kg paliwa, wydzielona przy całkowitym spalaniu próbki paliwa w bombie kalometrycznej, mierzona po skropleniu się pary wodnej i po ochłodzeniu produktów spalania do temperatury początkowej substratów, pomniejszonej o ilość ciepła wydzielonego podczas syntezy i rozpuszczenia H2SO4 i HNO3.
Zależność pomiędzy wartością opałową a ciepłem spalania można określić następująco:
Wg = Wd + r⋅f
gdzie: r - ciepło parowania wody
f - ilość kg H2O zawartej w paliwie
Na podstawie pomiarów przy pomocy bomby kalometrycznej ciepło spalania można obliczyć:
K - wartość cieplna kalorymetu (cal / oC)
t1 - najwyższa temperatura okresu głównego (oC)
t - ostatnia temperatura okresu początkowego ( oC)
m - masa próbki (g)
p - poprawka temperatury wynikająca z wymiany ciepła układu kalometrycznego z
otoczeniem
Σ - suma ciepła uzyskana z efektów cieplnych nie związanych z ciepłem spalania
(ciepło spalania drutu oporowego, syntezy kwasu siarkowego i azotowego)
Ilość wydzielonego ciepła po spaleniu próbki badanego paliwa w wypełnionej tlenem bombie kalometrycznej znajduje się mierząc przyrost temperatury wody w naczyniu kalometrycznym, do którego wstawiona jest bomba.
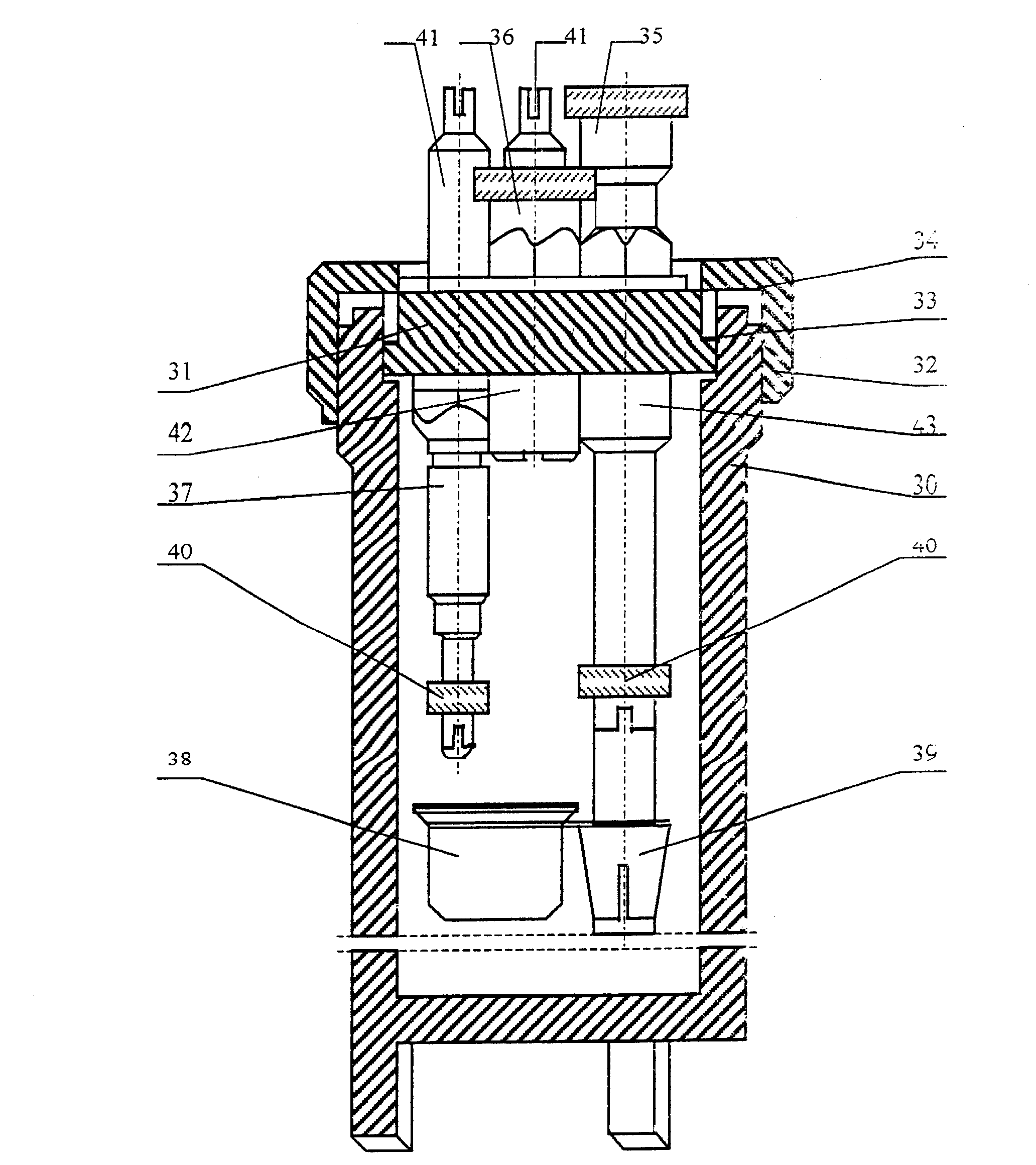
Rys. 1 Przekrój bomby kalometrycznej:
30 - korpus bomby
31 - głowica
32 - zakrętka samouszczelniająca
33 - uszczelka gumowa głowicy
34 - pierścień dociskowy metalowy
35 - zawór zwrotny wlotowy
36 - zawór zwrotny wylotowy
37 - elektroda
38 - tygiel
39 - obsada tygla
40 - tulejki zaciskowe
41 - zatyczki
42 - osłona zaworu wylotowego
43 - rurka wlotowa
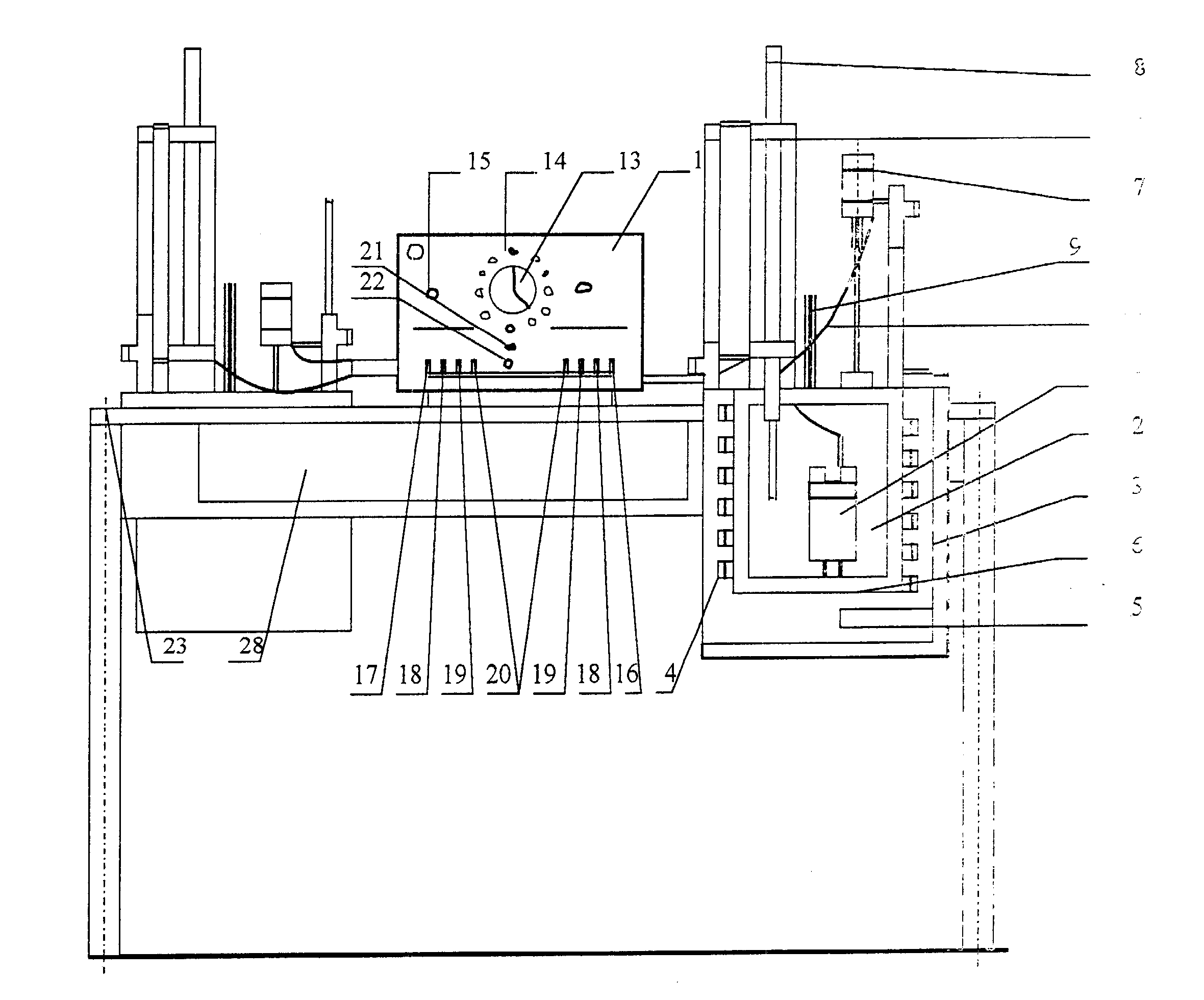
Rys. 2 Schemat zestawu kalometrycznego
PRZEBIEG ĆWICZENIA:
Zwarzyć próbkę sproszkowanego, uformowanego w postaci pastylki paliwa.
Podwiesić próbkę do uchwytów w głowicy bomby kalometrycznej wprowadzając drut oporowy pod tulejki zaciskowe elektrod.
Napełnić naczynie kalometryczne wodą destylowaną o temperaturze 1 - 1,5oC niższej od temperatury płaszcza kalorymetru. Ilość wody powinna wynosić 2700 ml.
Wprowadzić do korpusu bomby za pomocą pipety 2 - 5 ml wody destylowanej.
Napełnić bombę tlenem do ciśnienia 25 kG / cm2.
Tak przygotowaną bombę kalometryczną włożyć do naczynia kalometrycznego (bomba powinna być całkowicie zanurzona).
Połączyć bombę z przewodem elektrycznym za pomocą kołków kontaktowych.
Nakryć kalorymetr pokrywą dwudzielną umieszczając w naczyniu kalometrycznym termometr i mieszadło.
Włączyć zestaw do sieci.
Dokonać pomiaru temperatury (odczytując przez lupę wskazania termometru (8) z dokładnością do 0,005oC) co 30 sekund w trzech etapach:
Pierwszy etap składa się z 10-ciu odczytów, w czasie których następuje wyrównanie temperatury wody w naczyniu kalometrycznym.
Drugi etap rozpocząć od spalenia próbki przez włączenie przycisku zapłonowego (22) (zapłon sygnalizuje czerwona lampka kontrolna (15)) i następnie dokonać 10-ciu odczytów temperatury.
Etap trzeci, to dziesięć dalszych odczytów temperatury w odstępach co 30 sek.
Odczyty temperatury z trzech etapów wpisać do tabeli pomiarowej.
Po wykonaniu pomiarów należy: wyłączyć z sieci zestaw kalometryczny, wyjąć
termometr, wyjąć bombę kalometryczną, wypuścić z bomby kalometrycznej gazy
spalinowe i usunąć wodę z naczynia kalometrycznego.
OBLICZENIA:
k = 3185 cal / oC
p = 0,007 oC
Σe = 8,32 cal
t1 = 23,68 oC
t = 21,61 oC
m = 984 mg = 984 ⋅ 10-3 g
WNIOSKI
Podczas pierwszych odczytów z termometru temperatura wody minimalnie wzrosła. Po spaleniu próbki sproszkowanego paliwa temperatura wody podskoczyła o 0,79oC i do momentu 10-tego odczytu wzrosła do 23,68 oC. Różnica między pierwszym (21.53 oC), a ostatnim odczytem temperatury (23,78 oC) z trzeciego etapu pomiarów wynosi 2,19 oC. W końcowym efekcie ciepło spalania kwasu benzoesowego wyniosło Wg= 6669 cal/g.
Wyszukiwarka
Podobne podstrony:
Pomiar wartości opałowej
Pomiary ciepła spalania i wartości opałowej paliw gazowych
Pomiary ciepła spalania i wartości opałowej paliw gazowych
systemy, sciaga na systemy, Paliwo umowne to hipotetyczne paliwo mające wartość opałową ok
Oznaczanie ciepła spalania i obliczanie wartości opałowej
Ciepło spalania i wartość opałowa paliw stałych
cieplo spalania i wartosc opalowa, SPRAWKA
wyznaczanie ciepla spalania i wartosci opalowej paliw cieklych i gazowych
Oznaczanie ciepła spalania i wartości opałowej paliw gazowych
Badanie wartosci opalowej paliw gazowych
Specyfikacja techniczna(sensory), dokumenty, Sensory i pomiary wartości nieelektrycznych
Wartośc opałowa gazów
Ciepło spalania i wartość Opałowa Bomba Kalorymetryczna
Pomiar wartości przyspieszenia ziemskiego za pomocą wahadła matematycznego, fizycznego rewersyjnego
Ciepło spalania i wartość opałowa paliw stałych
Silnik BAEL i LFS pomiar wartości Bloku VAG
Silnik AFB pomiar wartości Bloku VAG
Ciepło spalania i wartość opałowa GZ 50
więcej podobnych podstron