Wyznaczanie stosunku ciepła właściwego gazu przy stałym ciśnieniu do ciepła właściwego przy stałej objętości (Cp/Cv)
Parametry termodynamiczne określające stan gazu to: ciśnienie p, temperatura T w skali bezwzględnej i objętość V. Ciśnienie i temperatura są to wielkości makroskopowe, których sensu fizycznego należy szukać w teorii kinetyczno-molekularnej budowy substancji. Według tej teorii cząsteczki gazu są w ciągłym bezładnym (chaotycznym) ruchu. Cząsteczki gazu doskonałego nie oddziałują miedzy sobą, a przy spotkaniu zderzają się sprężyście. Przy zderzeniach sprężystych ze ścianką naczynia zachodzi zmiana pędu cząsteczek gazu. Zgodnie z II zasadą dynamiki zmiana pędu ciała równa się popędowi siły, czyli na ściankę naczynia działa siła. Siła ta podzielona przez pole powierzchni ścianki jest ciśnieniem p, jakie wywiera gaz na ściankę naczynia. Dla gazu doskonałego, którego cząsteczki mają trzy stopnie swobody, ciśnienie p wyraża się wzorem:
gdzie:
no - liczba cząsteczek gazu w jednostce objętości,
m - masa jednej cząsteczki,
- średnia prędkość cząsteczek.
Wzór powyższy nazywa się podstawowym równaniem teorii kinetyczno--molekularnej. Na podstawie założeń tej teorii, za pomocą parametrów określających molekularną strukturę gazu, został policzony parametr makroskopowy, jakim jest ciśnienie.
Jeżeli do wzoru wprowadzić gęstość p, równą liczbowo masie jednostkowej (n0 m), to wyrażenie na ciśnienie p przyjmie postać:
Z równania tego wynika, że ciśnienie, jakie wywiera gaz na ścianki naczynia, jest proporcjonalne do kwadratu średniej prędkości chaotycznego ruchu cząsteczek tego gazu. Jest to kinetyczna interpretacja wielkości makroskopowej, jaką jest ciśnienie, za pomocą wielkości określających mikrostrukturę gazu.
Równaniem stanu gazu doskonałego jest równanie Clapeyrona, które wyraża związek między trzema parametrami stanu gazu (p, V, T).
gdzie:
V- obj. jednego mola gazu,
R - stała gazowa 8,32
T - temperatura w skali bezwzględnej.
Zgodnie z kinetyczno-molekularną teorią gazu doskonałego można definicję temperatury zapisać następująco:
gdzie:
E - średnia energia kinetyczna chaotycznego ruchu cząsteczek gazu.
Ze powyższego związku matematycznego wynika, że temperatura gazu jest proporcjonalna do średniej energii kinetycznej chaotycznego ruchu cząsteczek tego gazu. Jest to kinetyczna interpretacja wielkości makroskopowej, jaką jest temperatura, za pomocą wielkości opisujących mikrostrukturę gazu.
Związek średniej energii kinetycznej ruchu postępowego cząsteczek gazu z wielkością makroskopową, jaką jest temperatura T można otrzymać z równania ciśnienia p. Po pomnożeniu obustronnie przez objętość jednego mola Vμ otrzymujemy:
Iloczyn n0Vμ określa liczbę cząsteczek gazu w objętości jednego mola, a zatem równa się liczbie Avogadra
, możemy wobec tego napisać:
Wykorzystując równanie Clapeyrona oraz równanie powyższe, otrzymamy układ równań, w których lewe strony są sobie równe. Porównując prawe strony tych równań otrzymujemy:
stąd
Stosunek
nazywa się stała Boltzmanna. Przy jego uwzględnieniu ostatecznie wyrażenie na średnią energię kinematyczną cząsteczek gazu w funkcji temperatury ma postać:
Cząsteczki gazu doskonałego mają trzy stopnie swobody. Możemy wykazać, że na każdy stopień swobody cząsteczki przypada średnio taka sama energia kinetyczna, równa 1/2 kT. Jest to tzw. prawo ekwipartycji energii, jedno z podstawowych stwierdzeń klasycznej fizyki statystycznej i termodynamiki.
Właściwości makroskopowe gazu opisują zasady termodynamiki. Pierwsza zasada termodynamiki mówi, że zmiana energii wewnętrznej układu ΔU równa się sumie algebraicznej ciepła Q, przekazywanego w czasie procesu i wykonywanej pracy W
Wielkość Q jest dodatnia, gdy układ pobiera ciepło, ujemna - gdy oddaje. Podobnie wielkość W jest dodatnia, gdy praca jest wykonywana nad układem, ujemna - gdy układ wykonuje pracę. Jeżeli Q = 0 oraz W = 0, to ΔU = 0, czyli U = const.
Procesy adiabatyczne. Procesy adiabatyczne są to takie przemiany gazowe, które zachodzą bez wymiany ciepła z otoczeniem. Pierwsza zasada termodynamiki przyjmuje postać:
gdzie:
ΔU - wzrost lub ubytek energii wewnętrznej, zależnie od znaku W.
Energia wewnętrzna 1 mola gazu doskonałego jako funkcja temperatury ma następującą postać:
dzie:
Cv - molowe ciepło właściwe gazu przy stałej objętości.
Przyrost energii wewnętrznej na skutek zmiany temperatury oblicza się przez zróżniczkowanie względem temperatury wyrażenia.
Praca, jaką wykonuje gaz przy adiabatycznym zwiększeniu objętości o dowolnie małą wartość dV, równa się:
Biorąc powyższe pod uwagę, dla dowolnie małych zmian energii wewnętrznej dU, I zasadę termodynamiki dla procesów adiabatycznych można zapisać w postaci:
Wartość ciśnienia jakie wywiera gaz na ścianki naczynia, wynika z równania Clapeyrona:
Podstawiając tę wielkość do równania
i przekształcając je, otrzymamy:
Całkując otrzymane równanie w granicach zmian objętości i temperatury
otrzymuje się równanie Poissona:
lub
gdzie:
-molowe ciepło właściwe przy stałym ciśnieniu gazu
Cp - molowe ciepło właściwe przy stałym ciśnieniu gazu.
Z równania tego wynika, że przy adiabatycznej zmianie objętości gazu zachodzi zmiana jego temperatury.
Molowe ciepło właściwe przy stałym ciśnieniu gazu Cp jest większe od molowego ciepła właściwego przy stałej objętości gazu Cv o wartość pracy, jaką gaz wykonuje przy zwiększeniu objętości dla zachowania stałego ciśnienia podczas ogrzewania o jeden stopień.
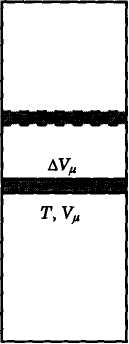
Obliczamy wartość pracy W, zakładając, że gaz jest zamknięty w naczyniu z ruchomym tłokiem, ciśnienie gazu w naczyniu wynosi p, objętość naczynia Vμ ,a temperatura gazu T.
Jeżeli gaz ogrzewamy, to jego objętość wzrośnie o ΔVμ , czyli tłok przesuwa się o Δh. Pracę, jaką wykonał gaz, przesuwając tłok o powierzchni S na odcinku Δh, oblicza się ze wzoru:
Objętość gazu po rozprężeniu wynosi Vμ'. W związku z tym, że:
to równanie na pracę można zapisać:
Jeżeli gaz ogrzejemy o jeden stopień, to podstawiając do powyższego równania
oraz
otrzymuje się:
czyli
Cp=Cv+R
a więc
Cp>Cv
Z otrzymanej równości wynika sens fizyczny stałej gazowej. Stała gazowa R jest równa liczbowo pracy wykonanej przez jeden mol gazu doskonałego pod stałym ciśnieniem przy rozprężeniu podczas ogrzewania go o jeden stopień.
Metoda pomiaru.
W dużym naczyniu szklanym B jest gaz (w tym ćwiczeniu powietrze) pod ciśnieniem nieco wyższym od atmosferycznego - równym p + p1. Jeżeli otworzymy korek K i po chwili zamkniemy, to ciśnienie gazu w naczyniu zrówna się z ciśnieniem atmosferycznym. Proces ten zachodzi bardzo szybko, więc możemy uważać, że przy przejściu ze stanu I do stanu II nastąpiło 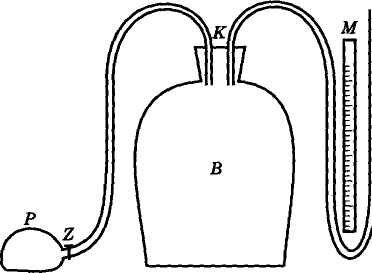
adiabatyczne rozprężenie gazu.
P — pompka
Z - zaworek
K - korek
B - pojemnik
M— manometr
Zgodnie z prawem Poissona zachodzi następująca zależność:
gdzie:
p - ciśnienie atmosferyczne,
V1 - objętość gazu przed rozprężeniem (objętość naczynia B),
V2 - objętość gazu po rozprężeniu.
Przy adiabatycznym rozprężeniu gaz ulega oziębieniu. Po pewnym czasie, na skutek wymiany ciepła z otoczeniem, temperatura gazu w naczyniu zrówna się z temperaturą otoczenia i wytworzy się nadwyżka ciśnienia p2. Objętość nie ulega zmianie, a więc przy przejściu ze stanu II do stanu III mamy przemianę izochoryczną.
Rozpatrując stan początkowy i końcowy gazu, który poddajemy przemianom, a więc przejście od stanu I do III, widzimy, że jest to proces izotermiczny, ponieważ w obu stanach temperatura gazu równa się temperaturze otoczenia. Nadwyżka ciśnienia p2 jest bardzo mała w porównaniu z ciśnieniem atmosferycznym, słuszne więc jest tu, z pewnym przybliżeniem, równanie Boyle'a i Mariotte'a, zapisane następująco:
Przekształcając dalej otrzymujemy:
a po logarytmowaniu:
Rozwijając ln(p + p1) na szereg otrzymamy:
Analogicznie rozwijamy ln(p+p2). W związku z tym, że p>p1 oraz p>p2, wyrazy drugiego i wyższych rzędów opuszczamy, a więc:
Nadciśnienia p1 i p2 można wyrazić za pomocą różnicy poziomów h1 i h2 cieczy w manometrze:
gdzie:
ρ-gęstość cieczy
g-przyśpieszenie ziemskie
Wzór przyjmuje więc postać:
Wykonanie pomiaru:
Otworzyć zaworek Z i za pomocą pompki A sprężyć powietrze w naczyniu B. Zamknąć zaworek Z i czekać na wyrównanie temperatury między gazem a otoczeniem (poznajemy po ustaleniu wahań cieczy w manometrze). Odczytać nadciśnienie h1 (w mm) ze skali manometru M.
Wyjąć korek K i po wyrównaniu się ciśnienia z ciśnieniem atmosferycznym natychmiast zamknąć butlę korkiem. Na skutek ogrzewania się powietrze w naczyniu powstaje nadciśnienie h2, które wskazuje manometr.
Pomiar wykonać kilka razy (ok. 10). Ze wzoru
obliczyć
. Wyniki zestawić w tabelce.Obliczyć niepewności wyniku pomiaru
Nr pomiaru |
toC |
h1 |
h2 |
h1-h2 |
|
|
|
|
|
|
|
Obliczanie niepewności pomiaru kappa.
Pomiar przeprowadzamy n razy (minimum 10 razy). Jest to jedno z niewielu doświadczeń, w którym do oceny niepewności wyznaczanej wielkości możemy zastosować metodę typu A. Najlepszą estymatą wartości
wielkości jest średnia arytmetyczna uzyskanych wyników. Odchylenie standardowe średniej wyników pomiaru s(
) określa zależność:
Najlepszą estymatą niepewności standardowej wartości (
) jest odchylenie standardowe obliczone na podstawie powyższego wzoru. Niezależnie możemy jeszcze oszacować niepewność pojedynczego pomiaru
, stosując metodę typu B. W tym przypadku musimy założyć, że wielkości bezpośrednio mierzone czyli h1 i h2 znajdują się w określonym przedziale o szerokościach połówkowych odpowiednio Δh1 i Δh2. Jeżeli założymy, że rozkład prawdopodobieństwa znalezienia tych wartości w określonych przedziałach jest rozkładem prostokątnym, niepewność standardowa wartości h1 i h2 wyniesie odpowiednio:
i
zatem złożoną niepewność standardową wielkości
obliczymy ze wzoru:
co po podstawieniu pochodnych cząstkowych daje wyrażenie:
po przekształceniu i skorzystaniu z faktu, że Δh1= Δh2= Δh otrzymujemy:
Wyszukiwarka
Podobne podstrony:
Wyznaczanie stosunku molowego ciepła właściwego gazu przy stałym ciśnieniu do molowego ciepła właści
WYZNACZANIE ZALEZNOSCI CIEPLA WLASCIWEGO CIAL STALYCH OD TEMPERATURY 2
,Laboratorium podstaw fizyki, WYZNACZANIE ZALEZNOSCI CIEPLA WLASCIWEGO CIAL STALYCH OD TEMPERATURYx
,laboratorium podstaw fizyki,WYZNACZANIE ZALEZNOSCI CIEPLA WLASCIWEGO CIAL STALYCH OD TEMPERATURY
Wyznaczanie zależności ciepła właściwego ciał stałych od temperatury
wyznaczanie Ciepła właściwego ciał stałych - 1
Wyznaczanie ciepła właściwego ciał stałych, Automatyka i Robotyka Rok I
Wyznaczanie ciepła właściwego ciał stałych, Automatyka i Robotyka Rok I
18, Wyznaczanie ciepła właściwego cieczy w stałym ciśnieniu metodą elektryczną, Artur Grudziński
wyznaczanie ciepła właściego ciał stałych, Transport i Logistyka (AM) 1 (semestr I), Fizyka, fiza la
SPR26, Studia, Pracownie, I pracownia, 26 Wyznaczanie ciepła właściwego ciał stałych metodą kaloryme
Wyznaczanie ciepła właściwego metali..., studia, fizyka
C1- Wyznaczanie ciepła topnienia lodu przy pomocy kalorymetru. sprawozdanie, Sprawozdania
Wyznaczanie ciepła topnienia lodu przy pomocy kalorymetru, Studia, Pracownie, I pracownia
Wyznaczanie ciepla własciwego ciała stał, Budownictwo-studia, fizyka
Wyznaczenie ciepła własciwego, Studia, Pracownie, I pracownia, 26 Wyznaczanie ciepła właściwego ciał
INSTRUKCJE, cw26, WYZNACZANIE CIEPŁA WŁAŚCIWEGO CIAŁ STAŁYCH
26 Wyznaczanie ciepła właściwego ciał stałych metodą kalorymetryczną G Szcześniak
więcej podobnych podstron