Laboratorium 18 O Z N A C Z A N I E F I Z J O L O G I C Z N Y C H S K Ł A D N I K Ó W
M O C Z U
Ćwiczenie 1. Reakcja mocznika z kwasem azotowym (V).
Zasada:
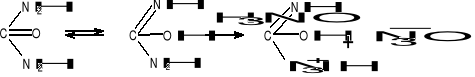
Mocznik, reagując z kwasem azotowym (V), tworzy trudno rozpuszczalny azotan (V) mocznika.
Wykonanie:
Do probówki odmierz 1 mL roztworu mocznika i dodaj 2 krople stężonego roztworu HNO3-. Zaobserwuj wytrącające się kryształy azotanu (V) mocznika.
Ćwiczenie 2. Wykrywanie kreatyniny.
metoda Weyla
Do 2 mL moczu dodaj 4 krople roztworu nitroprusydku sodu i 1 mL 2 M roztworu NaOH. Zaobserwuj pojawienie się czerwonej barwy, która znika natychmiast po zakwaszeniu 20% roztworem kwasu octowego (przy nieobecności acetonu w moczu).
metoda Jaffe'go
Do 1 mL moczu dodaj 1 mL wody destylowanej oraz 1 mL nasyconego roztworu kwasu pikrynowego. Następnie dodaj 4-5 kropli 2 M roztworu NaOH w celu zalkalizowania roztworu. Zaobserwuj pojawienie się pomarańczowo-czerwonego zabarwienia.
Ćwiczenie 3. Wykrywanie indykanu metodą Denigesa.
Do 2 mL moczu dodaj 1 mL chloroformu, 2 mL stężonego roztworu HCl oraz 3-4 krople KMnO4. Silnie wytrząśnij zawartość probówki. W przypadku obecności indykanu w moczu, pojawi się niebieskie zabarwienie warstwy chloroformowej (błękit indygo).
Ćwiczenie 4. Reakcja Ehrlicha na urobilinogen.
Do 4 mL moczu dodaj 0,5 mL odczynnika aldehydowego Ehrlicha. W przypadku dużej zawartości urobilinogenu, roztwór zabarwi się na czerwono już na zimno. Przy prawidłowym stężeniu urobilinogenu zabarwienie pojawia się dopiero po podgrzaniu, dlatego wstaw próbę na 3-4 minuty do wrzącej łaźni wodnej. Następnie probówkę należy ostudzić, dodać 1 mL chloroformu i wytrząsać przez 2 minuty. Jeżeli barwnik przejdzie do warstwy chloroformowej, to oznacza, że pochodzi głównie z urobilinogenu.
Ćwiczenie 5. Użycie testu paskowego do szybkiej oceny ogólnych właściwości fizykochemicznych moczu.
Za pomocą wieloparametrowych pasków testowych można ocenić obecność w moczu takich składników, jak: leukocyty, bakterie (azotyny), erytrocyty, białka (albuminy), glukoza, ciała ketonowe (acetooctan), bilirubina, urobilinogen i kwas askorbinowy oraz pH i ciężar właściwy moczu.
W celu wykonania oznaczenia, zanurz wieloparametrowy pasek testowy w próbce moczu na około 30 sekund. Porównując barwy na polach testowych paska z barwną skalą, dokonaj półilościowej analizy poszczególnych parametrów.
Ćwiczenie 6. Oznaczanie stężenia kwasu δ-aminolewulinowego w moczu.
Zasada:
Kwas δ-aminolewulinowy zawarty w moczu reaguje w podwyższonej temperaturze z acetyloacetonem. Powstaje związek pirolowy, który w reakcji z aldehydem p-dimetyloaminobenzoesowym (zmodyfikowany odczynnik Ehrlicha) w środowisku kwaśnym daje barwny kompleks oznaczany spektrofotometrycznie przy długości fali λ = 550 nm. Prawidłowe stężenie kwasu δ-aminolewulinowego w moczu wynosi do 10,5 ng/L.
Wykonanie:
Przygotuj 2 probówki. Do pierwszej (próba badana) dodaj 0,5 mL moczu, 1 mL acetyloacetonu oraz 3,5 mL buforu octanowego o pH 4,6. Do drugiej probówki (próba ślepa) dodaj 0,5 mL moczu i 4,5 mL buforu octanowego (pH 4,6). Obie probówki wymieszaj, zakorkuj, wstaw do wrzącej łaźni wodnej na 10 minut, a następnie ostudź. Przygotuj kolejne dwie probówki, do których przenieś po 1 mL odpowiednio próby badanej i próby ślepej. Następnie dodaj do tych probówek po 1 mL zmodyfikowanego odczynnika Ehrlicha, wymieszaj i odstaw na 15 minut. Po upływie tego czasu zmierz absorbancję próby badanej względem próby ślepej przy długości fali λ = 550 nm. Na podstawie otrzymanej absorbancji odczytaj z krzywej kalibracyjnej stężenie kwasu δ-aminolewulinowego.
Ćwiczenie 7. Oznaczanie stężenia mocznika w surowicy krwi.
Zasada:
Stężenie mocznika oznacza się przy użyciu metody enzymatycznej - sprzężony test Warburga.
mocznik + 2 H2O → 2 NH4+ + CO32- E: ureaza
NH4+ + α-ketoglutaran + NADH → L-glutaminian + NAD+ + H2O E: dehydrogenaza glutaminianowa
Wykonanie:
Oznaczenie stężenia mocznika w surowicy krwi wykonaj zgodnie z załączoną instrukcją.
Ćwiczenie 8. Oznaczanie stężenia kreatyniny w surowicy krwi.
Zasada:
Stężenie kreatyniny oznacza się przy użyciu modyfikacji metody Jaffe'go. W wyniku reakcji pikrynianów z kreatyniną w środowisku alkalicznym powstaje pochodna 2,4,6-trinitro-cykloheksadienu o zabarwieniu żółtoczerwonym, którego intensywność jest wprost proporcjonalna do stężenia kreatyniny.
Wykonanie:
Oznaczenie stężenia kreatyniny w surowicy krwi wykonaj zgodnie z załączoną instrukcją.
Wyszukiwarka
Podobne podstrony:
Laboratorium 19, II rok, II rok CM UMK, Giełdy, od Joe, biochemia, BIOCHEMIA, GIEŁDY - KOLOKWIA, Gie
Laboratorium 11 OKSYDOREDUKTAZY, II rok, II rok CM UMK, Giełdy, od Joe, biochemia
MELATONINA, II rok, II rok CM UMK, Giełdy, od Joe, biochemia, BIOCHEMIA, GIEŁDY - EGZAMIN, Dodatkowe
integracja 1(1), II rok, II rok CM UMK, Giełdy, od Joe, biochemia, BIOCHEMIA, GIEŁDY - KOLOKWIA, Gie
Feromony wytwarzane są przez ciało każdego człowieka, II rok, II rok CM UMK, Giełdy, od Joe, biochem
Integracja kolo 2008 rozwiazane, II rok, II rok CM UMK, Giełdy, od Joe, biochemia, BIOCHEMIA, GIEŁDY
lab(1), II rok, II rok CM UMK, Giełdy, od Joe, biochemia, BIOCHEMIA, GIEŁDY - KOLOKWIA, Giełdy - PRA
integracja[1](1), II rok, II rok CM UMK, Giełdy, od Joe, biochemia, BIOCHEMIA, GIEŁDY - KOLOKWIA, Gi
Biochemia 2011 egzamin 100 opyta, II rok, II rok CM UMK, Giełdy, od Joe, biochemia, BIOCHEMIA, GIEŁD
CUKRY MATERIAŁY, II rok, II rok CM UMK, Giełdy, od Joe, biochemia, BIOCHEMIA, INNE
homocysteina, II rok, II rok CM UMK, Giełdy, od Joe, biochemia, BIOCHEMIA, GIEŁDY - EGZAMIN, Dodatko
więcej podobnych podstron