Białko - jest to naturalny polipeptyd czyli polimer aminokwasów połączonych ze sobą wiązaniami polipeptydowymi. Białka należą do najważniejszych związków organicznych, potrzebnych żywemu organizmowi .Można je znaleźć w niemal każdej części organizmu zwierząt, roślin, a nawet wirusów. Jest ono podstawą życia biologicznego.
Białka powstają w wyniku polikondensacji, czyli polimeryzacji z wydzielaniem związków małocząsteczkowych a-L-aminokwasów. Reakcja ta zachodzi przy udziale wyspecjalizowanych kompleksów enzymatycznych - rybosomów, we wszystkich komórkach organizmów żywych i jest określana mianem translacji.
Zsyntetyzowany w komórce łańcuch białkowy przypomina unoszącą się swobodnie w roztworze "nitkę", która może przyjąć dowolny kształt (w biofizyce nazywa się to kłębkiem statystycznym, ale ulega procesowi tzw. zwijania białka (ang. protein folding) tworząc mniej lub bardziej sztywną strukturę przestrzenną, zwaną strukturą lub konformacja białka "natywną". Tylko cząsteczki, które uległy zwinięciu do takiej struktury mogą pełnić właściwą danemu białku rolę biochemiczną. Ze względu na skalę przestrzenną pełną strukturę białka można opisać na czterech poziomach:
Struktura pierwszorzędowa białka, zwana również strukturą pierwotną - jest określona przez sekwencję (kolejność) aminokwasów w łańcuchu białkowym
Struktura drugorzędowa białka - są to lokalne struktury powstające w wyniku tworzenia się wiązań wodorowych pomiędzy tlenem grupy -C=O, a wodorem grupy -NH dwóch niezbyt odległych od siebie w łańcuchu wiązań peptydowych. Do struktur drugorzędowych zalicza się:
helisę - gł. helisę alfa (ang. α helix)
różne rodzaje beta kartki lub "pofałdowanej kartki" (ang. β sheet)
skręty (ang. turn)
Struktura trzeciorzędowa białka - Wzajemne położenie elementów struktury drugorzędowej stabilizowane przez oddziaływania reszt aminokwasowych oraz tworzenie mostków dwusiarczkowych -S-S- , powstających pomiędzy dwiema resztami cysteiny w łańcuchu.
Struktura czwartorzędowa białka - opisuje ilość i wzajemne ułożenie podjednostek cząsteczkowych (pojedynczych łańcuchów) białek.
Białka nie posiadają charakterystycznej dla siebie temperatury topnienia. Na ogół rozpuszczalne w wodzie. Niektóre z nich mogą rozpuszczać się w rozcieńczonych kwasach lub zasadach, jeszcze inne w rozpuszczalnikach organicznych. Posiadają zdolność wiązania cząsteczek wody. Efekt ten nazywamy hydratacją. Na rozpuszczalność polipeptydów ma wpływ stężenie soli nieorganicznych. Ich małe stężenie wpływa dodatnio na rozpuszczalność. Jednak przy większym stężeniu następuje uszkodzenie otoczki solwatacyjnej, co powoduje wypadanie białek z roztworu. Proces ten nie narusza struktury białka, więc jest odwracalny. Nosi też nazwę "wysalanie białek". Innym procesem jest wypadanie białek z roztworów pod wpływem soli metali ciężkich, mocnych kwasów i zasad, wysokiej temperatury, niskocząsteczkowych alkoholi i aldehydów - jest to wytrącanie w sposób nieodwracalny. Zjawisko to nosi nazwę denaturacji białek. Wywołuje ono zmiany w strukturze drugo- i trzeciorzędowej. Następuje rozerwanie wiązań wodorowych i rozerwanie mostków dwusiarczkowych. Wyjątek stanowią proste białka, które mogą ulegać także procesowi odwrotnemu, tzw. renaturacji.
Białka dzielimy na:
Ze względu na budowę i skład :
-Białka proste, zbudowane są wyłącznie z aminokwasów. Dzielimy je na następujące grupy:
protaminy - posiadają charakter silnie zasadowy, charakteryzują się dużą zawartością argininy oraz brakiem aminokwasów zawierających siarkę. Są dobrze rozpuszczalne w wodzie. Najbardziej znanymi protaminami są: klupeina, salmina, cyprynina, ezocyna, gallina.
histony - podobnie jak protaminy posiadają silny charakter zasadowy i są dobrze rozpuszczalne w wodzie. Są składnikami jąder komórkowych (w połączeniu z kwasem dezoksyrybonukleinowym), czyli są obecne także w erytroblastach. W ich skład wchodzi duża ilość takich aminokwasów jak lizyna i arginina.
albuminy - są to białka obojętne, spełniające szereg ważnych funkcji biologicznych: są enzymami, hormonami i innymi biologicznie czynnymi związkami. Są dobrze rozpuszczalne w wodzie i rozcieńczonych roztworach soli, łatwo ulegają koagulacji. Znajdują się w tkance mięśniowej, osoczu krwi i mleku.
globuliny - w odróżnieniu od albumin są źle rozpuszczalne w wodzie, dobrze w rozcieńczonych roztworach soli; posiadają podobne właściwości do nich. Występują w dużych ilościach w płynach ustrojowych i tkance mięśniowej.
prolaminy - są to typowe białka roślinne, występują w nasionach. Charakterystyczną właściwością jest zdolność rozpuszczania się w 70% etanolu.
gluteliny - podobnie jak prolaminy - są to typowe białka roślinne; posiadają zdolność rozpuszczania się w rozcieńczonych kwasach i zasadach.
skleroliny - nie rozpuszczalne w wodzie i rozcieńczonych roztworach soli. Są to typowe białka o budowie włóknistej, dzięki temu pełnią funkcje podporowe. Do tej grupy białek należy kreatyna.
-Białka złożone, cząsteczki zwierają nie tylko łańcuchy polipeptydowe, ale także składniki niepeptydowe. Np.: jony metalu
Ze względu na rozpuszczalność w wodzie:
- hydrofobowe, nierozpuszczalne. Występują najczęściej w błonach komórkowych.
- Hydrofilowe, rozpuszczalne. Występują najczęściej w cytoplazmie.
Ze wzlędu na pełnioną funkcję:
- enzymy
- zapasowe
- przeciwciała (białka ochronne)
- receptory
- transportujące
- hormony
- toksyny
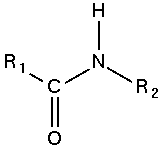
Wiązanie pomiędzy grupą karboksylową jednej cząsteczki, a grupą aminową drugiej nazywamy wiązaniami peptydowymi.
|
Wiązanie peptydowe |
Najczęściej obiema cząsteczkami są α-aminokwasy naturalne. polimery naturalne powstałe z połączenia aminokwasów wiązaniami peptydowymi to polipeptydy i białka. Wiązania peptydowe wystepują też w polimerach syntetycznych zwanych poliamidami, w tym przypadku jednak identyczne chemicznie wiązania są nazywane wiązaniami amidowymi.
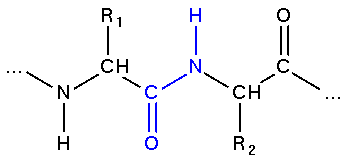
|
Fragment białka z zaznaczonym na niebiesko wiązaniem peptydowym |
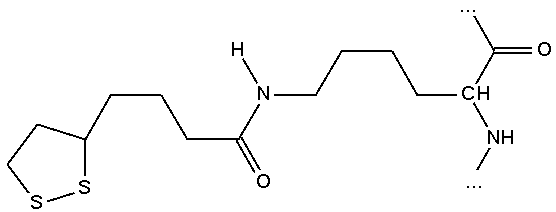
Wiązanie peptydowe tworzą też często łańcuchy boczne aminokwasów w białkach, takich jak lizyna, z cząsteczkami przyłączonymi do białka (koenzymami).
|
Połączenie lizyny białka z kwasem liponowym |
Białka mają następujące funkcje:
kataliza enzymatyczna - od uwadniania dwutlenku węgla do replikacji chromosomów,
transport i magazynowanie - hemoglobina, transferyna, ferrytyna,
kontrola przenikalności błon - regulacja stężenia metabolitów w komórce,
ruch uporządkowany - np. skurcz mięśnia, aktyna i miozyna
wytwarzanie i przekazywanie impulsów nerwowych,
kontrola wzrostu i różnicowania
Białka można wykryć dwoma sposobami. Za pomocą reakcji Biuretowej i ksantoproteinowej:
-Reakcja biuretowa polega na zmieszaniu białka z mieszaniną roztworu siarczku miedzi (II) i wodorotlenku potasu. W obecności białka ten roztwór zabarwia się na fioletowo-czerwony kolor, a w przypadku obecności polipeptydów na purpurowo
-Reakcja ksantoproteinowa jest to reakcja białek z kwasem azotowym (V), w wyniku której pojawia się żółtopomarańczowe zabarwienie roztworu.
Złożoność form oraz wzajemne powiązania wielu funkcji białek sprawia, że wyczerpujące opisanie tej najliczniejszej grupy związków organicznych wydaje się być niemożliwe.
W sumie jest to króciutki opis tej najszlachetniejszej formy architektonicznej stworzonej przez przyrodę.
Made by Manys®
Wyszukiwarka
Podobne podstrony:
Reakcje Hydrolizy, II Rok WIMiC inżynieria materiałowa AGH, Chemia, Chemia -, Chemia - Laborki
Sprawozdanie 5 GIG B, II Rok WIMiC inżynieria materiałowa AGH, Chemia, Chemia -, Chemia - Laborki, S
czesc2.1, II Rok WIMiC inżynieria materiałowa AGH, Obierak, mechanika
iloslab, II Rok WIMiC inżynieria materiałowa AGH, Chemia, Chemia -, laborki
zadanie zginanie - czesto je daja na kolach!!!, ZiIP, II Rok ZIP, Wytrzymałość materiałów, Wytrzymał
wydyma statyczna próba skręcania, ZiIP, II Rok ZIP, Wytrzymałość materiałów, Labv.wytrzymalosc
Sprawozdanie 4 GIG B chemia labor, II Rok WIMiC inżynieria materiałowa AGH, Chemia, Chemia -, Chemia
pkmy, II Rok WIMiC inżynieria materiałowa AGH, Obierak, mechanika, PKM, PKM
materiay II rok, DIAGNOZA, SWPS materiały, pytania
statyka-sc, ZiIP, II Rok ZIP, Wytrzymałość materiałów, Wytrzymałość materiałów
materiay II rok, DIAGNOZA, SWPS materiały, pytania
Sprawozdanie 6 GIG B chemia labor, II Rok WIMiC inżynieria materiałowa AGH, Chemia, Chemia -, Chemia
LABORA~2, ZiIP, II Rok ZIP, Wytrzymałość materiałów, Wytrzymałość materiałów, Wytrzymałość materiałó
wydyma pomiar twardości metodą Brinella Wickersa i Poldi, ZiIP, II Rok ZIP, Wytrzymałość materiałów,
materiay II rok, DIAGNOZA, SWPS materiały, pytania
SPRAWOZDANIE NR 3, II Rok WIMiC inżynieria materiałowa AGH, Chemia, Chemia -, Chemia - Laborki, redo
Sprawozdanie 3 GIG B chemia labor, II Rok WIMiC inżynieria materiałowa AGH, Chemia, Chemia -, Chemia
więcej podobnych podstron