CHEMIA- REAKCJE W ROZTOWRACH WODNYCH ELEKTROLITÓW
Dysocjacja jonowa/ elektrolityczna- rozpad elektrolity na jony pod wpływem wody.
Dysocjacji ulegają:
Kwasy dobrze rozpuszczalne w wodzie- dysocjują na kation wodoru i anion reszty kwasowej
HnR nH+ + Rn-
Kwasy wieloprotonowe
H2CO3 H+ + HCO3- anion wodorowęglanowy
HCO3- H+ + CO32- anion węglanowy
∑ H2CO3 2H+ + CO32-
Zasady - pod wpływem wody dysocjują na kationy metalu i aniony wodorotlenkowe
M(OH)n Mn+ + nOH-
Zasady wielowodorotlenkowe
Ca(OH)2 CaOH+ + OH-
CaOH+ Ca2+ + OH-
∑ CA(OH)2 Ca2+ + 2OH -
Sole dobrze rozpuszczalne w wodzie dysocjują na kation metalu i anion reszty kwasowej
MmRn mMn+ + nRm-
Elektrolit - substancja dobrze przewodząca prąd w roztworze wody.
Słabe α < 5%
Średnie 5%< α < 30% H3PO3
Mocne 30% < α < 100% HCl, HNO3, HClO4, H2SO4 , sole dobrze rozpuszczalne w wodzie, wodorotlenki metal gr 1 i 2, bez Mg(OH)2, Be(OH)2
Stopień dysocjacji - stosunek l. moli zdysocjowanych do liczby mol wprowadzonych
α=
• 100% nz- liczba moli cząsteczek zdysocjowanych; nw - liczba moli cząsteczek wprowadzonych
[α]= 0< α< 100%
α zależy od :
Rodzaju elektrolitu
Temperatury jeśli T rośnie to i α rośnie
Rozcieńczenia- im większe tym większe α
Reakcja zobojętniania= neutralizacji - łączenie się jonów wodoru H+ z jonami wodorotlenkowymi OH- i powstaniu niezdysocjowanej cząsteczki H2O
KOH + HCl - KCl + H2O zapis cząsteczkowy
K+ + OH- + H+ + Cl- K+ +Cl- + H2O zapis jonowy
OH- + H= H2O
Zobojętnianie niecałkowite
KOH + H2CO3 KHCO3 + H2O
K+ +OH- + H+ HCO-3 K+ + HCO-3 +H2O
OH - + H+ H2O
Reakcja wytrącania osadów- reakcja między jonami, które łącząc się dają trudno rozpuszczalny związek
Pb(NO3)2 + 2 KI PBI2 ↓ + 2KNO3
Pb2+ +2NO3- + 2K+ +2I- PbI2 ↓ +2K+ + 2NO3-
Pb2+ + 2I- PbI2 ↓
Skala pH
HnR nH+ + Rn-
H(OH)n Hn+ + n OH-
nH+ > n OH - kwas
nH+ = nOH - obojętny
nH+ < nOH- zasadowy
|
Kwas |
Obojętny |
zasada |
Fenoloftaleina |
Bezbarwna |
Bezbarwna |
Malinowa |
Lakmus |
Czerwony |
Fioletowy |
Niebieski |
Oranż metylowy |
Czerwony |
Pomarańczowy |
Żółty |
Pasek wskaźnikowy |
Czerwony |
Żółty |
Niebieski |
Błękit bromotymolowy |
Czerwony |
Żółty |
Niebieski |
Pehametry- urządzenia do badania pH
pH- wskaźnik zasadowości lub kwasowości roztworów ; zależy od stężenia jonów H+
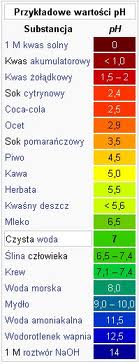
pH = -log[H+]
[H+]= 0,001 mol/dm3 = 10-3
pH= - log 10 -3= 3
pOH= -log[OH-]
pH+ pOH=14
[OH-]= 10 -pOH-
[H+]=10-pH+
[H+] • [OH-]=10-14
[OH-]>10-7 zasadowy
[OH-]< 10-7 kwasowy
[H+]> 10 -7 kwasowy
[H+] <10-7 zasadowy
Hydroliza soli- reakcja soli z wodą w wyniku, której powstaje kwas i zasada. Odczyn soli zależy od tego co jest silniejsze
Hydroliza anionowa - mocna zasada + słaby kwas
Na2CO3 + H2O NaOH + H2O + CO2
2Na + + CO32- +2H2O 2Na+ + 2OH- + H2O +CO2
CO32- + 2H2O 2OH- +H2O + CO2 odczyn zasadowy
Hydroliza kationowa- słaba zasada + mocny kwas
Fe(NO3)2 + H2O Fe(OH)2 + 2HNO3
Fe2+ + 2NO3- + H2O Fe(OH)2 + 2H+ + 2 NO3-
Fe2++ H2O Fe(OH)2 + 2H+ odczyn kwasowy
Hydroliza kationowo- anionowa - słaba zasada + słaby kwas
(NH4)2Co3 +H2O 2NH3 • H2O + CO2 +H2O
2NH4+ + CO32- +H2O 2NH3 • H2O + H2O + CO2
Mocny kwas+ mocna zasada- nie ulega dysocjacji
Wyszukiwarka
Podobne podstrony:
CHEMIA REAKCJE W ROZTOWRACH WODNYCH ELEKTROLITÓW
reakcje w roztworach wodnych, Studia, I rok, I rok, I semestr, Chemia I
reakcje w roztworach wodnych, Nauka, CHEMIA, Szkoła, Chemia ogólna
Reakcje w roztworach wodnych, chemia
TEST CHEMIA – reakcje w roztworach wodny elektrolitów
1 5 1 Reakcje w roztworach wodnych
1 5 2 Reakcje w roztworach wodnych +Odpowiedzi
reakcje aromatycznej substytucji elektrofilowej
Arkusz WSiP Reakcje w roztworach wodnych
reakcje w roztworach wodnych
1 5 2 Reakcje w roztworach wodnych +Odpowiedzi
04 2 Bilansowanie równań reakcji redoks metodą elektronowo jonową
więcej podobnych podstron