Woda jako najpowszechniejszy tlenek na kuli ziemskiej. Omów jej właściwości, rodzaje i sposoby ochrony jej zasobów przed degradacją.
Woda, H2O, jest to tlenek wodoru, bezbarwna ciecz (w grubych warstwach niebieskozielona), pozbawiona zapachu i smaku. Temperatura topnienia 0°C (może być przechłodzona do temperatury -46°C), temperatura wrzenia 100°C, temperatura krytyczna 374°C, ciepło topnienia (0°C) 6,01 kJ/mol, ciepło parowania (25°C) 44,01 kJ/mol, stała ebuliometryczna 0,512 K×kg/mol, stała kriometryczna 1,86 K×kg/mol, gęstość 1g/cm3, lepkość (20°C) 1,0×10-3 Pa×s, napięcie powierzchniowe (20°C) 72,75 J/m2, przewodnictwo właściwe (18°C) 4,2×10-8 W-1cm-1, względna przenikalność elektryczna (20°C) 80,20, moment dipolowy 1,84 D, współczynnik załamania światła (589,0 nm) 1,33.
Orbitale tlenu w cząsteczce wody ulegają hybrydyzacji typu sp3. Kąt między wiązaniami H-O-H wynosi 104,5°, są one spolaryzowane. Cząsteczki wody tworzą asocjaty (asocjacja). W nieznacznym stopniu ulega ona autoprotolizie zgodnie z równaniem
2H2O = H3O+ + OH-. Jony rozpuszczone w wodzie są hydratowane (hydratacja). Jej cząsteczki mogą spełniać rolę ligandu w związkach kompleksowych.
Łatwo wchodzi w reakcje chemiczne z wieloma substancjami, np. z metalami alkalicznymi, fluorem, niektórymi tlenkami metali i niemetali. Woda należy do najbardziej rozpowszechnionych związków w przyrodzie, stanowi składnik organizmów żywych.
W przemyśle stosowana jest jako rozpuszczalnik, para grzejna lub medium chłodzące, surowiec chemiczny, moderator w reaktorach jądrowych.
Woda znajdująca się na powierzchni Ziemi tworzy hydrosferę i jest przedmiotem badań działu geografii zwanego hydrografią, przy czym nauka ta zajmuje się także wodami podziemnymi. Woda na Ziemi występuje w postaci stałej (lodowce, lądolody, pokrywa śnieżna), ciekłej (oceany, rzeki, jeziora) i gazowej (para wodna). Ciągłe krążenie wody w przyrodzie opisuje cykl hydrologiczny.
Szacuje się, że wszystkie rodzaje wód łącznie mają objętość 1360 mln km3, z czego 97% to wody oceanów. Funkcje wody w środowisku geograficznym rzeźbotwórcza (akumulacja rzeczna i lodowcowa, erozja rzeczna i lodowcowa), skałotwórcza (osady morskie z minionych epok geologicznych), magazyn ciepła (para wodna w atmosferze), rozpuszczalnik związków organicznych (woda w glebie), źródło pożywienia dla człowieka (rybołówstwo), droga transportowa (żegluga), źródło energii (hydroelektrownie).
Wody powierzchniowe klasyfikuje się wg: zasolenia, zawartości składników mineralnych (np. wody oligotroficzne, eutroficzne), temperatury (prądy morskie ciepłe i zimne, stratyfikacja termiczna jeziora), możliwości przemieszczania się (wody płynące - rzeki, strumienie i stojące - jeziora, bagna).
Wody podziemne klasyfikuje się wg: występowania w warstwach skalnych (np. artezyjskie), mineralizacji, rodzaju mineralizacji (solanka, wody siarczane (z rozpuszczonym siarczanem wapnia), szczawy), temperatury (cieplice), dostępności dla roślin (woda glebowa), głębokości zwierciadła wody podziemnej (podziemne wody), pochodzenia (np. wody juwenilne, kondensacyjne).
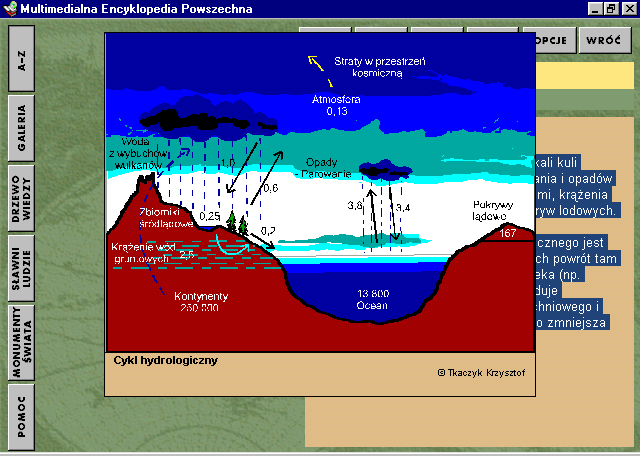
Cykl hydrologiczny, inaczej obieg wody w skali kuli ziemskiej, obejmujący procesy parowania i opadów nad morzami i zbiornikami śródlądowymi, krążenia wód gruntowych i zmian zasobów pokryw lodowych.
Charakterystyczne dla cyklu hydrologicznego jest większe parowanie wody z mórz, niż ich powrót tam w postaci opadów. Działalność człowieka (np. wycinanie lasów, antropopresja) powoduje zwiększenie wartości spływu powierzchniowego i obniżenie poziomu wód gruntowych, co zmniejsza zasoby wód podziemnych.
W chemii wyróżnia się wody:
Woda amoniakalna, wodny roztwór amoniaku (NH3) o stężeniu 10-25% - bezbarwna ciecz o zapachu amoniaku. Stosowana jest do otrzymywania amoniaku, produkcji bawników i gumy, a także w analizie chemicznej.
Woda barytowa, nasycony, bezbarwny roztwór wodorotlenku baru Ba(OH)2 - silna zasada. Znajduje zastosowanie w chemii analitycznej jako odczynnik na jony siarczanowe SO
i węglanowe CO
. Winna być przechowywana w szczelnie zamkniętych, polietylenowych naczyniach.Woda bromowa, nasycony, wodny roztwór bromu o barwie brunatnej. Poza cząsteczkami Br2, na skutek przebiegającej w niej reakcji chemicznej, zawiera także HBr i HBrO. Wodę bromową przechowuje się w naczyniach z ciemnego szkła. Znajduje ona zastosowanie jako środek utleniający.
Woda destylowana, aqua destillata, woda oczyszczona ze składników mineralnych i gazów na skutek destylacji. Do specjalnych celów (np. w analizie śladowej) stosowana jest woda podwójnie destylowana (aqua bidestillata albo aqua redestillata) lub destylowana wielokrotnie. Wody destylowanej używa się powszechnie w laboratoriach analitycznych, w niektórych gałęziach przemysłu, do sporządzania wody do iniekcji.
Woda gazowana, woda sodowa, woda nasycona dwutlenkiem węgla pod zwiększonym ciśnieniem. Może zawierać dodatkowo substancje smakowe i zapachowe.
Woda Goularda, woda gulardowa, aqua plumbi goulardi, wodny roztwór octanu ołowiu(II) Pb(CH3COO)2 i tlenku ołowiu(II) PbO z dodatkiem etanolu. Woda Goularda była dawniej stosowana jako środek ściągający i wysuszający.
Aqua regia, woda królewska, mieszanina stężonego kwasu solnego i stężonego kwasu azotowego w stosunku objętościowym 3:1. Produktem reakcji między kwasami jest chlorek nitrozylu i chlor, dzięki czemu aqua regia ma silne działanie utleniające. Aqua regia rozpuszcza m.in. złoto i platynę.
Woda krystalizacyjna, woda występująca w hydratach w stosunku stechiometrycznym.
Morska woda, woda mórz i oceanów, zawierająca rozpuszczone sole. Woda (H2O) stanowi 96,5% masy morskiej wody, reszta to głównie: chlor (55%) i sód (30%), a także siarka (jako SO4, 8%), magnez (4%), wapń (1%) i potas (1%). Zawartość soli w morskiej wodzie powoduje jej zasolenie, które jest różne dla poszczególnych mórz, części oceanu i które czyni morską wodę nieprzydatną do spożycia dla człowieka i zwierząt lądowych.
Woda pogazowa, produkt uboczny otrzymywany podczas odgazowywania stałych paliw naturalnych, głównie węgli kopalnych. Stanowi mieszaninę zawierającą amoniak, sole amonowe ((NH4)CO3, NH4Cl, (NH4)2S, (NH4)2SO4, (NH4)2S2O3, NH4SCN), pirydynę, fenole i in. związki. Jest surowcem do otrzymywania amoniaku i siarczanu amonu.
Woda utleniona, roztwór wodny nadtlenku wodoru zawierający 3% H2O2. Stosowana do odkażania ran.
Woda wapienna, aqua calcis, nasycony roztwór wodny wodorotlenku wapnia Ca(OH)2, wykazuje odczyn silnie alkaliczny. Znajduje zastosowanie w analizie chemicznej jako odczynnik na CO2 oraz w medycynie jako środek ściągający i wysuszający, a wewnętrznie jako odtrutka po zatruciu kwasami.
Wyszukiwarka
Podobne podstrony:
Krainy roślinne i zwierzęce na kuli ziemskiej
Glebą nazywamy luźną powierzchniowo warstwę lądu na kuli ziemskiej (2)
Wiatry na kuli ziemskiej
klimaty na kuli ziemskiej
ROZMIESZCZENIE LĄDÓW I OCEANÓW NA KULI ZIEMSKIEJ, Konspekty lekcji
Zróżnicowanie języków na kuli ziemskiej, Filologia polska, Językoznawstwo
Geogr strefy klimatyczne na kuli ziemskiej, Referaty
Strefowość klimatyczna na Kuli Ziemskiej
praca z filozofii „Każdy człowiek na kuli ziemskiej ma skarb, który gdzieś na niego czeka ”
Formacje roślinne na kuli ziemskiej
Zróżnicowanie świata zwierzęcego na kuli ziemskiej
Omów właściwości, odmiany, otrzymywanie i znaczenie najpopularniejszego pierwiastka na Ziemi czyli t
astro, Nawigacja - 5-12 - Współrzędne geograficzne rzutu cn na powierzchnię kuli ziemskiej; AKP, alp
Na dowolnym przykładzie omów?chy epopei jako gatunku literackiego
woda jako składnik żywności oraz równowagi kwasowo- zasadowe w żywności, żywienie człowieka i ocena
NOWA Biografia jako tworzywo artystyczne na postawie życia i twórczości J Kochanowskiego i J Słowa
Wpływ wojny na psychikę ludzką Omów temat odwołując się do przykładów z literatury
Animacja kuli ziemskiej id 6491 Nieznany (2)
ciasto na kuli na karasia, Wędkarstwo
więcej podobnych podstron