Omów właściwości, odmiany, otrzymywanie i znaczenie najpopularniejszego pierwiastka na Ziemi czyli tlenu.
Tlen, O, oxygenium, pierwiastek chemiczny o liczbie atom. 8, masie atom. 15,9994; należy do grupy tlenowców; bezbarwny i bezwonny gaz, słabo rozpuszczalny w wodzie; temp. krzepnięcia -218,4°C, temp. skraplania -182,962°C, gęstość 1,4289 g/dm3; skroplony stanowi niebieską ciecz; występuje w 2 odmianach alotropowych: o cząsteczkach dwuatomowych O2 (dwutlen, tlen) i o cząsteczkach trójatomowych O3 (trójtlen, ozon); tlen ma właściwości paramagnet., jest silnie elektroujemny; w związkach występuje głównie na stopniu utlenienia -II (-I w nadtlenkach); w temperaturze pokojowej tlen jest stosunkowo mało aktywny chemicznie; większość reakcji łączenia się tlenu z innymi pierwiastkami przebiega z dużą szybkością dopiero po ogrzaniu reagentów do odpowiedniej temperatury (utlenianie, spalanie); reaguje bezpośrednio, zwłaszcza w temperaturze podwyższonej, prawie ze wszystkimi pierwiastkami chemicznymi (tworząc tlenki lub nadtlenki), a także z wieloma substancjami organicznymi i nieorganicznymi. Tlen jest najbardziej rozpowszechnionym pierwiastkiem chemicznym w przyrodzie. W stanie wolnym występuje w powietrzu w ilości 20,95% objętości; stanowi 46,5% masowych skorupy ziemskiej, wchodząc w skład prawie wszystkich minerałów skałotwórczych (głównie krzemianów, glinokrzemianów, tlenków, węglanów); bardzo rozpowszechnionym związkiem tlenu jest woda, zawierająca także niewielkie ilości rozpuszczonego wolnego tlenu; wchodzi też w skład wielu substancji organicznych (m.in. białek, węglowodanów, tłuszczów).
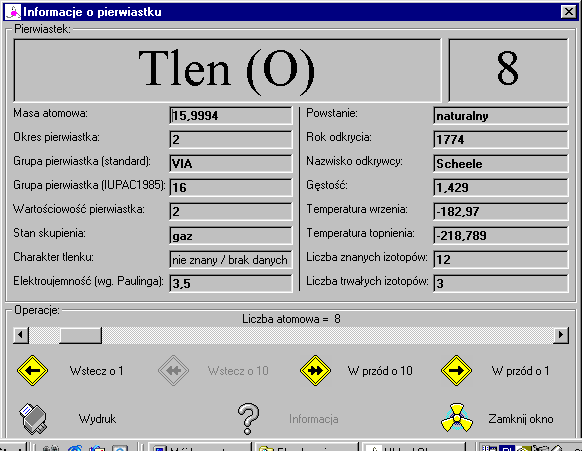
Tlen otrzymuje się na skalę przem. przez destylację frakcjonowaną ciekłego powietrza lub elektrolizę wodnych roztworów zasad lub soli, laboratoryjnie przez rozkład tlenków, nadtlenków lub innych związków bogatych w tlen. Jest on niezbędny do życia dla większości organizmów. Ma ogromne zastosowanie w przemyśle, m.in. w hutnictwie do świeżenia metali; w przemyśle chemicznym bierze udział (jako tlen powietrza) w wielu procesach technologicznych (np. otrzymywanie kwasu azotowego, kwasu siarkowego); spalanie paliw (łączenie się z tlenem) jest źródłem energii cieplnej wykorzystywanej w wielu gałęziach przemysłu, w transporcie, do ogrzewania pomieszczeń oraz w gospodarstwie domowym; palniki acetylenowo-tlenowe i wodorowo-tlenowe służą do spawania i cięcia metali; stosowany też w lecznictwie. Dawna pol. nazwa — kwasoród. Tlen odkrył 1772 K.W. Scheele i, niezależnie, 1774 J. Priestley.
Tlenki są to związki tlenu, w których występuje on na -2 stopniu utlenienia. Wszystkie pierwiastki (z wyjątkiem helowców) z tlenem tworzą tlenki. Rozróżniamy 4 typy tlenków: kwasowe, zasadowe, amfoteryczne i obojętne. Powstają one podczas reakcji spalania pierwiastków w powietrzu, rozkładu termicznego soli lub wodorotlenków oraz w wyniku odwadniania kwasów. W reakcji z kwasami lub zasadami tlenki tworzą sole, z wyjątkiem tlenków obojętnych, które nie reagują ani z kwasami ani z zasadami. Zasadowe tlenki litowców i berylowców reagują ponadto z wodą, tworząc wodorotlenki, niektóre tlenki kwasowe tworzą z wodą kwasy tlenowe.
Tlenki metali są to ciała stałe o dość dużej gęstości i wysokich temp. topnienia (500-3000°C). Są tlenkami zasadowymi i reagują z kwasami tworząc sole. Ponadto tlenki litowców i berylowców rozpuszczają się w wodzie i powstają z nich wodorotlenki metali.
Tlenki niemetali są to gazy lub ciecze, rzadziej ciała stałe o charakterze kwasowym, które reagują z zasadami tworząc sole. Są ponadto bezwodnikami kwasowymi i w reakcji z wodą dają kwasy tlenowe.
Przykłady tlenków:
tlenek ołowiu(II), PbO, występuje w 2 odmianach: tetragonalnej o barwie czerwonej (glejta) i rombowej o barwie żółtej, temp. topnienia Tt = 884°C, temp. wrzenia Tw = 1470°C (masykot). Trudno rozpuszcza się w wodzie i ma własności amfoteryczne. Używany jest do wyrobu szkła, glazury, emalii.
czad, CO, tlenek węgla, bezbarwny, bezzapachowy i łatwopalny gaz, o temp. topnienia Tt = -204°C, temp. wrzenia Tw = -191,5°C i gęstości g = 1,25 g/dm3. Trudno rozpuszcza się w wodzie i ma własności redukujące. Jest silną trucizną, gdyż tworzy trwały związek z hemoglobiną uniemożliwiając łączenie się jej z tlenem. Już w stężeniu 0,3% objętości jest zabójczy dla człowieka. Powstaje podczas spalania węgla przy niedostatecznym dostępie tlenu, co wykorzystuje się w metalurgii.
Niektóre związki tlenu. Dziesięć najprostszych pierwiastków występuje w skorupie ziemskiej w postaci tlenków. Prawie połowę materiału skorupy ziemskiej stanowi dwutlenek krzemu SiO2, około jednej trzeciej tlenek magnezu (MgO), a nieco mniej niż jedną czwartą tlenek żelaza (II), czyli FeO. Dalsze pospolite tlenki to: tlenek glinu (Al2O3), tlenek wapnia (CaO) i tlenek żelaza (III), Fe2O3.
Wszystkie aktywne metale grupy IA (1) układu okresowego, czyli litowce, reagują energicznie z tlenem w temperaturze pokojowej i pod ciśnieniem atmosferycznym. Tlen tworzy związki na stopniu utlenienia - II, natomiast litowce tworzą związki na stopniu utlenienia I; ogólnie równanie reakcji między tlenem a tymi metalami jest więc następujące:
4M + O2 → 2M2O
M oznacza ty dowolny litowiec: lit (Li), sód (Na), potas (K), rubid (Rd), cez (Cs) i frans (Fr).
Reakcje między tlenami grupy IIA (2), czyli berylowcami, nie przebiegają tak energicznie; tworzą one tlenki na stopniu utlenienia II, zgodnie z reakcją:
2M + O2 → 2MO
M oznacza tu dowolny berylowiec: beryl (Be), magnez (Mg), wapń (Ca), stront (Sr), bar (Ba) i rad (Ra).
Ważną grupę tlenków tworzą lantanowce, czyli metale ziem rzadkich. Lantanowce występują w przyrodzie na ogół w postaci tlenków. Ponieważ większość lantanowców tworzy związki na stopniu utlenienia III, reakcja powstawania tlenków ma postać:
2M + 3O2 → 2M2O3
M oznacza jeden z lantanowców - od ceru (pierwiastka 58) do lutetu (pierwiastka 71)
Tlenki metali mniej aktywnych, np. glinu, cyny i ołowiu, nie mają takich prostych i dających się przewidzieć wzorów. W pewnych przypadkach (np. w przypadku ołowiu) stopień utlenienia metalu nie wyraża się małą liczbą całkowitą. Niektóre metale np. wanad i mangan, tworzą związki na różnych stopniach utlenienia, co komplikuje obraz. Znacznie bardziej złożony, niż można by sądzić, jest także proces utleniania żelaza, zwany potocznie rdzewieniem.
Tlen wiąże się łatwo z większością niemetali, tworząc powszechnie znane tlenki np. dwutlenek węgla (CO2).
Wyszukiwarka
Podobne podstrony:
Tlen najpopularniejszy pierwiastek na Ziemi
Woda jako najpopularniejszy tlenek na kuli ziemskiej Omów jej właściwości, rodzaje i sposoby ochron
SEMESTR I, wyklad 3, Planowanie - zabieg umysłowy, który poprzedza właściwą czynność, jest zatem dzi
20 Rola i znaczenie stowarzyszeń i fundacji na rzecz dzieci potrzebujących wsparcia
11. Wymień i omów podstawowe zalety mechanizmu rynkowego, Ekonomia - PYTANIA NA EGZAMIN DYPLOMOWY
11. Wymień i omów podstawowe zalety mechanizmu rynkowego, Ekonomia - PYTANIA NA EGZAMIN DYPLOMOWY
Znaczenie zbrojenia rozproszonego na oddziaływania pośrednie w betonowych elementach masywnych
Znaczenie jazdy rowerowej na proces rehabilitacji
wlasciwosci tworzyw sprawozdanie-JOLANTA CZAJA, Materialy na uczelnie
Znaczenie programu Rodzina na swoim dla rynku nieruchomości
Znaczenie rozwoju umysłowego na rozwój emocjonalny u dzieci w wieku przedszkolnym
Właściwości reologiczne półprod. ciastkarskich i ich wpływ na jakośc wyrobów
BEZPIECZEŃSTWO ENERGETYCZNE I JEGO ZNACZENIE W FUNKCJONOWANIU GOSPODARKI NA PRZYKŁADZIE WĘGLA KAMIEN
pierwiastki na płaszczyźnie zespolonej
Zmiany właściwości fiz półprod piekarskich i ich wpływ na teksturę gotowych produktów
Rola i znaczenie stowarzyszeń i fundacji na rzecz dzieci potrzebujących wsparcia, Pytania do licencj
Rodzina, jej znaczenie, wpływ rodziny na jednostkę
więcej podobnych podstron