Rozdział 1
ROZWÓJ KOMÓREK
(GAMETOGENEZA)
Rozwój człowieka rozpoczyna się od zapłodnienia, czyli od połączenia się plemnika mężczyzny i owocytu kobiety oraz powstania nowego organizmu, zygoty. W przyholowaniu do zapłodnienia w męskich i w żeńskich komórkach płciowych zachodzi wiele zmian, obejmujących zarówno chromosomy, jak i cytoplazmę. Cykl tych zmian| jest dwojaki:
1. Redukcja diploidalnej liczby chromosomów, wynoszącej w komórkach somatycznych 46 do występującej w gametach haploidalnej liczby 23. Odbywa się to w wyniku podziałów mejotycznych, zwanych także podziałami dojrzewania i jest niezbędne, gdyż. inaczej fuzja (połączenie się) komórki płciowej męskiej z żeńską prowadziłaby do powstania osobnika z dwukrotnie większą liczbą chromosomów, niż było ich w komórkach rodzicielskich.
2. Zmiana kształtu komórek płciowych podczas przygotowania do zapłodnienia. Komórka płciowa męska, początkowo duża i okrągła, traci praktycznie całą cytoplazmę, wykształca się w niej natomiast główka, szyjka i witka. Komórka płciowa żeńska stopniowo się zaś powiększa w wyniku przyrostu objętości cytoplazmy. Dojrzały owocyt ma średnicę około 120 μm.
Komórka somatyczna człowieka zawiera 23 pary, czyli diploidalną (gr. diploos, podwójny) liczbę chromosomów. Jeden chromosom każdej pary pochodzi od matki, a drugi od ojca. W czasie mitozy i w komórce nie dzielącej się chromosomy tworzące parę na ogół nie lezą blisko siebie. W bezpośrednim kontakcie ze sobą •znajdują się tylko podczas podziałów mejotycznych, czyli podziałów dojrzewania, komórek płciowych.
Aby procesy zachodzące podczas podziałów mejotycznych przedstawić w sposób możliwie zrozumiały, najważniejsze elementy tych podziałów porównano z elementami podziału mitotycznego. Z tego samego względu, mimo że redukcja liczby chromosomów i zmiany cytoplazmatyczne są podczas dojrzewania komórek płciowych nierozerwalnie z sobą związane, każdy z tych procesów jest przedstawiony oddzielnie.
Chromosomy podczas podziału mitotycznego
Zanim normalna komórka mitotyczna wejdzie w mitozę, każdy chromosom replikuje swoje DHA i tym samym ulega podwojeniu. W fazie replikacji DNA chromosomy są bardzo długie, rozproszone w jądrze i pod mikroskopem świetlnym nie można ich rozpoznać. Na początku mitozy chromosomy zaczynają ulegać spiralizacji, kondensacji i skróceniu, co stanowi znak rozpoznawczy początku profazy. Każdy chromosom składa się z dwóch równoległych podjednostek (chromatyd), połączonych w przewężeniu, zwanym centromerem — kinetochorern*. W czasie profazy, chromosomy nadal ulegają kondensacji, co prowadzi do ich skrócenia i pogrubienia (ryć. 1-1 A), ale poszczególne chromatydy można odróżnić dopiero począwszy od stadium prometafazy (ryć. 1-1 B). Podczas metafazy chromosomy układają się w płaszczyźnie równikowej i obie chromatydy są wyraźnie widoczne (ryć. 1-1C). Każda chromatyda połączona jest z mikrotubulami (wrzeciona podziałowego) biegnącymi od kinetochoru do centromeru.
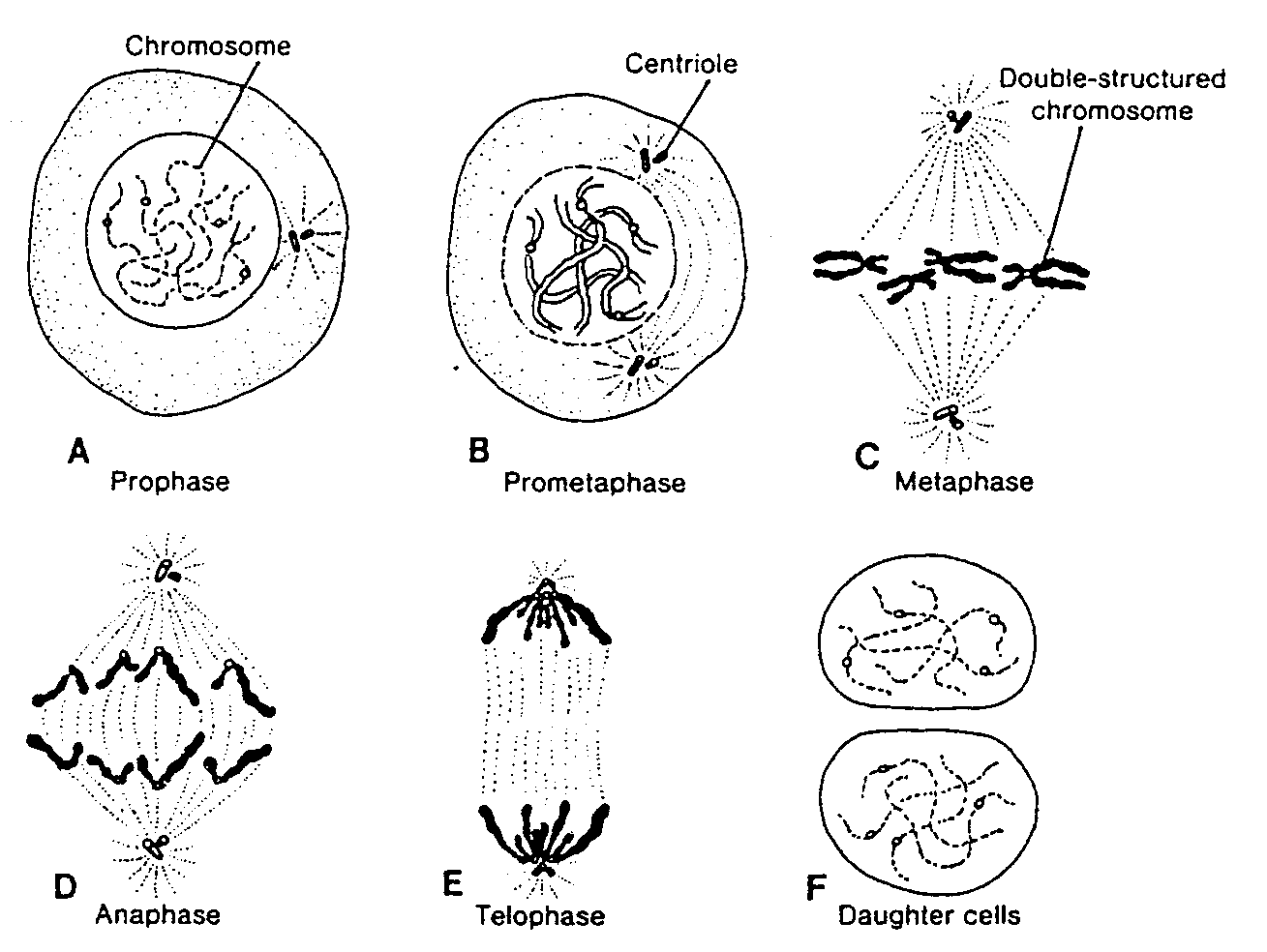
Ryć. 1-1. Schematyczny rysunek przedstawiający różne stadia podziału mitotycznego. W protazie chromosomy są widoczne w postaci nitek. Podwojone chromatydy stają się wyraźnie widoczne jako pojedyncze struktury w prometafazie. W czasie podziału nigdy nie dochodzi do łączenia się chromosomów homologicznych. Chromosomy ojcowskie — niebieskie; chromosomy matczyne — czerwone.
Chromosome — chromosom; Centriole — centriola; Double-structured chromosome — chromosom dwuchromatydowy; Prophase — profaza; Prometaphase — prometafaza; Metaphase — metafaza; Anaphase — anafaza; telophase — telofaza; Daughter cells — komórki potomne
* Kinetochory, oddzielne dla każdej chromatydy, występują na centromerze (przyp. tłum.).
** Obecnie wiadomo, że mikrotubule łączą kinetochory z centrosomem, a nie ze znajdującymi się w jego obrębie centriolami (przyp. tłum.).
Na początku anafazy centromer każdego chromosomu ulega rozdzieleniu, a chromatydy wędrują do przeciwległych biegunów wrzeciona. Na koniec, podczas telofazy, chromosomy despiralizują się i wydłużają, odtwarza się otoczka jądrowa i zachodzi podział cytoplazmy (ryć. 1-1D, E). Komórka potomna otrzymuje połowę każdego podwójnego chromosomu i w ten sposób zachowuje taką sama liczbę chromosomów, jaką miała komórka — matka.
Chromosomy podczas podziałów dojrzewania (mejozy)
PIERWSZY PODZIAŁ DOJRZEWANIA
Podobnie jak podczas podziału mitotycznego. kobiece i męskie niedojrzałe komórki płciowe (owocyty I rzędu i spermatocyty I rzędu) replikują DNA tuż przed rozpoczęciem pierwszego podziału dojrzewania. Stąd, na początku podziałów dojrzewania, komórki płciowe zawierają podwojoną ilość DNA w stosunku do normalnej i każdy z 46 chromosomów jest podwojony, tzn. składa się z dwóch chromatyd. (ryć. l-2).
Pierwsza charakterystyczną cecha pierwszego podziału dojrzewania jest tworzenie par (synapsis) homologicznych chromosomów. Pary te nazywa się biwalentami (ryć. 1-2A). Chromosomy tworzące parę łączą się z sobą punkt po punkcie z wyjątkiem chromosomów X-Y*. Centromery chromosomów homologicznych nie łączą się z sobą. Ponieważ każdy chromosom jest podwojony i zawiera dwie chromatydy, para chromosomów homologicznych składa się z czterech chromatyd fryc. 1-2B). W czasie podziału mitotycznego chromosomy homologiczne nigdy nie tworzą par.
Drugą charakterystyczną cechą pierwszego podziału dojrzewania jest zjawisko crossing-over, czyli wymiana odcinków chromatyd pomiędzy chromosomami homologicznymi (biwalentami) (ryć. 1-2C). Gdy po utworzeniu pary każdy dwuchromatydowy chromosom wchodzący w jej skład rozdzieli się wzdłuż, w chromatydach dochodzi do jednego lub więcej pęknięć i do wymiany segmentów chromatyd pomiędzy homologicznymi chromosomami (ryć. 1-2C). Podczas rozdzielania się chromosomów homologicznych miejsca, w których odbywała się wymiana pozostają przejściowo połączone i chromosomy przybierają postać litery X. Miejsce połączenia nosi nazwę chiasmy** (ryć. 1-2C).
W stadium chiasmy pomiędzy chromosomami homologicznymi zachodzi wymiana bloków genów. W tym samym czasie nadal odbywa się rozdzielanie chromosomów homologicznych oraz ich łączenie się z włóknami wrzeciona podziałowego i przestrzenne zorientowanie w stosunku do biegunów komórki (ryć. 1-2D). Następnie chromosomy homologiczne wędrują do przeciwnych biegunów komórki (ryć. 1-2E).
Po zakończeniu pierwszego podziału dojrzewania każda z komórek potomnych zawiera jeden chromosom z każdej pary, czyli ma 23 dwuchromatydowe chromosomy (ryć. 1-2E). Tym samym ilość DNA w każdej komórce potomnej jest taka sama jak w normalnej komórce somatycznej.
* Chromosomy te łączą się z sobą w części kodującej cechy somatyczne (przyp. tłum.).
** Chromosom może zawierać kilka chiasm (przyp. tłum.).
ROZWÓJ KOMÓREK ROZRODCZYCH
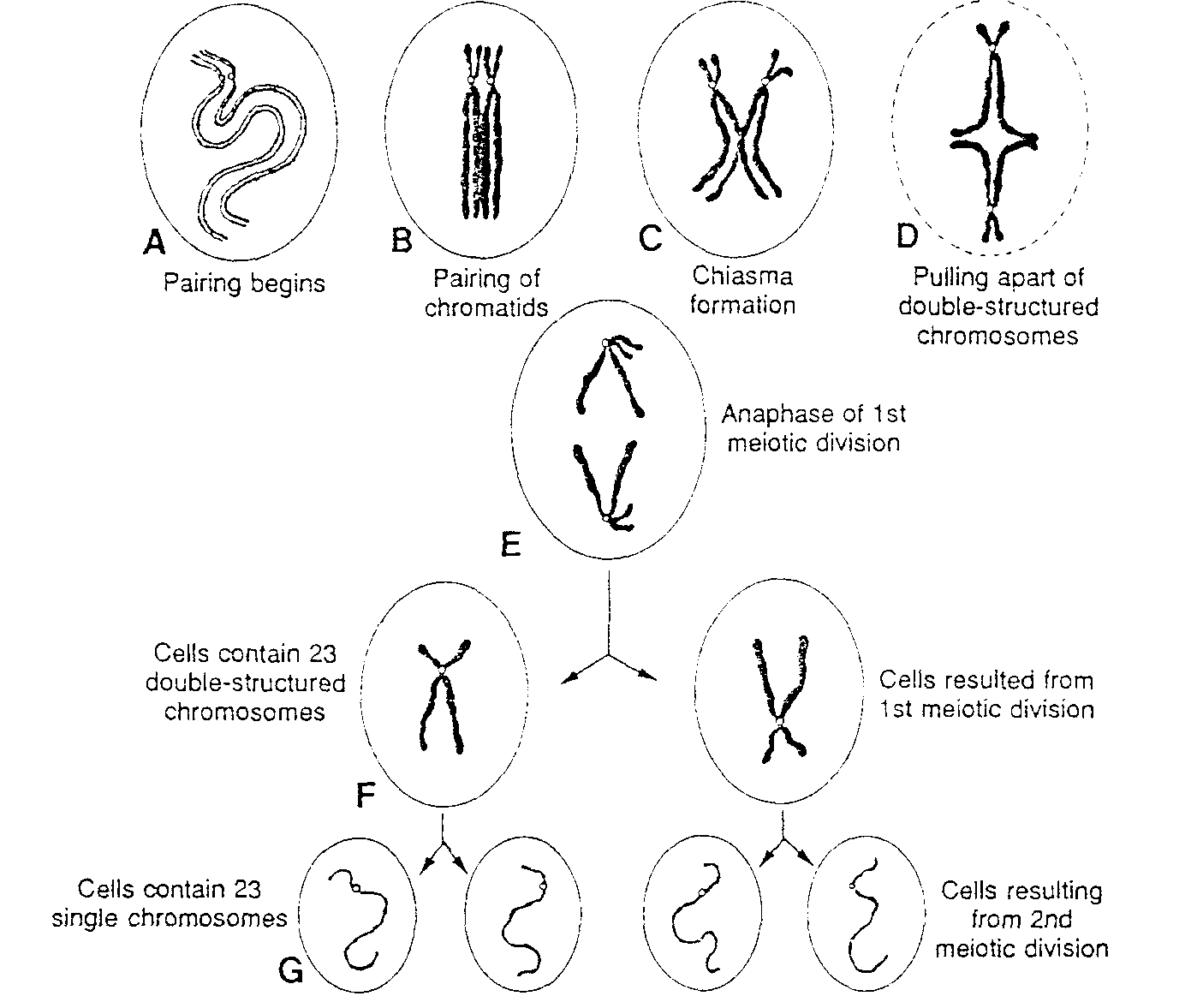
Ryć. 1-2. Schematycznie przedstawiony pierwszy i drugi podział mejotyczny. A, Chromosomy homologiczne zbliżają się do siebie. B, Chromosomy homologiczne tworzą pary (są sparowane), przy czym każdy z nich składa się z dwóch chromatyd. C, Ściśle sparowane chromosomy homologiczne wymieniają fragmenty chromatyd (ang. crossing-over). Widoczna jest chiasma. D, Dwuchromatydowe chromosomy rozdzielają się. E. Anafaza pierwszego podziału mejotycznego. F i G, Podczas drugiego podziału mejotycznego następne rozdzielenie centromerów dwuchromatydowych chromosomów. Po zakończeniu podziału wszystkie chromosomy w każdej z czterech komórek potomnych różnią się między sobą.
Pairing begins — rozpoczyna się tworzenie par; Pairing of chromatids — chromatydy utworzyły pary; Chiasma formation — tworzenie chiasmy; Puiling apart of double-structured chromosomes — rozdzielanie się chromosomów dwuchromatydowych; Anaphase ot 1st meiotic division — anafaza pierwszego podziału mejotycznego; Cell contain 23 double-structured chromosomes — komórka zawiera 23 dwuchromatydowe chromosomy; Cell contain 23 single chromosomes — komórka zawiera 23 pojedyncze chromosomy; Cells resulted from Ist meiotic division — komórki powstałe po pierwszym podziale mejotycznym; Cells resulting from 2nd meiotic division — komórki powstałe po drugim podziale mejotycznym.
DRUGI PODZIAŁ DOJRZEWANIA
Wkrótce po zakończeniu pierwszego podziału dojrzewania komórka rozpoczyna drugi podział dojrzewania. W przeciwieństwie do pierwszego podziału przed drugim podziałem nią zachodzi synteza DNA. Wszystkie 23 dwuchromatydowe chromosomy rozdzielają się w obrębie centromeru i każda z nowo utworzonych komórek potomnych otrzymuje 23 chromatydy (ryć. 1-2G). Ilość DNA w każdej takiej komórce stanowi połowę ilości występującej w normalnej komórce somatycznej. Stąd też, cel dwóch podziałów mejotycznych lub podziałów dojrzewania jest
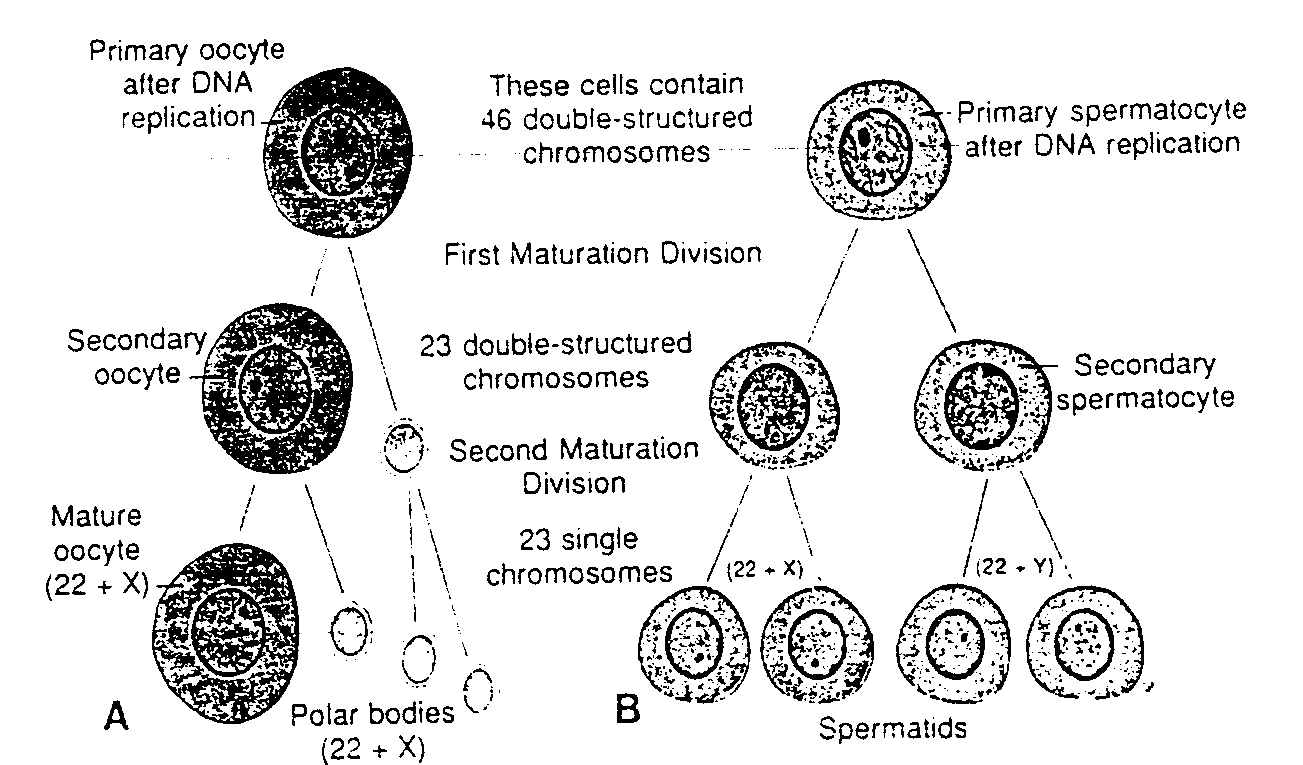
Ryć. 1-3. Schematyczny rysunek pokazujący procesy zachodzące podczas pierwszego i drugiego podziału dojrzewania. A. Owocyt l rzędu wytwarza tylko jedną dojrzałą komórkę rozrodczą, dojrzały owocyt. B, Spermatocyt l rzędu wytwarza cztery spermatydy, które następnie przekształcają się w plemniki. Primary oocyte after DNA replication — owocyt l rzędu po replikacji DNA; Secondary oocyte — owocyt II rzędu; Maturę oocyte — dojrzały owocyt; Polar bodies — ciałka biegunowe (polocyty); These cells contain 46 double-structured chromosomes — te komórki zawierają 46 dwuchromatydowych chromosomów; First maturation division — pierwszy podział dojrzewania: 23 double-structured chromosomes — 23 chromosomy dwuchromatydowe; Second maturation division — drugi podział dojrzewania; 23 single chromosomes — 23 chromosomy jednochromatydowe; Primary spermatocyte after DNA replication — spermatocyt l rzędu po replikacji DNA; Secondary spermatocyte — spermatocyt II rzędu; Spermatids — spermatydy
dwojaki: (a) zapewnienie zrnienności genetycznej przez proces wymiany odcinków chromatyd pomiędzy chromosomami homologicznymi, co stwarza „nowe" chromosomy, i przypadkowe przemieszczanie się chromosomów homologicznych do komórek potomnych; (b) wyposażenie komórki płciowej w haploidalny zestaw chromosomów i połowę ilości DNA normalne komórki somatycznej (drugi podział mejotyczny).
W wyniku podziałów mejotycznych z jednego owocytu I rzędu powstają ostatecznie cztery komórki potomne, z których każda ma 22 chromosomy somatyczne i l chromosom płciowy X (ryć. l-3 A). Spośród nich tylko jedna rozwija się w dojrzałą komórkę płciową, owocyt; trzy pozostałe, zwane ciałkami kierunkowymi, prawie nie mają cytoplazmy i degenerują się w czasie dalszego rozwoju.
Spermatocyt I rzędu daje początek czterem komórkom potomnym; dwóm z 22 autosomami i l chromosomem X oraz dwóm z 22 autosomami i l chromosomem Y (ryć. 1-3B). Ze wszystkich powstają dojrzałe komórki płciowe.
NIEPRAWIDŁOWE PODZIAŁY MEJOTYCZNE
Procesy zachodzące podczas podziałów mejotycznych nie zawsze przebiegają bez zakłóceń. Gdy tylko ustalono prawidłowy zestaw chromosomów człowieka, natychmiast okazało się, że niektórzy ludzie mają nieprawidłową liczbę chromosomów.
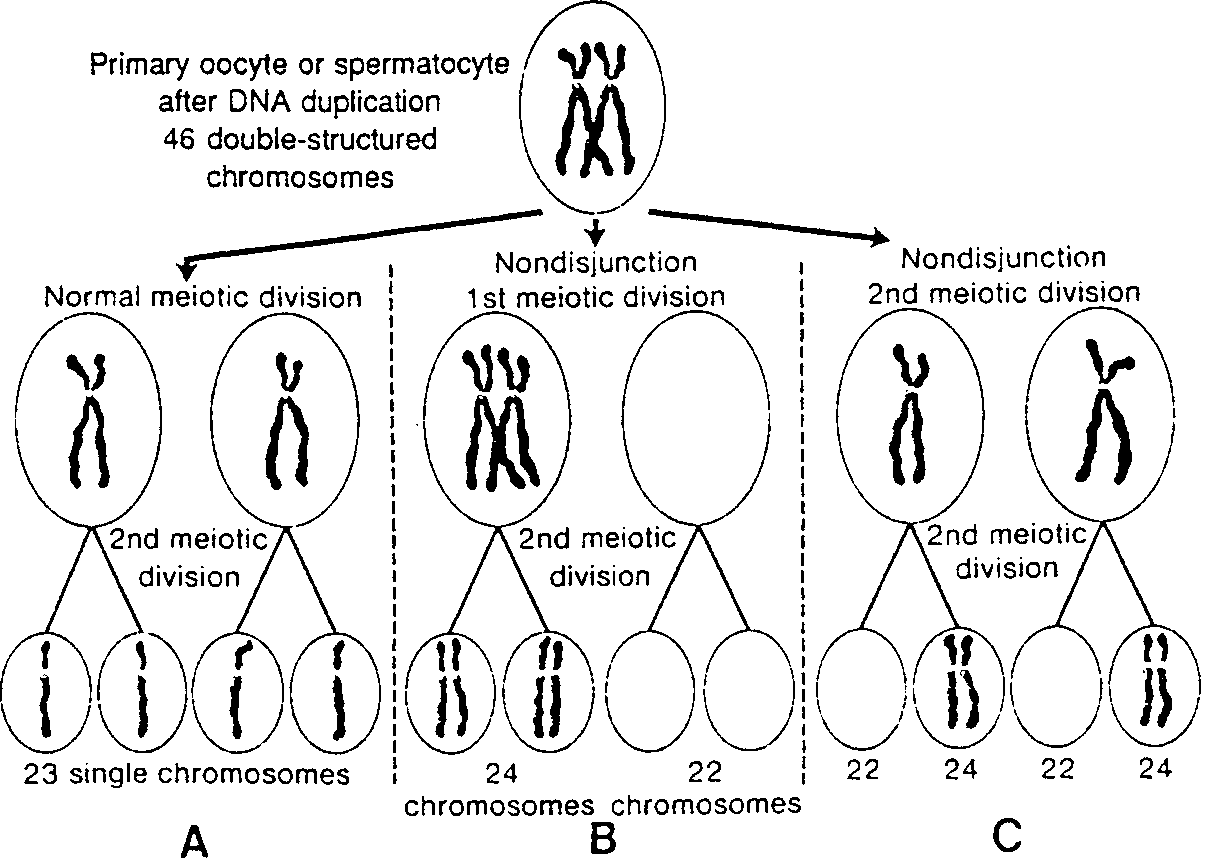
Nieprawidłowości chromosomowe powstają w czasie podziałów mejotycznych. Zazwyczaj oba homologiczne chromosomy, tworzące, parę, rozdzielają się w czasie
Ryc.1-4. Schematyczny rysunek przedstawiający: A, Normalne podziały dojrzewania; B, Nierozdzielenie się chromosomów w czasie pierwszego podziału mejotycznego; C, Nierozdzielenie się chromosomów w czasie drugiego podziału mejotycznego.
Primary oocyte or spermatocyte after DNA duplication 46 double-structured chromosomes — owocyt lub spermatocyt l rzędu po podwojeniu zawartości DNA, 46 chromosomów dwuchromatydowych; Normal meiotic division — normalny podział mejotyczny; 2nd meiotic division — 2 podział mejotyczny; 23 single chromosomes — 23 chromosomy jednochromatydowe; Nondisjunction 1st meiotic division — nierozdzielenie się chromosomów w czasie 1 podziału mejotycznego; 2nd meiotic division — 2 podział mejotyczny; Chromosomes — chromosomy; Nondisjunction 2nd meiotic division — nierozdzielenie się chromosomów w czasie 2 podziału mejotycznego; 2nd meiotic division — 2 podział mejotyczny
pierwszego podziału mejotycznego i każda komórka potomna otrzymuje jeden chromosom z każdej pary (ryć. l-4A). Niekiedy jednak nie dochodzi do rozdzielenia się chromosomów (ang. nondisjunction) i oba chromosomy tworzące parę przechodzą do jednej komórki (ryć. 1-4B). W następstwie rozdzielenia się chromosomów jedna komórka otrzymuje 24 chromosomy a druga 22, zamiast, jak normalnie, 23 chromosomów. Jeśli podczas zapłodnienia gameta mająca 23 chromosomy połączy się z gametą rnającą 24 lub 22 chromosomy, to powstanie wówczas osobnik albo z 47 chromosomami (trisomia) tub 45 chromosomami (monosomia). Nierozdzielenie się chromosomów przypuszczalnie może zachodzić podczas albo pierwszego, albo drugiego podziału mejotycznego komórek płciowych i może dotyczyć dowolnego chromosomu (1).
Zmiany morfologiczne podczas dojrzewania
OWOCYTY I SPERMATOCYTY l RZĘDU
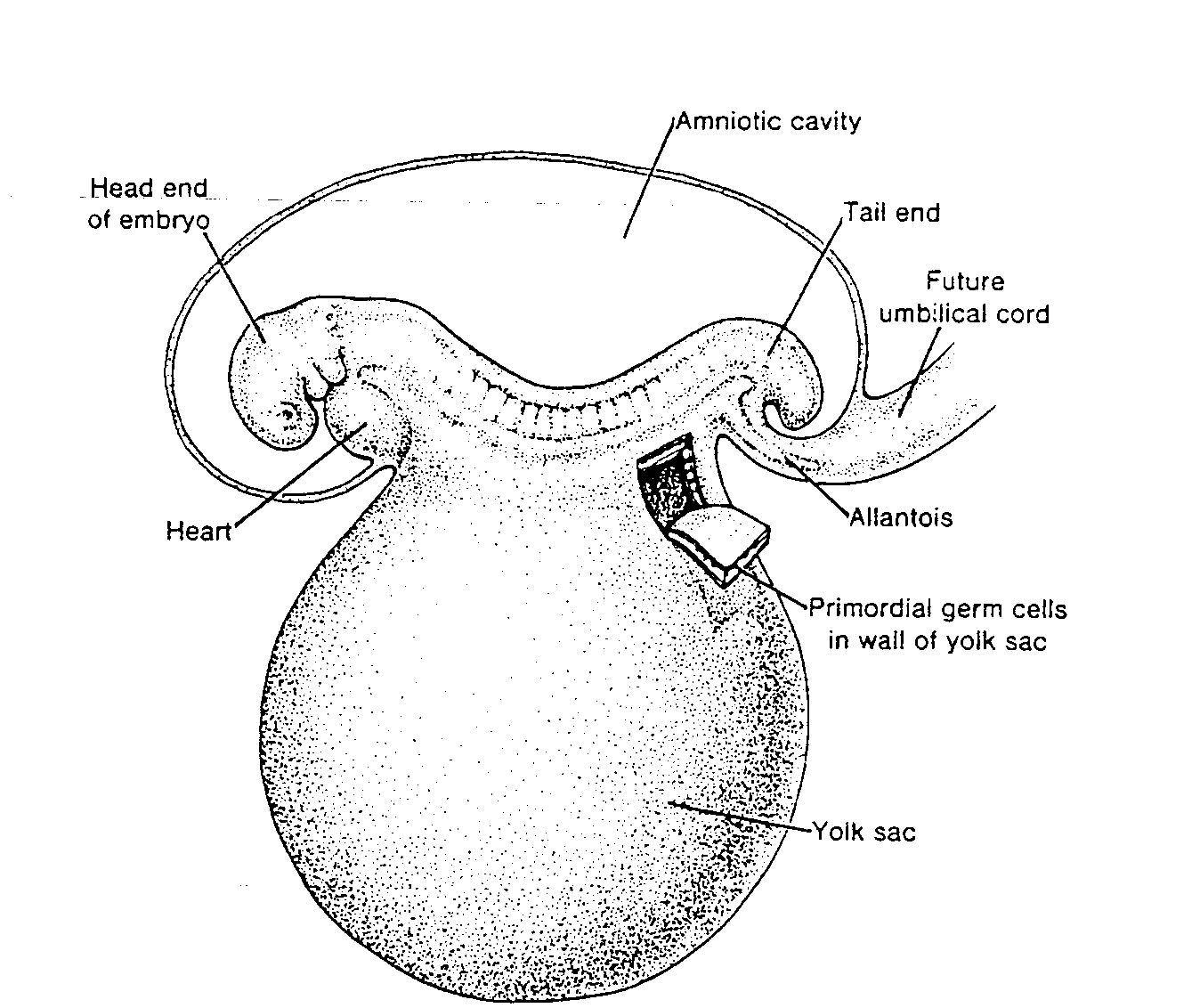
Dojrzałe męskie i żeńskie komórki płciowe wywodzą się w linii prostej z pierwotnych komórek płciowych (komórek prapłciowych), które w zarodku ludzkim
Ryć. 1-5. Rysunek tygodniowego zarodka ukazujmy położenie pierwotnych komórek płciowych w ścianie
pęcherzyka żółtkowego, w pobliżu miejsca przyczepu przyszłej pępowiny.
Head end of embryo — koniec głowowy zarodka; Heart — serce; Amniotic cavity — jama owodniowa; Taił end
— koniec ogonowy; Future umbilical cord — przyszła pępowina; Allantois — omocznia; Primordial germ cells in wall of yolk sac — pierwotne komórki płciowe w ścianie pęcherzyka żółtkowego; Yolk sac — pęcherzyk
żółtkowy
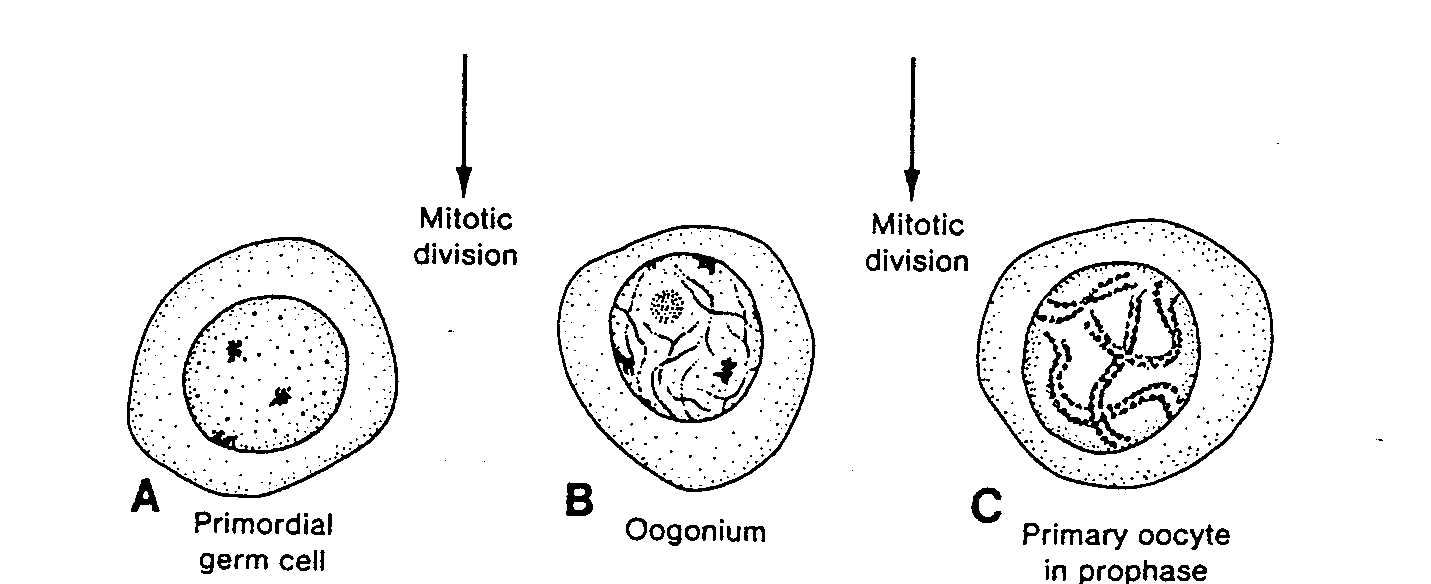
Ryć. 1-6. Różnicowanie się pierwotnych komórek płciowych w owogonie zaczyna się wkrótce po ich dotarciu do jajnika. W końcu trzeciego miesiąca rozwoju część owogonii przekształca się w owocyty l rzędu, które prawie natychmiast wchodzą w profazę pierwszego podziału mejotycznego. Profaza taka może trwać przez 40 lub więcej lat i ulegnie zakończeniu jedynie wówczas, gdy komórka rozpocznie ostateczne różnicowanie się. W czasie trwania profazy komórka zawiera 46 dwuchromatydowych chromosomów. Mitotic diyision — podział mitotyczny; Primordial germ celi — pierwotna komórka płciowa; Oogonium - - owogonium; Primary oocyte in prophase — owocyt l rzędu w profazie
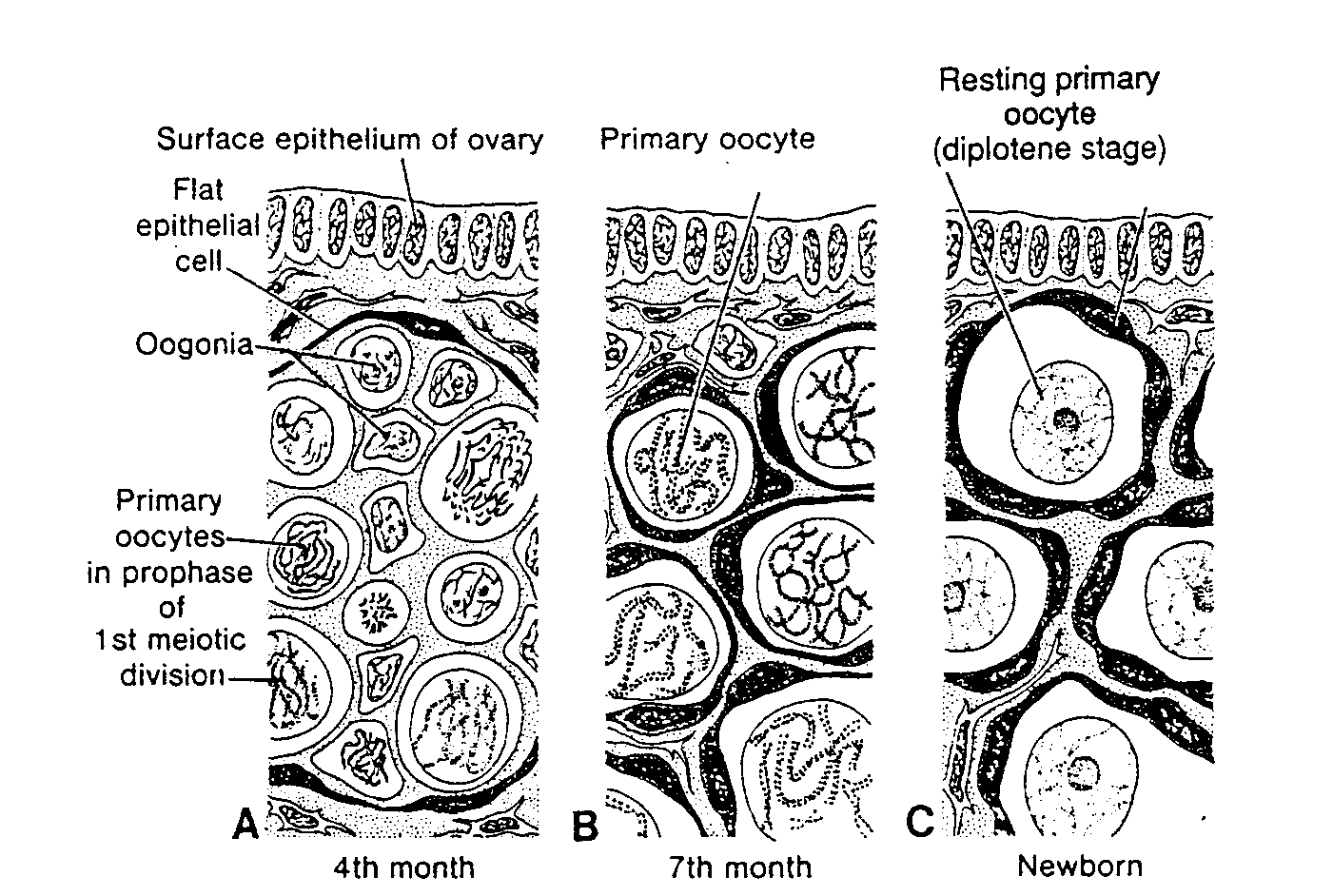
Ryć. 1-7. Schematycznie przedstawione fragmenty jajnika z różnych stadiów rozwoju. A, W 4 miesiącu. Owogonie zgrupowane są w skupieniach w korowej części jajnika. W niektórych widać podziały mitotyczne, inne już się zróżnicowały w owocyty l rzędu i weszły w profazę pierwszego podziału mejotycznego. B, W 7 miesiącu. Niemal wszystkie owogonie przekształciły się w owocyty l rzędu i są w profazie pierwszego podziału mejotycznego. C, W okresie okołoporodowym. Owogonie nie występują. Każdy owocyt l rzędu jest otoczony przez pojedynczą warstwę komórek pęcherzykowych i stanowi pęcherzyk jajnikowy pierwotny. Owocyty znajdują się w stadium diplotenu, w którym pozostaną niemalże do momentu owulacji. Dopiero wówczas wejdą w metafazę pierwszego podziału mejotycznego. (Zaadaptowano z pracy Ohno i wsp.: Female germ cells in man. fxp. Celi Res 24:106, 1961).
Surface epithelium of ovary — nabłonek powierzchniowy jajnika; Fiat epithelial celi — płaska komórka nabłonkowa; Oogonia — owogonium; Primary oocytes in prophase of 1st meiotic division — owocyty l rzędu w profazie pierwszego podziału dojrzewania; 4th month — 4 miesiąc; Primary oocyte in prophase — owocyt l rzędu w profazie; 7th month — 7 miesiąc; Resting primary oocyte (diplotene stage) — spoczynkowy owocyt l rzędu (stadium diplotenu); Follicular celi — komórka pęcherzykowa; Newborn — noworodek
pojawiają się w końcu 3 tygodnia rozwoju w ścianie pęcherzyka żółtkowego (ryć. 1-5). Komórki te wędrują ruchem amebowatym z pęcherzyka żółtkowego w kierunku rozwijających się gonad (pierwotnych gruczołów płciowych), gdzie docierają w końcu 4 lub na początku 5 tygodnia (3 - 5) (patrz rozdział 15, ryć. 15-15).
OWOGENEZA
Dojrzewanie komórek jajnika przed urodzeniem
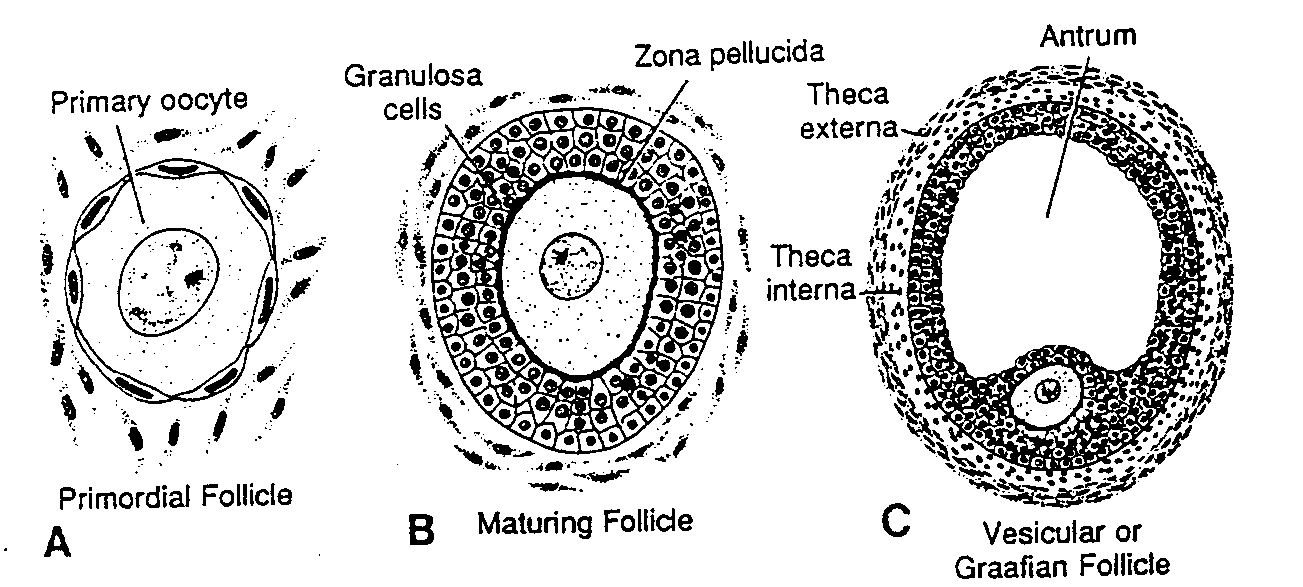
Pierwotne komórki płciowe po dojściu do gonady zarodka mającego żeński kariotyp różnicują się w owogonie (ryć. 1-6A, B). Owogonie przechodzą przez pewną liczbę podziałów mitotycznych i w końcu 3 miesiąca tworzą skupienia otoczone przez warstwę płaskich komórek nabłonkowych (ryć. 1-7A). Wszystkie owogonie z jednej grupy prawdopodobnie wywodzą się z pojedynczej pierwotnej komórki płciowej, natomiast płaskie komórki nabłonkowe, zwane komórkami pęcherzykowymi (ziarnistymi), pochodzą z powierzchniowego nabłonka pokrywającego jajnik.
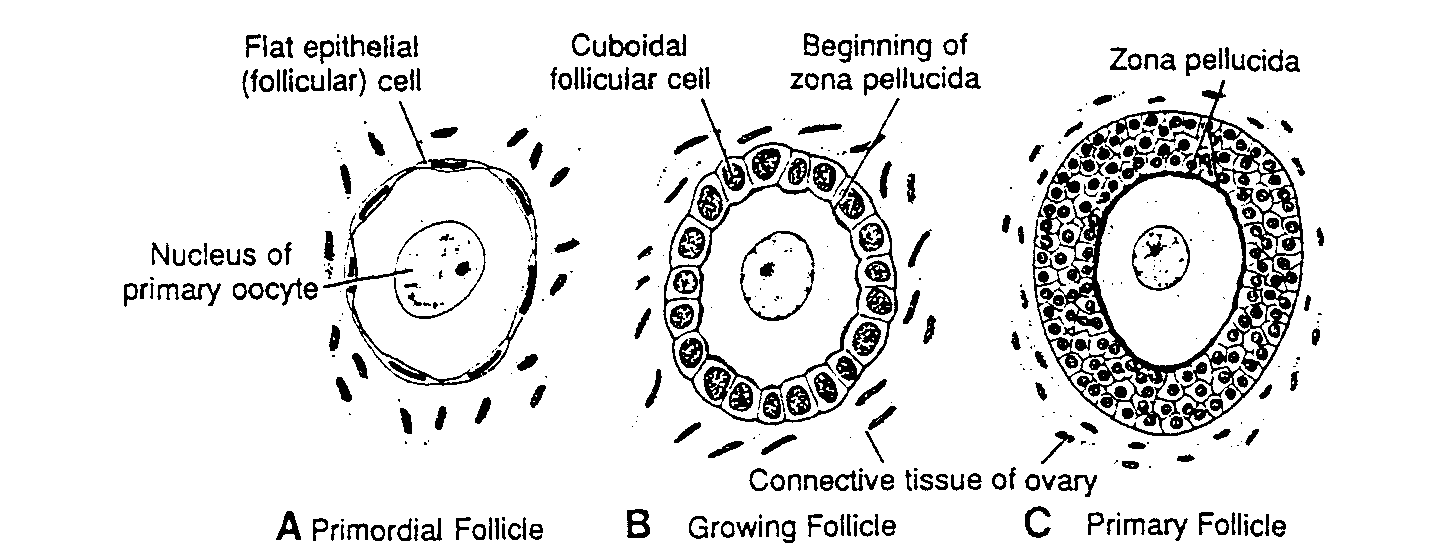
Ryć. 1-8. A, Schematyczny rysunek przedstawiający pierwotny pęcherzyk jajnikowy, składający się z owocytu l rzędu otoczonego przez warstwę spłaszczonych komórek nabłonkowych. B, W miarę dojrzewania pęcherzyka komórki pęcherzykowe zmieniają kształt z płaskiego na sześcienny. Zaczynają one teraz wytwarzać osłonkę przejrzystą (zona pellucida) widoczna w postaci nieregularnych kępek na powierzchni owocytu. C. Podczas dalszego dojrzewania komórki pęcherzykowe wytwarzają wokół owocytu kilkupokładową warstwę komórek ziarnistych, przekształcając w ten sposób pęcherzyk pierwotny w pęcherzyk wzrastający z dobrze rozwiniętą osłonką przejrzystą.
Flat epithelial follicular cell — płaska komórka nabłonkowa (pęcherzykowa); Nucleus of primary oocyte — jądro owocytu l rzędu; Cuboidal tollicular cells — komórki pęcherzykowe sześcienne; Beginning of zona pellucida — początkowe stadium powstawania osłonki przejrzystej; Connective tissue ot ovary — tkanka łączna jajnika; Zona pellucida — osłonka przejrzysta; Primordial rollicle — pęcherzyk jajnikowy pierwotny; Crowing follicle — pęcherzyk jajnikowy w początkowym okresie wzrostu: Primary rollicle — pęcherzyk wzrastający
Większość owogonii nadal dzieli się mitotycznie, ale niektóre różnicują się w znacznie większe owocyty I rzędu. Komórki te natychmiast po powstaniu replikują DNA i wchodzą w profazę pierwszego podziału mejotycznego (ryć. 1-6C i l -7A) (6-9). W czasie kilku następnych miesięcy liczba owogonii szybko wzrasta i do 5 rniesiąca rozwoju całkowita liczba komórek płciowych w jajniku osiąga maksimum, oceniane na 7000000. W tym samym czasie zaczyna się degeneracja komórek i liczne owogonie oraz owocyty I rzędu ulegają atrezji. W 7 miesiącu większość owogonii uległa już zwyrodnieniu, z wyjątkiem niewielkiej liczby w pobliżu powierzchni jajnika. Wszystkie przeżywające owocyty I rzędu znajdują się natomiast w pierwszym podziale mejotycznym i prawie każdy z nich jest teraz otoczony przez warstwę płaskich komórek nabłonkowych (ryć. 1-7B). Owocyt I rzędu wraz z otaczającymi go płaskimi komórkami nabłonkowymi stanowi pęcherzyk jajnikowy pierwotny (ryć. l-8A).
Dojrzewanie komórek jajnika po urodzeniu
W okresie okołoporodowym wszystkie owocyty I rzędu znajdują się już w profazie pierwszego podziału mejotycznego, ale nie przechodząc do metafazy pozostają w stadium diplotenu, czyli w stadium spoczynkowym, w okresie profazy charakteryzującym się ułożeniem chromatyny w postaci koronkowej siateczki (ryć. 1-7C) (7-9). Owocyty I rzędu pozostają w profazie i nie kończą pierwszego podziału mejotycznego przed okresem pokwitania, prawdopodobnie w wyniku działania inhibitor dojrzewania owocytów (ang. oocyte maturation inhibitor, OMI) wydzielanego przez kornórki pęcherzykowe (10). Całkowita liczba owocytów I rzędu
w okresie okołoporodowym oceniana jest na 700000 do 2000000. Ponieważ w dzieciństwie większość owocytów ulega atrezji. przeto w okresie pokwitania jest ich tylko 400000, a mniej niż 500 zostanie owulowanych w czasie reprodukcyjnego okresu życia kobiety.
Należy zdawać sobie sprawę, że niektóre owocyty, dojrzewające w późnym okresie reprodukcyjnego życia kobiety, przebywały w stanie spoczynku, w stadium diplotenu pierwszego podziału mejotycznego, przez 40 lub więcej lat. Jak dotychczas nie wiadomo, czy stadium diplotenu jest najkorzystniejsze dla zapewnienia owocytowi ochrony przed wpływami środowiska oddziaływującego na jajnik. Biorąc pod uwagę to. że liczba dzieci z aberracjami chromosomowymi wzrasta z wiekiem ich matek, można się również zastanawiać, czy wydłużenie podziału mejotycznego nie sprawia, że owocyty staja się podatne na uszkodzenie.
Począwszy od okresu pokwitania w każdym cyklu jajnikowym zaczyna dojrzewać od 5 do 15 pierwotnych pęcherzyków jajnikowych. Owocyt l rzędu (ciągle jeszcze w stadium diplotenu) zaczyna się powiększać, podczas gdy otaczające go komórki zmieniają się z płaskich w sześcienne i rozmnażają się, wytwarzając kilkupokładową warstwę nabłonkowych komórek ziarnistych. Taki pęcherzyk nazywany jest pęcherzykiem jajnikowym wzrastającym (folliculus ovaricus crescens) (ryć. 1-8B, C). Komórki ziarniste spoczywają na błonie podstawnej oddzielającej je od otaczających pęcherzyk komórek zrębu tworzących osłonkę pęcherzyka (theca follifiili). Ponadto komórki ziarniste i być może owocyt (11. 12) wydzielają
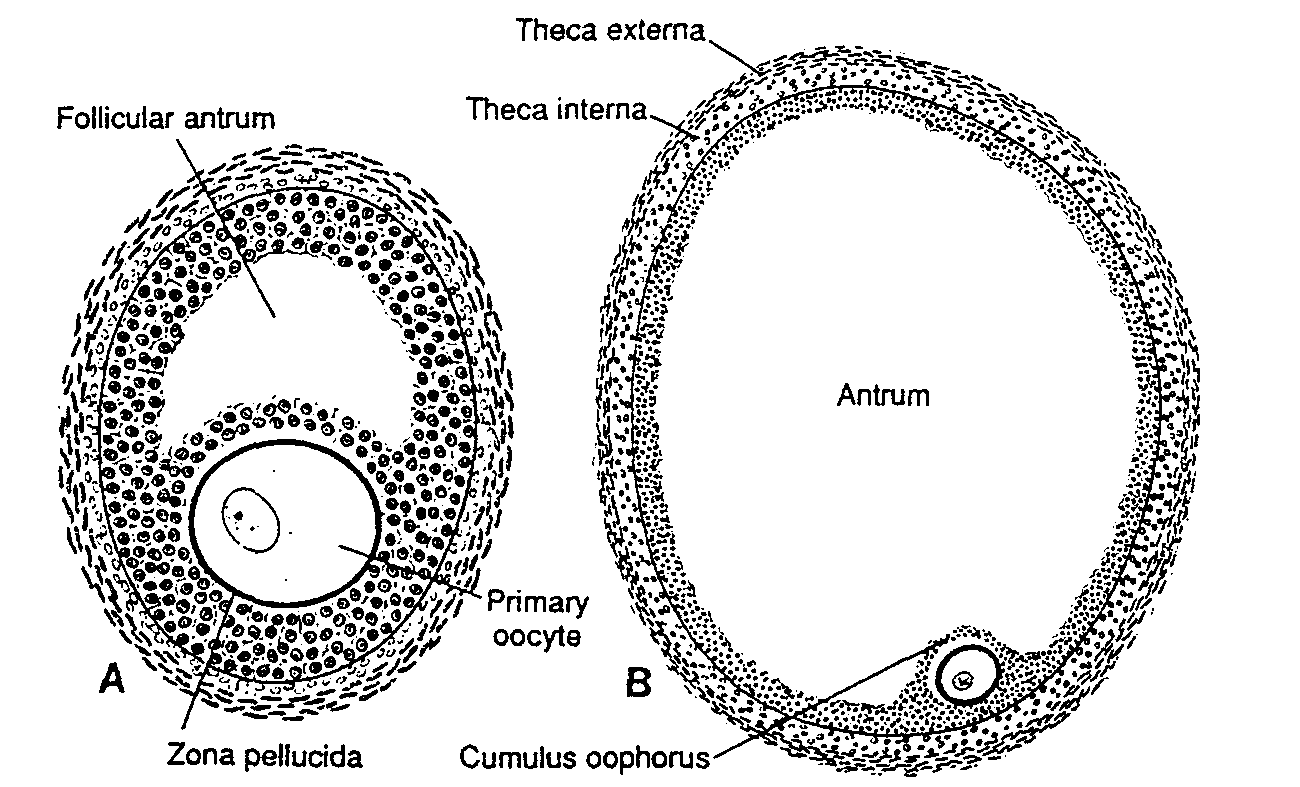
Ryć. 1-9. Schematycznie przedstawione dojrzewanie pęcherzyka jajnikowego. A, Owocyt otoczony przez osłonkę przejrzystą zajmuje pozycję mimośrodkową: jama pęcherzykowa utworzona po złączeniu się przestrzeni międzykomórkowych. Widać ułożenie komórek w warstwie wewnętrznej i warstwie zewnętrznej osłonki pęcherzyka. B, Dojrzały pęcherzyk jajnikowy (pęcherzyk Graafa). Znacznie powiększona jama pęcherzykowa jest wypełniona płynem pęcherzykowym. Otacza ją kilkupokładowa warstwa komórek ziarnistych. Owocyt wraz z otaczającymi go komórkami ziarnistymi tworzy wzgórek, zwany wzgórkiem jajonośnym.
Follicular antrum — jama pęcherzykowa: Primary oocyte — owocyt l rzędu; Zona pellucida — osłonka przejrzysta; Theca externa — warstwa zewnętrzna osłonki pęcherzyka; Theca interna — warstwa wewnętrzna osłonki pęcherzyka; Antrum — jama pęcherzykowa; Cumulus oophorus — wzgórek jajonośny
glikoproteiny. tworzące na powierzchni owocytu osłonkę przejrzysta (zona pellucida) (ryć. 1-8C). W miarę dalszego wzrostu pęcherzyka komórki osłonki pęcherzyka organizują się w wewnętrzną warstwę komórek wydzielniczych (tunica interna) oraz warstwę zewnętrzną (tunica externa) zawierająca tkankę łączną z komórkami fibroblastopodobnymi. Komórki pęcherzykowe natomiast wytwarzają małe. palczaste wypustki przechodzące przez osłonkę przejrzystą i przeplatające się z mikrokosmkami błony komórkowej owocytu. Wypustki te, jak się wydaje, maja istotne znaczenie przy transporcie materiałów z komórek pęcherzykowych do owocytu (13).
Podczas dalszego rozwoju pęcherzyka pomiędzy komórkami ziarnistymi pojawiają się wypełnione płynem przestrzenie, które następnie łączą się ze sobą tworząc jamę pęcherzykowa (cavum folliculi), a pęcherzyk nazywa się teraz pęcherzykiem jajnikowym wtórnym (dojrzewającym). Początkowo jama pęcherzykowa ma kształt półksiężyca, ale z czasem znacznie się powiększa (ryć. l -9A, B). Komórki otaczające owocyt pozostają nie zmienione i tworzą wzgórek jajonośny (cumulus oophorus).
Pęcherzyk jajnikowy po zakończeniu rozwoju osiąga średnicę 10 mm lub nawet większą i jest nazywany pęcherzykiem jajnikowym dojrzałym (pęcherzykiem Graafa) (folliculus ovaricus maturus). Otacza go bogato unaczyniona warstwa wewnętrzna osłonki pęcherzyka, składająca się z komórek o strukturze charakterystycznej dla komórek wytwarzających i uwalniających steroidy (14). oraz warstwa zewnętrzna osłonki, stopniowo zlewająca się ze zrębem jajnika (ryć. 1-9).
Podczas każdego cyklu jajnikowego zaczyna się rozwijać kilkanaście pęcherzyków, ale zazwyczaj tylko jeden osiąga pełną dojrzałość. Pozostałe pęcherzyki ulegają atrezji. Jak tylko pęcherzyk osiągnie dojrzałość, owocyt I rzędu podejmuje pierwszy podział dojrzewania, co doprowadza do utworzenia dwóch komórek potomnych niejednakowej wielkości, ale z 23 dwuchromatydowymi chromosomami w każdej (ryć. 1-10A, B). Jedna z nich. owocyt II rzędu, otrzymuje prawie
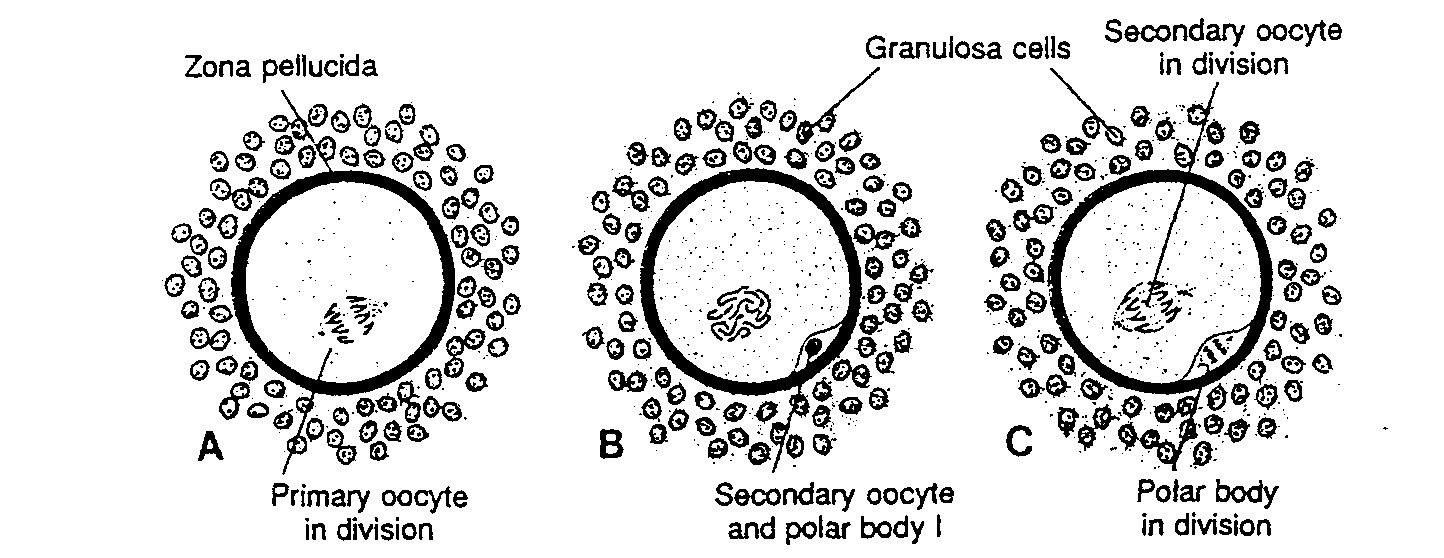
Ryć. 1-10. Dojrzewanie owocytu. A. Owocyt l rzędu z wrzecionem podziałowym w pierwszym podziale mejotycznym. B, Owocyt II rzędu i l ciałko kierunkowe. Zwraca uwagę brak otoczki jądrowej. C, Owocyt II rzędu z wrzecionem podziałowym w drugim podziale dojrzewania. Dzieli się także l ciałko kierunkowe. (Na podstawie kilku źródeł). Zona pellucida — osłonka przejrzysta; Granulosa cells — komórki ziarniste: Primary oocyte in diyision — owocyt l rzędu w czasie podziału; Secondary oocyte and polar body — owocyt II rzędu i ciałko kierunkowe l; Secondary oocyte in division — owocyt II rzędu w czasie podziału; Polar body in division — ciałko kierunkowe w czasie podziału
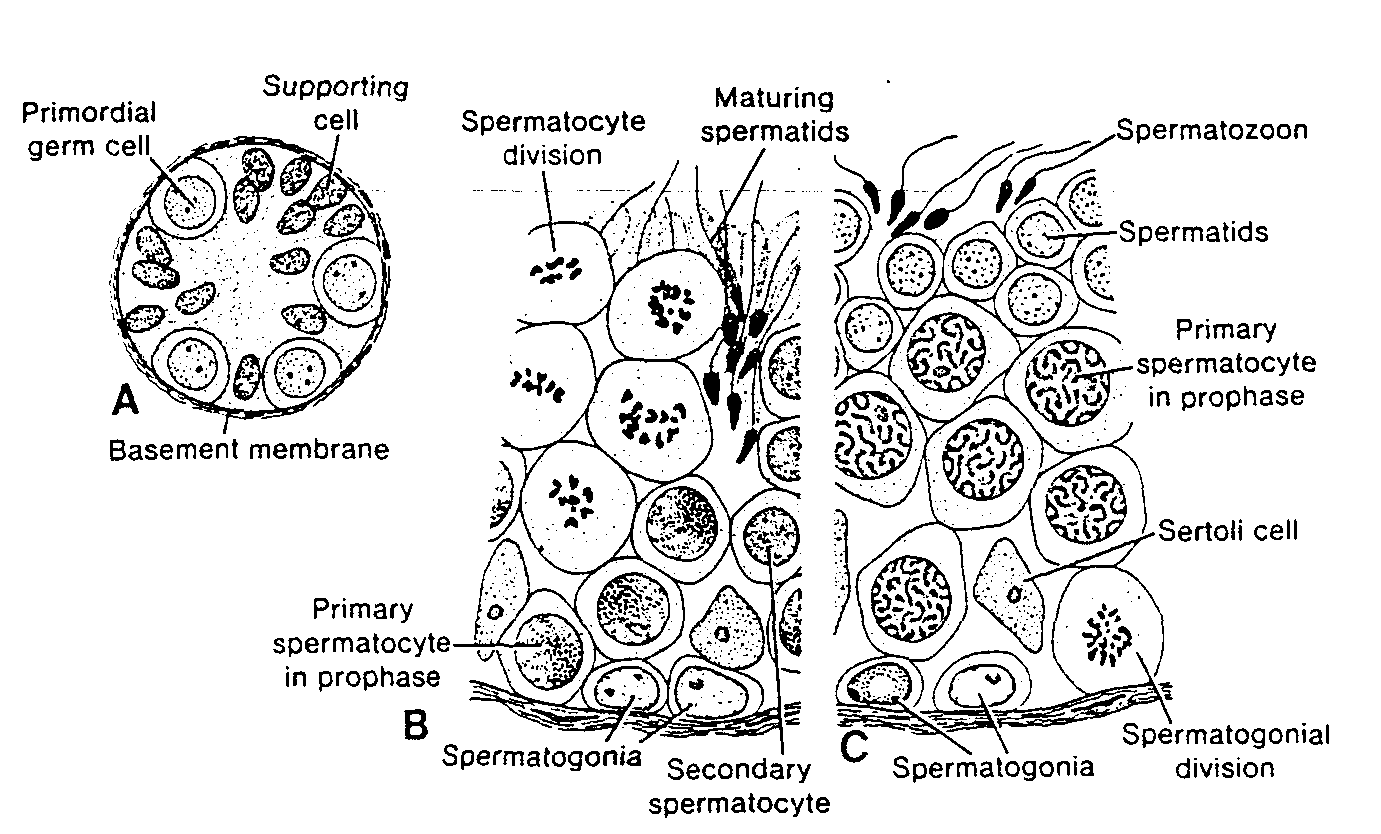
Ryć. 1-11. A, Przekrój poprzeczny przez niedojrzały sznur płciowy (niedojrzały kanalik nasienny kręty) noworodka płci męskiej z pierwotnymi komórkami płciowymi i komórkami podporowymi. 8 i C, Dwa fragmenty kanalika krętego w przekroju poprzecznym. Zwracają uwagę różne stadia spermatogenezy.
Primordial germ celi — pierwotna komórka płciowa; Supporting celi — młoda komórka podporowa: Basement membranę — błona podstawna; Spermatocyte division — podział spermatocytu; Spermatogonia — spermatogonie: Maturing spermatids — dojrzewające spermatydy; Secondary spermatocyte — spermatocyt II rzędu; Spermatozoon — plemnik; Primary spermatocyte in prophase — spermatocyt l rzędu w profazie; Spermatogonial division — podział spermatogonii
całą cytoplazmę, podczas gdy druga, czyli pierwsze ciałko kierunkowe praktycznie jej nie ma. Ciałko kierunkowe układa się pomiędzy osłonką przejrzystą i błona komórkową owocytu II rzędu w przestrzeni okołożółtkowej* (ryć. 1-10B). Zakończenie pierwszego podziału rnejotycznego następuje na krótko przed owulacją.
Po zakończeniu pierwszego podziału dojrzewania, zanim jądro owocytu II rzędu ulegnie całkowitemu odtworzeniu, komórka rozpoczyna, nie replikując DNA, drugi podział mejotyczny. Owulacją i wydalenie komórki jajowej z jajnika zachodzi wówczas, gdy w owocycie II rzędu utworzy się wrzeciono podziałowe, a chromosomy ułożą się w płytkę równikową (ryć. 1-IOC). (15). Drugi podział dojrzewania kończy się tylko wówczas, gdy owocyt zostanie zapłodniony, w przeciwnym przypadku, mniej więcej po 24 godzinach ód owulacji, owocyt degeneruje się. Nie jest pewne, czy pierwsze ciałko kierunkowe dzieli się, czy nie, ale zaobserwowano występowanie zapłodnionych owocytów z towarzyszącymi im trzema ciałkami kierunkowymi.
* Tradycyjna nazwa oznaczająca przestrzeń pomiędzy osłonką przejrzystą i błoną komórki jajowej.
SPERMATOGENEZA
Spermatogeneza obejmuje wszystkie zjawiska zachodzące w procesie przekształcania się spermatogonii w plemniki. Różnicowanie pierwotnych komórek płciowych rozpoczyna się u mężczyzn w okresie pokwitania, natomiast u kobiet już w okresie płodowym podczas 3 miesiąca rozwoju. W okresie okołoporodowym komórki płciowe mężczyzny można rozpoznać w sznurach płciowych (niedojrzałe kanaliki nasienne kręte) jądra jako duże, słabo zabarwione komórki otoczone przez młode
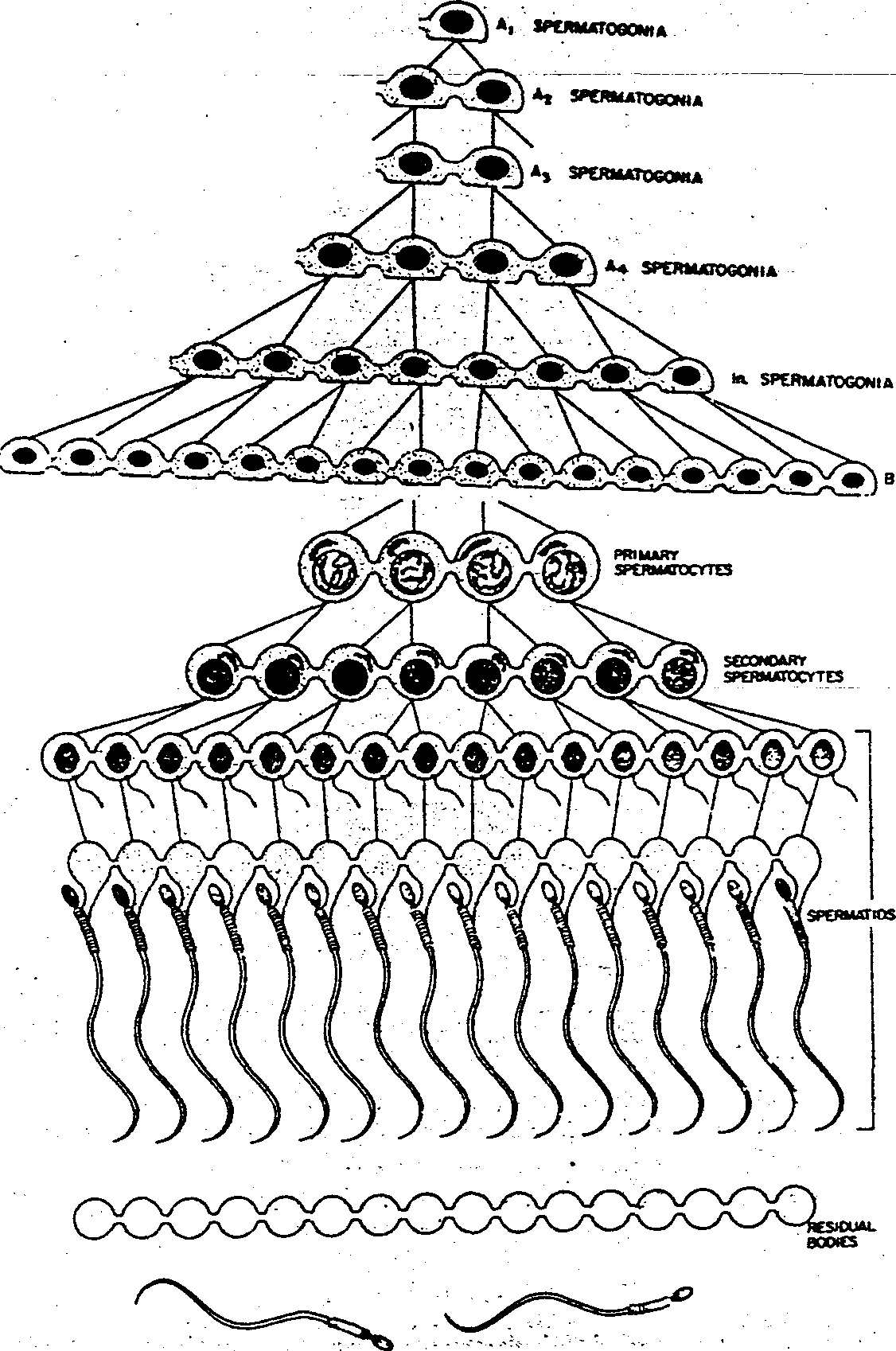
Ryć. 1-12. Rysunek przedstawiający klonalne pochodzenie męskich komórek płciowych. Cytokinezę kończą jedynie najmniej zróżnicowane spermatogonie typu A, uzupełniające populację komórek macierzystych. Po opuszczeniu przez spermatogonię typu A populacji komórek macierzystych po każdym następnym podziale pozostaje mostek cytoplazmatyczny łączący komórki, aż do chwili gdy pojedyncze plemniki oddzielą się od ciałek resztkowych. W rzeczywistości liczba komórek połączonych ze sobą jest znacznie większa, niż to przedstawiono na rycinie. (Zapożyczone z D.W. Fawcetta: 8/oom and fawcelt: A Tetbook oi Histo/ogy, Philadelphia, W.B. Saunders, 1986).
Primary spermatocyte — spermatocyt l rzędu; Secondary spermatocyte — sper-matocyt II rzędu; Residual bodics — rialka resztkowe
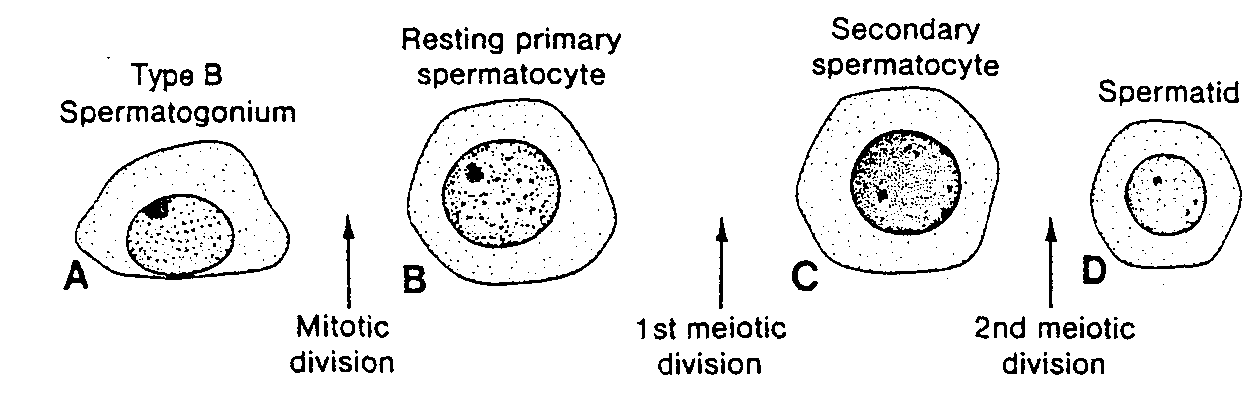
Ryć. 1-13. Schematycznie przedstawiona spermatogeneza człowieka.
Ty po B Spermatogonium — ipermalogonia typu B; Mitntic division — podział mitotyczny; RestinK prim.irv spermatocyte — spoczynkowy spermatocyt l rzędu: 1st meiotic clwision — pierws/y podział rnejotyczny Secondary spermatocyte — spermatocyt II rzędu; 2nd meiotic divisinn — drugi podział mejotyczny: Spermatid — spermatyda
komórki podporowe (ryć. l-HA). Te ostatnie prawdopodobnie pochodzą z nabłonka powierzchniowego gruczołu, podobnie jak komórki pęcherzykowe jajnika, i dają początek komórkm podporowym (komórkom Sertolego).
Na krótko przed pokwTufhiem w sznurach płciowych pojawia się światło i przekształcają się one w kanaliki nasienne kręte. W tym samym prawie okresie z pierwotnych komórek płciowych powstają spermatogonie, wśród których rozróżnia się dwa typy: spermatogonie typu A dzielące się mitotycznie i stanowiące stałe źródło komórek macierzystych i spermatogonie typu B. z których powstają spermatocyty I rzędu. W normalnym procesie różnicowania niektóre spermatogonie typu A opuszczają populację komórek macierzystych i dają początek kolejnym generacjom spermatogonii. przy czym każda następna generacja jest bardziej zróżnicowana niż poprzednia (ryć. l-l l B. Ci l-l 2). Po zakończeniu ostatniego podziału komórek typu A dochodzi do utworzenia spermatogonii typu B; a gdy one z kolei podzielą się mitotycznie powstaną spermatocyty I rzędu (ryć. l-12). Spermatocyty I rzędu rozpo-
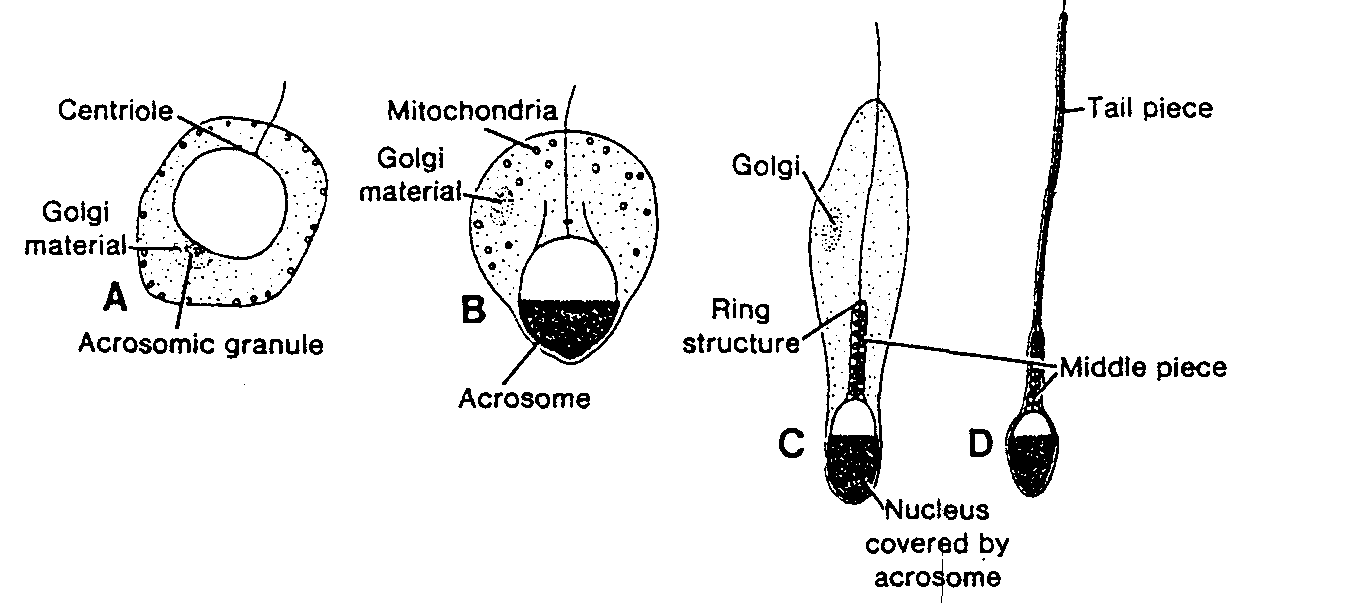
Ryc. 1-14. Schematyczne rysunki pokazujące ważne etapy w procesie przekształcania się ludzkiej spermatydy w plemnik. IZ pracy Clermonta i Leblonda).
Centriole — centriola; Golgi materiał — materiał z aparatu Colgiego; Acrosomic granule — ziarenko akrosomowe; Acrosome — akrosom; Ring structure — pierścień; Nucleus covered by acrosome — jądro pokryte przez akrosom; Taił piece — witka; Middle piece — wstawka
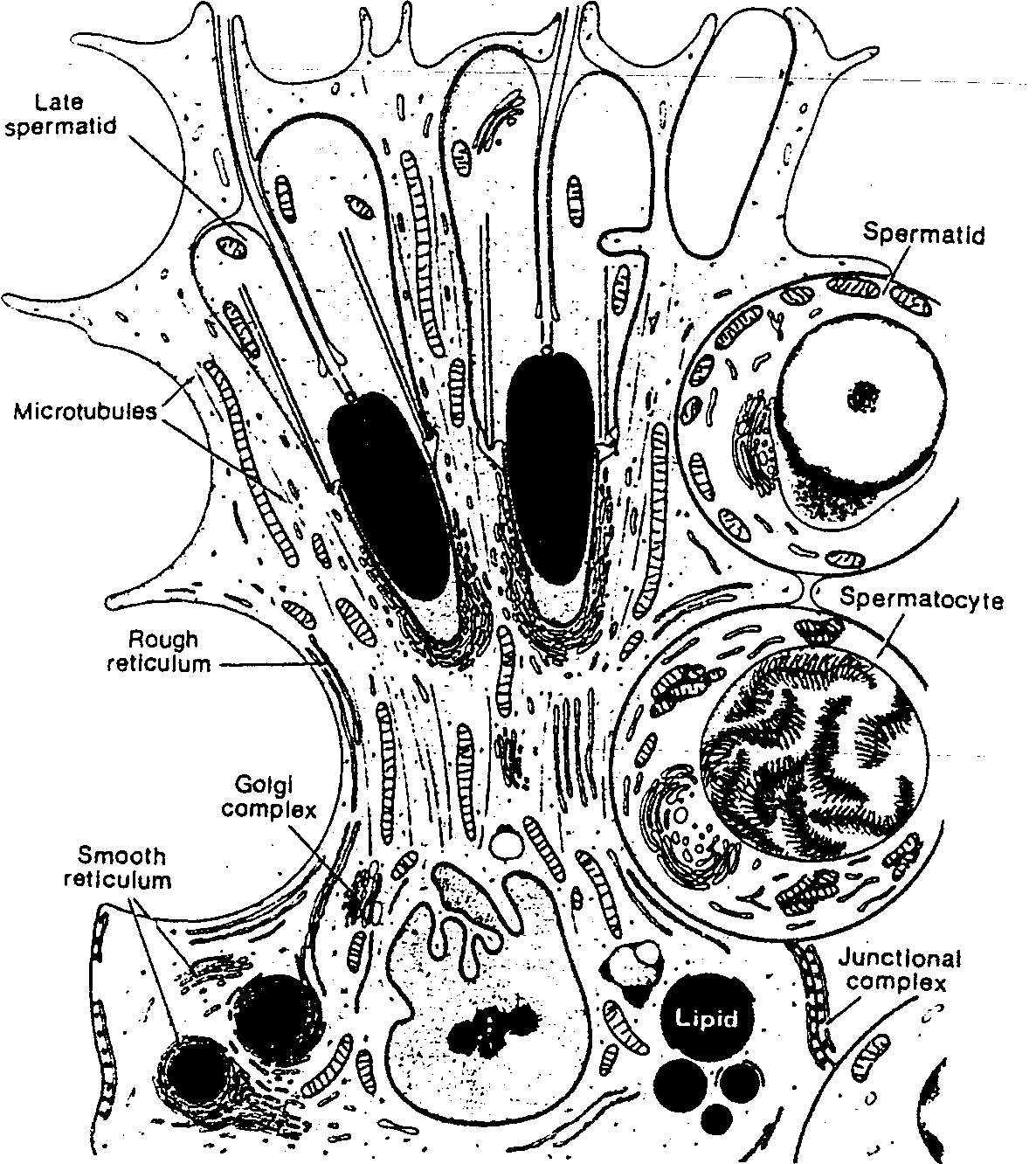
Ryć. 1-15. Zdjęcie komórki podporowej Sertolego pod dużym powiększeniem pokazujące jej powiązanie z komórkami płciowymi. Spermatocyty i wczesne spermatydy znajdują się w zazębieniach w podstawno-bocznej powierzchni komórki, a późne spermatydy w głębokich zachyłkach w pobliżu jej wierzchołka (Zapożyczono z D.W. Fawcetta: Bloom i fanreff: A Texbook oi Histology. Philadelphia. W.B. Saunders. 1986). L.ite spermatid — spermatycla późna: Microtubules — mikrntuhule; Rough reticulum — siateczka srodplazrndtytzna szorstka; Colgi complex — aparat Colgiego; Smooth reticulum — siateczka śródplazmatycz-na gładka; Spermatid — spermatyda; Spermatocyte — spermatocyt: Junctional complex — kompleks połączeń międzykomórkowych
czynają następnie wydłużoną profazę (22 dni), po której następuje szybkie zakończenie pierwszego podziału mejotycznego i utworzenie spermatocytów II rzędu. Komórki te zaczynają natychmiast po drugim podziale mejotycznym przekształcać się w spermatydy (ryć. 1-12, 1-13 i 1-14), zawierające 23 chromosomy, czyli liczbę haploidalną. W czasie gdy zachodzą te procesy, od momentu gdy spermatogonie typu A opuszczą populacje komórek macierzystych, do czasu gdy uformują się spermatydy, cytokineza nie ulega zakończeniu, tak że następujące po sobie generacje komórek są połączone mostkami cytoplazmatycznymi. W ten sposób komórki pochodzące z pojedynczej spermatogonii typu A tworzą grupę komórek płciowych
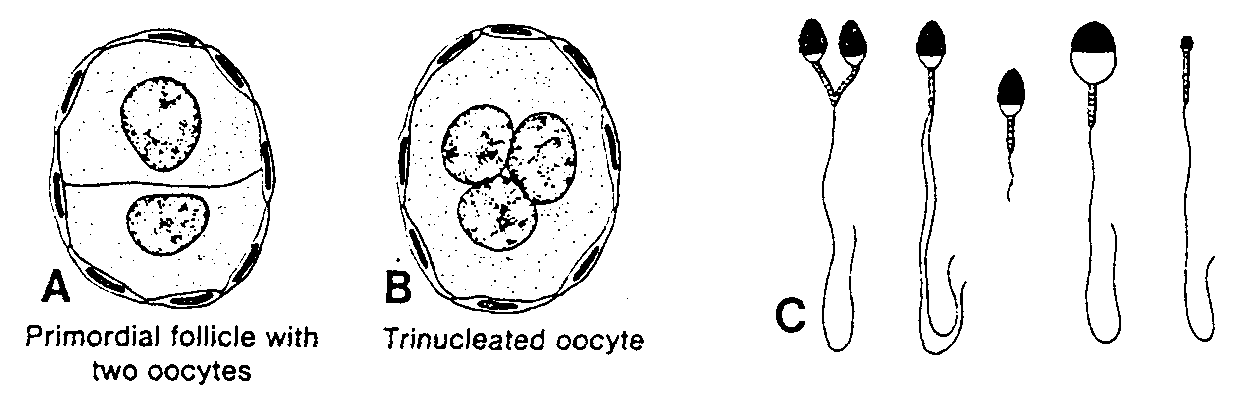
Ryć. 1-16. Rysunki nieprawidłowych komórek płciowych kobiety i mężczyzny. A, Pierwotny pęcherzyk jajnikowy z dwoma owocytami. B, Owocyt z trzema jądrami; C, Różne formy nieprawidłowych plemników. Primordial follicle with two oocytes — pierwotny pęcherzyk jajnikowy z dwoma osvocytami; Trinucleated oocyte — owocyt z trzema jądrami
pozostających z sobą w kontakcie w czasie różnicowania (ryć. 1-12). Ponadto spermatogonie i spermatydy pozostają w czasie rozwoju pogrążone w głębokich zachyłkach komórek podporowych (Sertolego) (ryć. 1-15). W ten sposób komórki Sertolego podtrzymują i chronią komórki płciowe, uczestniczą w ich odżywianiu i mają udział w uwalnianiu dojrzałych plemników.
SPERMIOGENEZA
Seria zmian prowadzących do przekształcenia spermatyd w plemniki nazywa się spermiogenezą. Zmiany te obejmują f a) utworzenie akrosomu, zajmującego ponad połowę powierzchni jądra plemnika i zawierającego enzymy pomocne przy wnikaniu do komórki jajowej i przechodzeniu przez otaczające ją struktury w czasie zapłodnienia (ryć. 1-14B, C); (b) kondensację jądra; (c) utworzenie szyjki, wstawki i witki (ryć. 1-14C) oraz (d) pozbycie się większości cytoplazmy (ryć. 1-14D). Okres potrzebny do rozwinięcia się spermatogonii w dojrzały plemnik wynosi u ludzi w przybliżeniu 64 dni (16).
Po całkowitym uformowaniu plemniki przechodzą do światła kanalików nasiennych krętych. Stamtąd są transportowane w kierunku najądrza za pomocą elementów kurczliwych kanalików nasiennych krętych. Plemniki wykazujące początkowo nieznaczną ruchliwość stają się w pełni ruchliwe w najądrzu.
NIEPRAWIDŁOWE GAMETY
U ludzi, podobnie jak u większości ssaków, pojedynczy pęcherzyk jajnikowy zawiera niekiedy dwa lub trzy wyraźnie oddzielone od siebie owocyty I rzędu (ryć. 1-16A). Z owocytów tych mogą niekiedy wykształcić się bliźnięta lub trojaczki, przeważnie jednak ulegają one zwyrodnieniu jeszcze przed osiągnięciem dojrzałości. W rzadkich przypadkach owocyt I rzędu ma dwa lub trzy jądra (ryć. 1-16B). Owocyty takie obumierają, zanim staną się zdolne do zapłodnienia. W przeciwieństwie do nietypowych owocytów nieprawidłowe plemniki spotyka się często. Nieprawidłowość może dotyczyć zarówno główki, jak i witki plemników. Plemniki mogą także mieć zbyt małe lub zbyt duże rozmiary albo zlewać się z sobą. Istnieją dane wskazujące, że 10% plemników może być nieprawidłowych bez zmniejszenia płodności. Jeśli jednak 25% lub więcej plemników odbiega od normy, to zdolność do zapłodnienia obniża się.
STRESZCZENIE
Przygotowując się do zapłodnienia zarówno męskie, jak i żeńskie komórki płciowe podlegają licznym chromosomowym i morfologicznym zmianom składającym się łącznie na proces zwany gametogenezą. Zmiany chromosomowe zachodzą podczas podziałów mejotycznych. Podczas pierwszego podziału mejo-tycznego homologiczne chromosomy układają się w pary i wymieniają między sobą materiał genetyczny; podczas drugiego podziału mejotycznego komórki nie replikują DNA. Dlatego każda dojrzała komórka płciowa zawiera haploidalną liczbę chromosomów i potowe ilości DNA występującą w normalnej komórce somatycznej (ryć. 1-2). Tym samym dojrzałe gamety żeńskie mają 22 autosomy + chromosom X, a męskie — 22 autosomy + chromosom X lub 22 autosomy + chromosom Y.
Pierwsze postacie komórek płciowych człowieka, zwane pierwotnymi komórkami płciowymi, pojawiają się w ścianie pęcherzyka żółtkowego (ryć. 1-5) przy końcu 3 tygodnia rozwoju i wędrują do niezróżnicowanej gonady, gdzie docierają w 5 tygodniu. U mężczyzny proces dojrzewania pierwotnej komórki płciowej i wytwarzania dojrzałej gamety jest nazywany spermatogenezą, a u kobiety owogenezą. U kobiety pierwotne komórki płciowe różnicują się w owogonie. Po wielu podziałach z niektórych owogonii powstają owocyty I rzędu, które bezpośrednio po powstaniu rozpoczynają pierwszy podział mejotyczny. Do 7 miesiąca życia płodowego wszystkie owocyty l rzędu rozpoczynają już ten podział i większość z nich otaczają płaskie komórki pęcherzykowe (ryć. 1-7). Wspólnie z owocytem tworzą one pęcherzyki jajnikowe pierwotne. Owocyty l rzędu nie kończą pierwszego podziału dojrzewania, lecz pozostają w stadium diplotenu aż do okresu pokwitania. W momencie urodzenia całkowita liczba owocytów l rzędu wynosi od 700 000 do 2 000 000.
Począwszy od okresu pokwitania niewielka liczba pierwotnych pęcherzyków jajnikowych zaczyna dojrzewać w każdym cyklu jajnikowym, ale tylko jeden pęcherzyk osiąga gełną dojrzałość. W czasie dojrzewania z jednego owocytu l rzędu powstaje jeden owocyt ii rzędu i jedno ciałko kierunkowe. Z kolei z owocytu II rzędu powstaje dojrzały owocyt i następne ciałko kierunkowe. W ten sposób z jednego owocytu l rzędu tworzy się jeden owocyt II rzędu i trzy ciałka kierunkowe (ryć. 1-3).
U mężczyzny pierwotne komórki płciowe pozostają w stanie spoczynku aż do okresu pokwitania i dopiero wówczas różnicują się w spermatogonie. Są to komórki macierzyste różnicujące się w spermatocyty l rzędu, z których każdy po przejściu przez dwa następujące po sobie podziały mejotyczne wytwarza cztery spermatydy (ryć. 1-11). W następnej kolejności spermatydy przechodzą liczne zmianv (spermiogeneza) (ryć. 1-14) obejmujące: (a) utworzenie akrosomu; (b) kondensację jądra; (c) uformowanie się szyjki, wstawki i witki i (d) odrzucenie większej części cytoplazmy. Powstanie dojrzałych plemników ze spermatogonii trwa około 64 dni.
Rozdział 2
OD OWULACJI DO IMPLANTACJI
(PIERWSZY TYDZIEŃ ROZWOJU)
Cykl jajnikowy
W okresie pokwitania u kobiety pojawiają się regularne cykle miesiączkowe. Cykle te zwane cyklami płciowymi żeńskimi znajdują się pod kontrola podwzgó-rza (l, 2). Wytwarzana .przez podwzgórze gonadoliberyna oddziałuje na komórki przedniego pląta przysadki, a te z kolei wydzielają gonadotropiny. Hormony te, folitropina (FSH) i lutropina (LH), pobudzają i kontrolują cykliczne zmianyjajnika (patrz ryć. 2-13).
Na początku każdego cyklu jajnikowego (rodzaj cyklu płciowego żeńskiego) pewna liczba pierwotnych pęcherzyków jajnikowych (od 5 do 15) wzrasta pod wpływem folitropiny (ryć. 2-1). W normalnych warunkach tylko jeden z nich osiąga
Ryć. 2-1. Rysunek pokazuje zmiany zachodzące w pęcherzyku jajnikowym pierwotnym w pierwszej połowie cyklu jajnikowego. Pod wpływem folitropiny pęcherzyk pierwotny (A) rozwija się i staje się pęcherzykiem dojrzałym (C). Obecny w pęcherzyku owocyt l rzędu pozostaje w stadium diplotenu prawie do owulacji. W czasie ostatnich kilku dni wzrostu pęcherzyka estrogeny, wytwarzane przez komórki ziarniste i komórki osłonki pęcherzyka, pobudzają wytwarzanie lutropiny przez przysadkę (patrz ryć. 2-13). Primary oocyte — owocyt l rzędu; Primordial folłicie — pęcherzyk jajnikowy pierwotny; Cranułosa cetls — komórki ziarniste; Zona pellucida —- osłonka przejrzysta; Maturing iollicle — pęcherzyk wzrastający; Theca externa — warstwa zewnętrzna osłonki pęcherzyka; Theca interna — warstwa wewnętrzna osłonki pęcherzyka; Antrum — jama pęcherzyka; Vesicular or Craanan folłicie — pęcherzyk jajnikowy dojrzały (pęcherzyk Graafa)
pełna dojrzałość i tylko jeden owocyt zostaje wydalony na zewnątrz, a pozostałe degenerują się i przekształcają w pęcherzyki atrezyjne. W następnym cyklu wzrasta kolejna grupa pęcherzyków i ponownie tylko jeden z nich osiąga dojrzałość. W efekcie większość pęcherzyków degeneruje się jeszcze przed osiągnięciem pełnej dojrzałości. W pęcherzykach atrezyjnych owocyt i otaczającego komórki pęcherzykowe degenerują się i zostają zastąpione przez tkankę łączną. W ten sposób powstaje pęcherzyk lub ciałko atrezyjne (folliciilits atreticus; corpus atreticum). W czasie wzrostu pęcherzyka jajnikowego powstaje duża liczba komórek ziarnistych i osłonki pęcherzyka. Komórki te wspólnie wytwarzają estrogeny, które (a) powodują wejście błony śluzowej macicy w fazę wzrostu, zwaną także fazą folikularną; i (b) pobudzają wydzielanie lutropiny przez przysadkę. Gwałtowny wzrost stężenia tego hormonu jest niezbędny do osiągnięcia przez pęcherzyk jajnikowy pełnej dojrzałości i wydostania się z pęcherzyka owocytu, co określa się jako owulację lub jajeczkowanie (ryć. 2-13).
Owulacja (jajeczkowanie)
Na kilka dni przed owulacją .pęcherzyk.jajnikowy pod wpływem folitropiny i lutropiny gwałtownie się powiększa i osiąga średnicę 15 mm. W ostatniej fazie rozwoju pęcherzyka jajnikowego również owocyt I rzędu, który do tego czasu pozostawał w stadium diplotenu, podejmuje i kończy pierwszy podział mejotyczny. W tym samym czasie powierzchnia jajnika zaczyna się w jednym miejscu uwypuklać, a na szczycie uwypuklenia pojawia się nie unaczyniona plamka
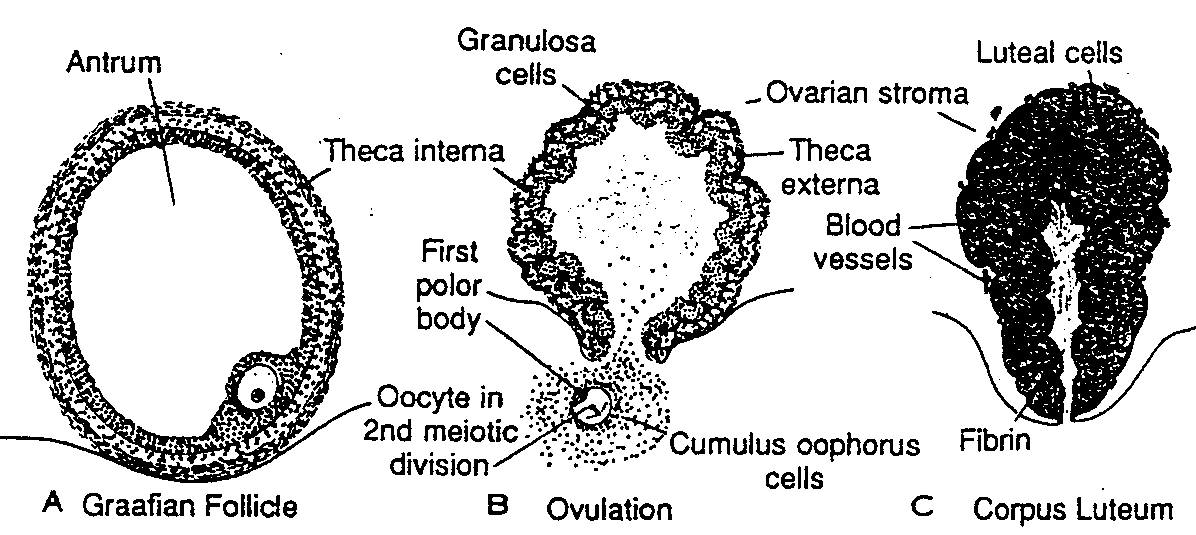
Ryć. 2-2. A, Pęcherzyk jajnikowy tuż przed pęknięciem. B, Owulacja. Owocyt rozpoczynający drugi podział mejotyczny wydostaje się z jajnika wraz z licznymi komórkami wzgórka jajonośnego. Komórki ziarniste pozostają we wnętrzu zapadniętego pęcherzyka i przekształcają się w komórki luteinowe. C, Ciałko żółte. Zwracają uwagę duże rozmiary ciałka żółtego spowodowane przerostem komórek ziarnistych i komórek warstwy wewnętrznej pęcherzyka oraz nagromadzeniem w nich lipidów. Nie zarośnięta część jamy pęcherzyka jest wypełniona wlóknikiem.
Antrum — jama pęcherzyka; Craafian folłicie — pęcherzyk jajnikowy dojrzały (Craafa); Theca interna
— warstwa wewnętrzna osłonki pęcherzyka; Cranułosa cells — komórki ziarniste; First polar body — pierwsze ciałko kierunkowe; Oocyte in 2nd meiotic division — owocyt w drugim podziale mejotycznym; Ovulation
— owuiacja; Ovarian stroma — zrąb jajnika; Theca externa — warstwa zewnętrzna osłonki pęcherzyka; Cumulus oophorus cells — komórki wzgórka jajonośnego; Luteal cells — komórki luteinowe; Blood vessels
— naczynia krwionośne; Fibrin - - wlóknik; Corpus luteum — ciałko żótte

Ryć. 2-3. A. Elektronogram z mikroskopu skenującego pokazujący emulację u myszy. Powierzchnia owocytu pokryta jest osłonka, przejrzysta,. Widać wzgórek jajonośny złożony z komórek ziarnistych. B, Elektronogram z mikroskopu skenującego przedstawiający owocyt królika w półtorej godziny po owulacji. Owocyt otoczony przez komórki ziarniste leży na powierzchni jajnika. Widać miejsce owulacji. (Z pracy J. van Blerkoma i P. Motty: The Cel/u/ar Bd.s/s 01 Mjmma/un Rcprorfuclion. Baltimore, Urhan & Schwarzenberg, 1979). Granuiosa cells — komórki ziarniste: Oocyte covered by zona pelludda — owocyt pokryty osłonką przejrzysty; Ovulation site — miejsce owulacji; Oocyte surrounded by granulosa cells — owocyt otoczony komórkami ziarnistymi; Sunące of ovary — powierzchnia jajnika
(gr. stigma). W wyniku miejscowego osłabienia i zwyrodnienia tkanek w obrębie powierzchni jajnika, w miejscu tej plamki stopniowo powstaje otwór, przez który wysącza się płyn pęcherzykowy. Następnie, po wypłynięciu większej ilości płynu i zmniejszeniu napięcia ściany pęcherzyka, owocyt wraz z towarzyszącymi mu komórkami ziarnistymi z wzgórka jajonośnego uwalnia się i wypływa z jajnika (ryć. 2-2 i 2-3) (3-5). Cześć komórek wzgórka jajonośnego układa się wówczas wokół osłonki przejrzystej i tworzy wieniec promienisty (corona radiata) (ryć. 2-5). Pierwszy podział mejotyczny zostaje zakończony w czasie owulacji, gdy owocyt wraz z komórkami wzgórka jajonośnego opuszcza jajnik, a powstały owocyt II rzędu rozpoczyna drugi podział mejotyczny (ryć. 2-2 B).
Niektóre kobiety odczuwają w czasie owulacji lekki ból, zwany bólem środka cyklu, gdyż normalnie występuje w połowie cyklu miesiączkowego. W ustaleniu terminu owulacji może pomóc zaobserwowanie towarzyszącego jej wzrostu temperatury.
Ciałko żółte (corpus luteum)
Do komórek ziarnistych pozostających po owulacji w ścianie pękniętego pęcherzyka wraz z komórkami warstwy wewnętrznej osłonki pęcherzyka dochodzą naczynia krwionośne będące odgałęzieniami naczyń otaczających pęcherzyk. Jednocześnie komórki ziarniste przybierają kształt wielościanów. Pod wpływem lutropiny pojawia się w nich żółty barwnik i przekształcają się w komórki luteinowe, tworzące ciałko żółte. Komórki luteinowe syntetyzują i uwalniają progesteron (ryć. 2-2 C). Hormon ten, wraz z hormonami estrogennymi powoduje wystąpienie w błonie śluzowej macicy fazy wydzielniczej (progesteronowej) (patrz ryć. 2-12), co stanowi przygotowanie do implantacji zarodka.
Transport komórki jajowej
Na krótko przed owulacja strzępki jajowodu zbliżają sie,do powierzchni jajnika, a jajowód zaczyna się rytmicznie kurczyć. Sądzi się, że komórka jajowa otoczona przez komórki ziarniste (ryć. 2-3 i 2-4) przedostaje się do jajowodu dzięki zagarniającym ją ruchom strzępków i ruchowi rzęsek nabłonka jajowodu (6-9). Po przejściu do jajowodu komórki wzgórka tracą kontakt z owocytem wyciągając wypustki cytoplazmatyczne z osłonki przejrzystej (10).
Owocyt przesuwa się w kierunku światła macicy dzięki skurczom komórek mięśniowych ściany jajowodu (11). Na szybkość transportu wpływa do pewnego stopnia stężenie hormonów w czasie i po owulacji. U kobiety zapłodniona komórka jajowa dochodzi do światła macicy po 3-4 dniach (patrz ryć. 2-11) (12, 13).
Ciałko białawe (corpus albicans)
Jeśl nie nie nastąpi zapłodnienie, to ciałko żólte osiągnie najwyższy stogień rozwoju około jednia po owulacji. Można je łatwo rozpoznać, gdyż tworzy żółtawe
Ryć. 2-4. Stosunek strzępków jajowodu do jajnika. Przypuszcza się, że podczas owulacji strzępki przesuwają się
nad pękniętym pęcherzykiem.
Crowing follicles — pęcherzyki wzrastające; Ruptured follicle — pęknięty pęcherzyk; Fimbriae — strzępki;
Uterine tubę — jajowód; Ampulla — bańka jajowodu; Cumulus oophorus cells — komórki wzgórka
jajonośnego: Secondary oocyte in 2nd meiotic division — Owocyt II rzędu podczas drugiego podziału
mejotycznego
uwypuklenie na powierzchni jajnika. Następnie ciałko żółte ulega zmniejszeniu na skutek zwyrodnienia komórek luteinowych i przekształca się w włóknistą, zbliz-nowaciałą tkankę, zwaną ciałkiem białawym (corpus albicans). Jednocześnie zmniejsza się wytwarzanie progesteronu, co przyspiesza wystąpienie krwawienia miesięcznego (patrz ryć. 2-13) (14, 15).
Jeśli owocyt zostanie zapłodniony, to ciałko żółte nie zwyrodnieje dzięki pojawieniu się gonadotropiny kosmówkowej (ang. human chorionic gonadotropin, HCG), hormonu wydzielanego przez trofoblast rozwijającego się zarodka. Pod wpływem tego hormonu ciałko żółte rośnie nadal i staje się ciałkiem żółtym ciążowym (corpus litteum graviditatis). Pod koniec 3 miesiąca może ono stanowić od jednej trzeciej do połowy masy całego jajnika. Komórki luteinowe kontynuują wytwarzanie progesteronu do końca 4 miesiąca; następnie ulegają one stopniowo zanikowi, w miarę jak trofoblast wchodzący wskład łożyska zaczyna syntetyzować i uwalniać wystarczająco dużo progesteronu, aby utrzymać ciążę. Usunięcie ciałka żółtego ciążowego przed 4 miesiącem ciąży zazwyczaj prowadzi do poronienia.
Obecnie dobrze wiadomo, że owulację można zahamować działaniem zwiążków chemicznych z grupy progesteronu (16). Progestageny przyjmowane doustnie między 5 i 25 dniem cyklu miesiączkowego działają jako związki antykoncepcyjne i hamują owulację w prawie 100% przypadków. Większość używanych obecnie preparatów antyowulacyjnych zawiera również niewielką ilość estrogenu, jako dodatek do progestagenu. Składnik estrogenowy takiego preparatu również hamuje owulację, a składnik progestagenowy zapewnia wystąpienie normalnego krwawienia miesięcznego po odstawieniu preparatu w 25 dniu cyklu. Sadzi się. że oba hormony działają na podwzgórze. na zasadzie sprzężenia zwrotnego. Wstępne obserwacje wskazują, że całkowicie hamują one dojrzewanie pęcherzyków.
Zapłodnienie
Zapłodnienie (fertillisatio), czyli proces łączenia się gamety męskiej i żeńskiej zachodzi w bańce jajowodu. Jest to najszersza część jajowodu, leżąca w pobliżu jajnika (ryc. 2-4). Plemniki mogą zachować żywotność w układzie rozrodczym kobiety około 24 godzin, natomiast owocyt II rzędu, jeśli nie zostanie zapłodniony (17), przypuszczalnie obumiera w ciągu 12 do 24 godzin po owulacji.
Plemniki szybko przedostają się z pochwy do macicy, a następnie do jajowodu. Transport plemników w kierunku bańki jajowodu jest zapewne spowodowany skurczami komórek mięśniowych macicy i jajowodu. Należy pamiętać, że plemniki bezpośrednio po przedostaniu się do dróg rodnych kobiety nie są zdolne do zapłodnienia owocytu. Aby tę zdolność uzyskać, muszą (a) przejść kapacytację (uzdatnnianie) i (b) musi w nich zajść reakcja akrosomowa.
Kapacytacja stanowi proces przygotowawczy zachodzący w drogach rodnych samicy i trwa u kobiety około 7 godzin. W tym czasie z błony komórkowej leżącej nad akrosomem zostaje usunięta osłonka glikoproteinowa i białka płynu nasiennego. Zakończenie kapacytacji umożliwia wystąpienie reakcji akrosornowej (18, 19).
Reakcja akrosomowa zachodzi w bezpośrednim sąsiedztwie owocytu pod wpływem substancji uwalnianych z komórek wieńca promienistego i komórki jajowej (20). Pomiędzy błoną komórkową plemnika i zewnętrzną błoną akrosomowa powstają liczne punktowe połączenia, co umożliwia uwolnienie zawartości akrosomu (ryć. 2-5) potrzebnej do przeniknięcia plemnika przez wieniec promienisty i osłonkę przejrzystą. Podczas reakcji akrosomowej uwalniane są następujące substancje: (a) hialuronidaza. pomocna przy przenikaniu plemnika przez barierę utworzoną przez wieniec promienisty (21); (b) trypsynopodobne enzymy potrzebne do wytrawienia przejścia w osłonce przejrzystej (22); (c) akrozyna, związana z wewnętrzną powierzchnią błony akrosomowej i również ułatwiająca plemnikom sforsowanie osłonki przejrzystej (23, 24).
FAZA 1: PRZENIKANIE PLEMNIKÓW PRZEZ WIENIEC PROMIENISTY
Spośród 200 do 300 milionó plemników wprowadzonych do dróg rodnych kobiety tylko 300 do 500 dociera do miejsca zapłodnienia. Ponieważ zapłodnienia dokonuje jeden plemnik, sądzi się, że pozostałe są pomocne przy przechodzeniu przez wieniec promienisty, stanowiący pierwszą barierą chroniącą żeńską gametę (ryć. 2-5). Początkowo przypuszczano, że najważniejszą rolę w procesie rozpraszania komórek wieńca odgrywa hialuronidaza. Obecnie uważa się, że komórki
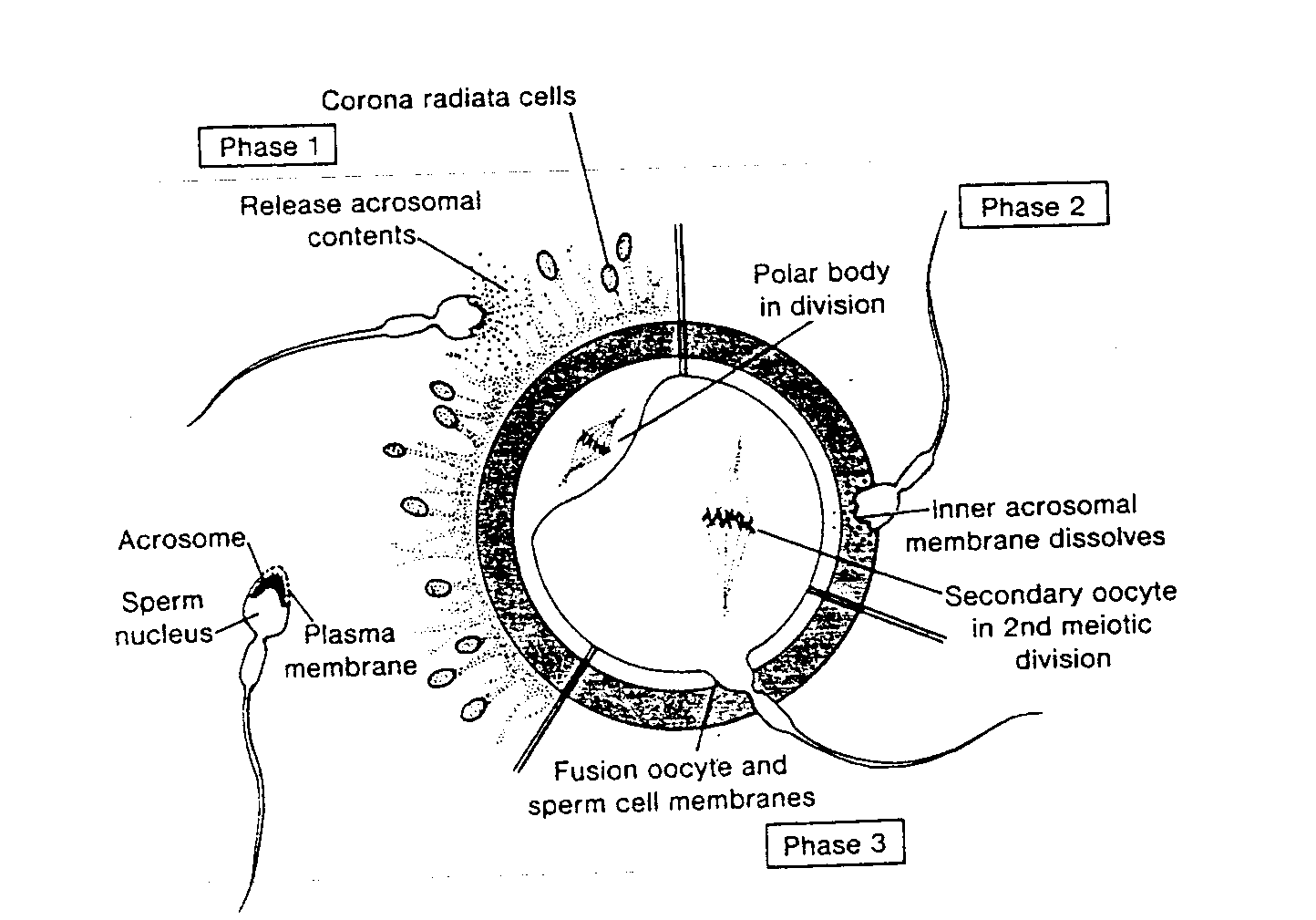
Ryć. 2-5. Schematycznie przedstawione trzy fazy zbliżania się plemnika do komórki jajowej. W fazie 1 plemnik forsuje barierę utworzoną przez wieniec promienisty; w fazie 1 jeden lub więcej plemników przenika przez osłonkę przejrzystą; w fazie 3 jeden plemnik przechodzi przez błonę owocytu. tracąc przy tym własną błonę komórkową. Rysunek po lewej stronie pokazuje normalny plemnik z czapeczka akrosomową. Acrosome — akrosom; Sperm nucleus — jądro plemnika: Plasma membranę — błona komórkowa; Phase 1 — faza 1; Corona radiata cells — komórki wieńca promienistego; Release atrosomal contents — iplemnik) uwalnia zawartość akrosomu; Polar body in division — dzielące się ciałko kierunkowe; Inner acrosomal membranę dissoives — rozpuszcza się wewnętrzna błona akrosomową; Secondary oocyte in 2nd meiotic division — owocyt II rzędu podczas drugiego podziału mejotycznego; Phase 3 — faza 3; Fusion oocyte and sperm celi membranes — fuzja błony komórkowej owocytu i plemnika
wieńca promienistego są rozpraszane dzięki łącznemu działaniu enzymów nasienia i enzymów z błony śluzowej jajowodu (17).
FAZA 2: PRZENIKANIE PLEMNIKÓW PRZEZ OSŁONKĘ PRZEJRZYSTĄ
Tę drugą barierę chroniącą żeńską gametę plemniki przenikają z pomocą enzymów uwalnianych z wewnętrznej błony akrosomowej (ryć. 2-5) (15). Plemnik po zetknięciu się z osłonką przejrzysta zostaje z nią silnie związany i szybko przez nią przenika. Przepuszczalność osłonki przejrzystej zmienia się po zetknięciu się głowy plemnika z powierzchnią owocytu. Powoduje to uwolnienie enzymów lizosomalnych wywołujących zmianę we właściwościach osłonki przejrzystej (reakcja osłony) i inaktywuje swoiste gatunkowo receptory dla plemników (25). W osłonce przejrzystej mogą znajdować się dalsze plemniki, ale w zasadzie tylko jeden może wniknąć do owocytu (ryć. 2-6 B) (26). W rzadkich przypadkach do żeńskiej gamety wchodzą dwa plemniki jednocześnie i wówczas może powstać zarodek z 69 chromosomami (27).
FAZA 3: ZLEWANIE SIĘ (FUZJA) BŁONY KOMÓRKOWEJ OWOCYTU l PLEMNIKA
Natychmiast po zetknięciu się plemnika z owocytem dochodzi do fuzji pomiędzy ich błonami komórkowymi (ryć. 2-5). Ponieważ błona komórkowa pokrywająca czapeczkę akrosomową zaniknęła podczas reakcji akrosomowej, fuzja zachodzi pomiędzy błoną owocytu i błoną pokrywającą tylną cześć główki plemnika (ryć. 2-5). U człowieka zarówno główka, jak i witka plemnika wchodzą do cytoplazmy owocytu, natomiast błona komórkowa plemnika pozostaje na jego powierzchni (26).
Zaraz po wniknięciu plemnika do owocytu komórka jajowa wykazuje trzy różne reakcje:
1. Reakcja korowa i reakcja osłony. W wyniku uwolnienia, ziaren korowych owocytu, zawierających enzymy lizosomalne, (a) błona owocytu staje się nieprzepuszczalna dla innych plemników i (b) osłonka przejrzysta zmienia swoją budowę i skład, być może na skutek usunięcia swoistych receptorów dla plemników. W ten sposób nie dochodzi do wnikania do komórki jajowej kilku plemników, czyli do polispermii.
2. Zakończenie drugiego podziału dojrzewania. Owocyt kończy drugi podział dojrzewania natychmiast po wniknięciu plemnika. Jedna z komórek potomnych zapłodnionego jaja, zwana drugim ciałkiem kierunkowym, po podziale prawie nie zawiera cytoplazmy; druga natomiast staje się dojrzałym lub ostatecznym owocytem (dojrzałym jajem, dojrzałą komórką jajową). Chromosomy tego owocytu (w liczbie 22 + X) znajdują się w pęcherzykowatym jądrze, zwanym przedjądrzetn żeńskim (ryć. 2-6 B).
3. Aktywacja metaboliczna komórki jajowej. Czynnik aktywujący metabolizm jaja jest prawdopodobnie dostarczany przez plemnik. Sądzi się, że następująca po fuzji błon aktywacja jaja dotyczy początkowych reakcji zachodzących na poziomie komórkowym i molekularnym i związanych z wczesną embriogenezą.
W tym czasie plemnik przesuwa się w głąb jaja aż znajdzie się w pobliżu żeńskiego przedjądrza. Jądro plemnika pęcznieje i tworzy przedjadrze męskie (ryć. 2-6 C), natomiast witka odczepia się i wyrodnieje. Morfologicznie nie można odróżnić przedjądrza męskiego od żeńskiego. Ostatecznie oba przedjądrza wchodzą z sobą w ścisły kontakt i tracą otoczkę jądra (ryc. 2-7 A) (28, 29). Oba haploidalne przedjądrza powiększają się i replikują - DNA (30). Gdyby replikacja nie nastąpiła, wówczas każda komórka zygoty dwukomórkowej* miałaby połowę normalnej ilości DNA. Bezpośrednio po zakończeniu syntezy DNA chromosomy wiążą się z wrzecionem podziałowym w przygotowaniu do normalnego podziału mitotycznego. Wszystkie chromosomy — 23 matczyne i 23 ojcowskie (dwuchromatydowe) — rozdzielają się wzdłuż w obrębie centromeru, a chromatydy siostrzane wędrują do przeciwległych biegunów komórki, zapewniając w ten sposób każdej komórce zygoty normalną diploidalną liczbę chromosomów i normalną ilość DNA (ryć. 2-6 D, E). W czasie gdy siostrzane chromatydy wędrują do biegunów, na powierzchni komórki pojawia się głęboka bruzda, dzieląca stopniowo cytoplazme na dwie części (ryć. 2-6 F i 2-7 B).
* Zygota wg ścisłej definicji jest to zapłodniona komórka jajowa. W piśmiennictwie anglosaskim termin ten jest często używany do oznaczenia zarodka, który jeszcze nie wszczepił się do błony śluzowej macicy (przyp. tłum.).
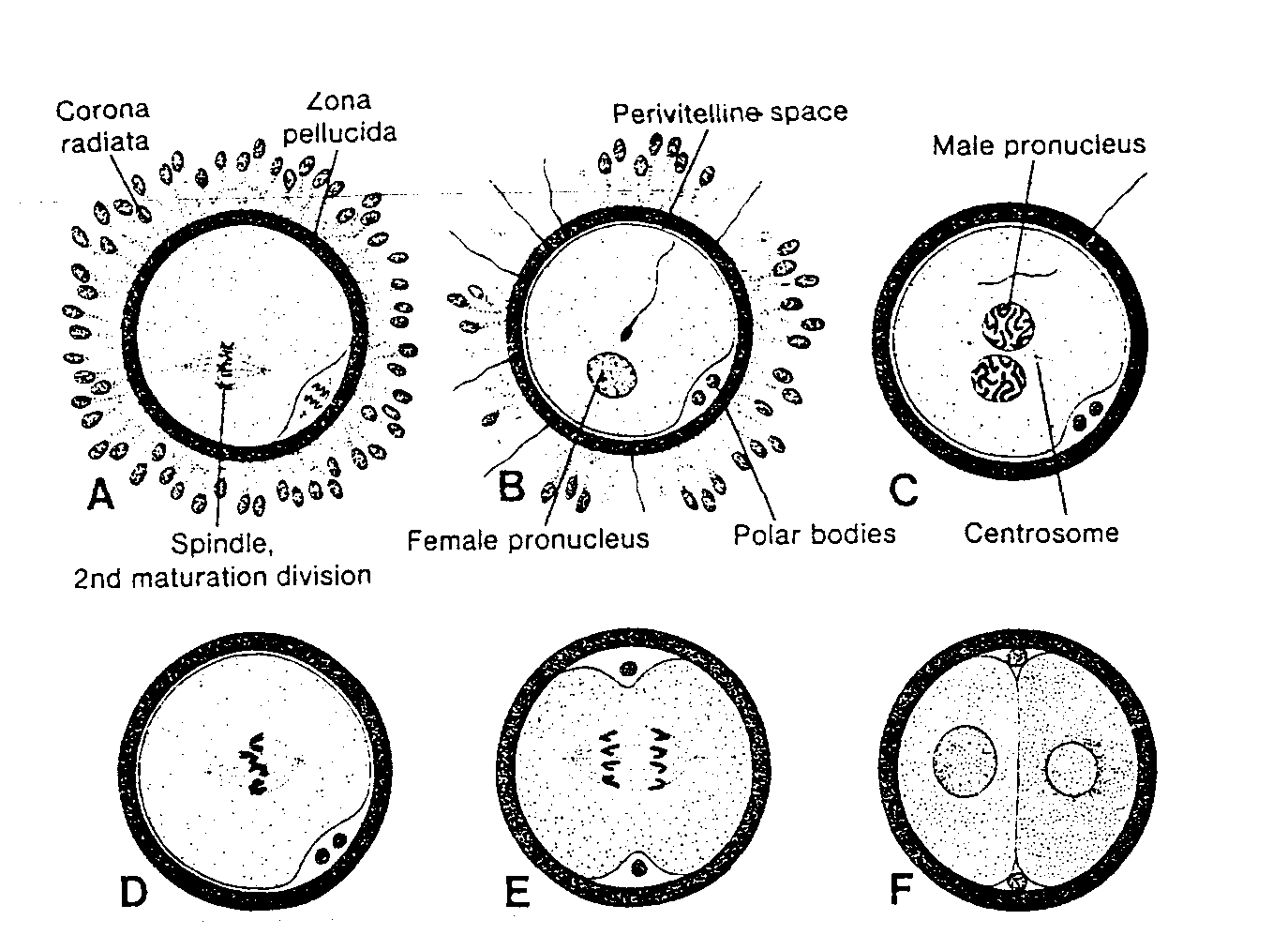
Ryć 2-6 A Owocyt bezpośrednio po owulacji. z widocznym wrzecionem drugiego podziału dojrzewania. 8, Plemnik wniknął do owocytu i nastąpiło zakończenie drugiego podziału dojrzewania. Chromosomy owocytu znajdują się w pęcherzykowawm jądrze, będącym żeńskim przedjądrzem. Główki kilku plemników ugrzęzły w osłonce przejrzystej. C. stadium męskiego i żeńskiego przedjądrza. D i E. Chromosomy związane i wrzecionem uległy podłużnemu rozszczepieniu i wędrują w kierunku biegunów. F, Stadium dwukomórkowe. Corona radiata- wieniec promienisty; Zona pellucida-osłonka przejrzysta; Spindle. 2nd maturation division - wrzeciono drugiego podziału dojrzewania; Periviteline space - przestrzeń okolożoltkowa; Female pronucleus — przedjądrze żeńskie; Polar bodies - ciałka kierunkowe. Małe pronucleus - przed|ądrze męsk.e; Centrosome — centrosom
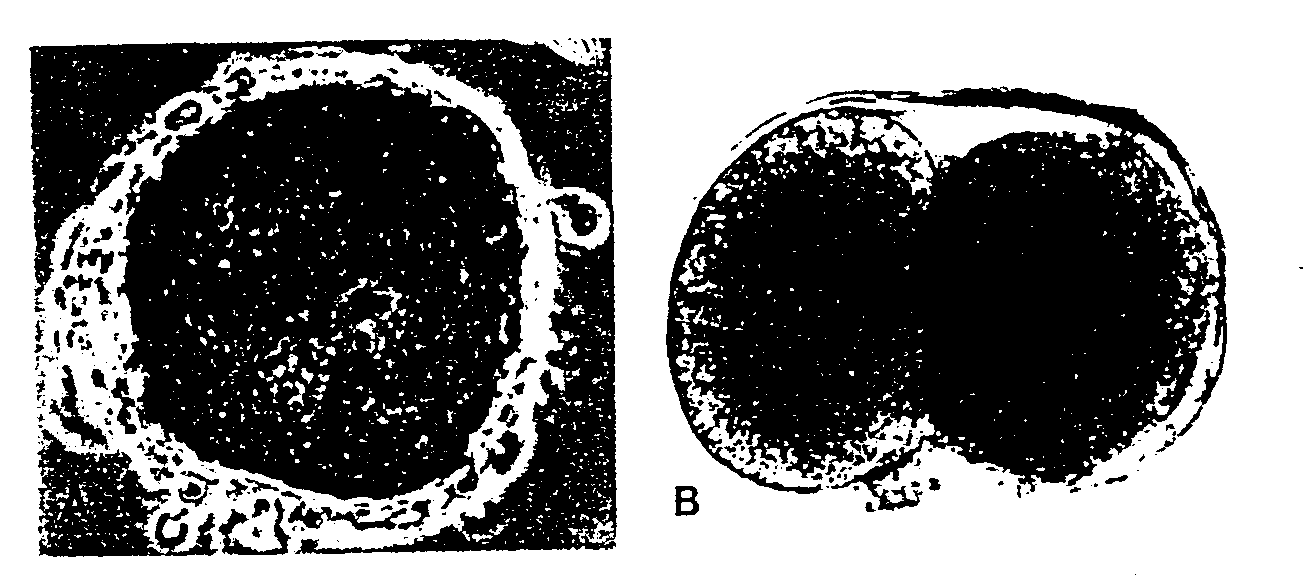
Ryć. 2-7. A, Zapłodniony ludzki, owocyt w stadium przedjądrzy. oglądany w mikroskopie fazowo-kontrastowym. Widoczne jest męskie i żeńskie przedjądrze (31). (Dzięki uprzejmość, Dr L. Dickmanna i Dr Noy«a z Uniwersytetu Vanderbilta). B, Ludzka zygota w stadium dwóch komórek. (Z pracy A.T. Hertiga 11. Kocka. ozi?k. uprzejmości Carnegie Institution ot Washington).
Najważniejszym skutkiem zapłodnienia jest (a) przywrócenie diploidalnej liczby chromosomów pochodzących w połowie od ojca i w połowie od matki. Dlatego też zygota zawiera nowa kombinację chromosomów, odmienną niż u obojga rodziców: (b) determinacja pici nowego osobnika. Plemnik zawierający chromosom X powoduje powstanie zarodka płci żeńskiej (XX). a plemnik z chromosomem Y — zarodka płci męskiej (XY). Jak z tego wynika, płeć chromosomowa zarodka zostaje zdeterminowana podczas zapłodnienia; (r) zapoczątkowanie bruzdkowania. Niezapłodniony owocyt zazwyczaj degeneruje się w 24 godziny po owulacji.
Zapłodnienie in vitro
W laboratoriach na całym świecie często dokonuje się zapłodnienia ludzkiego jaja in vitro. Wzrost pęcherzyków jajnikowych pobudza się podaniem gonadotropin. Owocyty pobiera się z pęcherzyków jajnikowych za pomocą aspiratora, tuż przed owulacja. gdy owocyt znajduje się w późnym okresie pierwszego podziału mejotycznego. Owocyty umieszcza się następnie w pożywce hodowlanej i natychmiast dodaje nasienie. Zapłodnione jaja obserwuje się do stadium 8 blastomerów, a następnie przenosi sieje do macicy, aby dalej tam się rozwijały. Stosując tę technikę doprowadzono już do urodzenia się wielu dzieci (32-34).
Metoda zapłodnienia in vitro stwarza możliwość przezwyciężenia skutków niepłodności spowodowanej licznymi przyczynami, takimi jak zarośnięcie jajowodu, szkodliwy dla plemników śluz szyjki macicy, uczulenie w stosunku do plemników itd. Inna potencjalna korzyść zapłodnienia in vitro, wymagająca jednak dalszych badań, stanowi możliwość określenia kariotypu zapłodnionego jaja i uniknięcia wszczepiania zarodków z wadami chromosomów somatycznych lub płciowych (34). Na szczęście zarodek w okresie przedimplantacyjnym jest wysoce odporny na działanie czynników teratogennych i dlatego ryzyko uzyskania potomstwa z wadami rozwojowymi przez procedurę zapłodnienia in vitro jest bardzo niewielkie.
Poważna wadę techniki zapłodnienia in vitro stanowi niski odsetek powodzenia, gdyż tylko 20% zapłodnionych jaj wszczepia się do macicy i rozwija aż do porodu. Dlatego też, aby zwiększyć szansę na uzyskanie sukcesu, gromadzi się 4 - 5 komórek jajowych, zapładnia je i wprowadza do macicy. Może to oczywiście doprowadzić do mnogiej ciąży, co niejednokrotnie już się zdarzało.
Bruzdkowanie
Zygota po osiągnięciu stadium dwóch komórek przechodzi serię podziałów mitotycznych prowadzących do szybkiego zwiększenia liczby komórek. Komórki te, zmniejszające się po każdym podziale bruzdkowania, zwane są blastomerami (ryć. 2-8). Po trzech lub czterech podziałach zygota upodabnia się z wyglądu do morwy i dlatego zwana jest morula. Zarodek osiąga stadium moruli około 3 dnia po zapłodnieniu, na krótko przed dojściem do macicy (ryć. 2-11). W tym okresie (stadium 12- 16 komórek) morula składa się z komórek wewnętrznych położonych w środku i z zewnętrznych — na obwodzie. Z wewnętrznych
Ryć. 2-8. Schematycznie przedstawiony rozwój zygoty od stadium dwóch komórek do późnej moruli. Stadium dwóch komórek występuje około 30 godzin po zapłodnieniu: stadium 4 komórek około 40 godzin; stadium 12-16 komórek po około 3 dniach i stadium późnej moruli po około 4 dniach. W tym czasie elastomery są otoczone osłonką przejrzysta, znikającą pod koniec 4 dnia. Two-cell stage — stadium dwóch komórek: Four-cell stage — stadium czterech komórek
komórek powstają tkanki zarodka, natomiast komórki zewnętrzne tworzą trofoblast, wchodzący w przyszłości w skład łożyska.
Powstawanie blastocysty
W czasie gdy morula przesuwa się do jamy macicy, przez jej osłonkę przejrzystą przenika płyn gromadzący się pomiędzy leżącymi w jej wnętrzu komórkami. Stopniowo wypełnione płynem przestrzenie zlewają się tworząc ostatecznie pojedynczą jamę zwaną jamą blastuli (blastocele) (ryć. 2-9 B i 2-10 A). W tym okresie zarodek nosi nazwę blastocysty. Grupa komórek pozostających wewnątrz blastocysty, zwana teraz embrioblastem (lub często w polskich podręcznikach węzłem zarodkowym. przyp. tłum.), znajduje się na jednym biegunie, natomiast komórki zewnętrzne, czyli obecnie komórki trofoblastu, spłaszczają się i tworzą nabłonkową, ścianę blastocysty (ryć. 2-10 B). Zanik osłonki przejrzystej umożliwia rozpoczęcie implantacji.
Komórki ludzkiego trofoblastu znajdujące się na biegunie ponad embrioblastem zaczynają wnikać pomiędzy komórki nabłonkowe błony śluzowej macicy około 6 dnia ciąży (ryć. 2-10 B). Wnikanie trofoblastu i następnie niszczenie komórek nabłonkowych błony śluzowej zachodzi prawdopodobnie dzięki wytwarzanym przez trofoblast enzymom proteolitycznym (37). Błona śluzowa macicy wspomaga, jednak proteolityczną czynność blastocysty, tak że implantacja zachodzi w wyniku ich współdziałania. Zatem do końca l tygodnia rozwoju ludzka zygota przechodzi przez stadium moruli i blastocysty i zaczyna implantować się w błonie śluzowej macicy (ryć. 2-10).
Nieprawidłowe zygoty
Często opisywano nieprawidłowe zygoty ludzkie i innych ssaków. Spośród 8 zygot w okresie przedimplantacyjnym, uzyskanych z jajowodów przez Hertiga
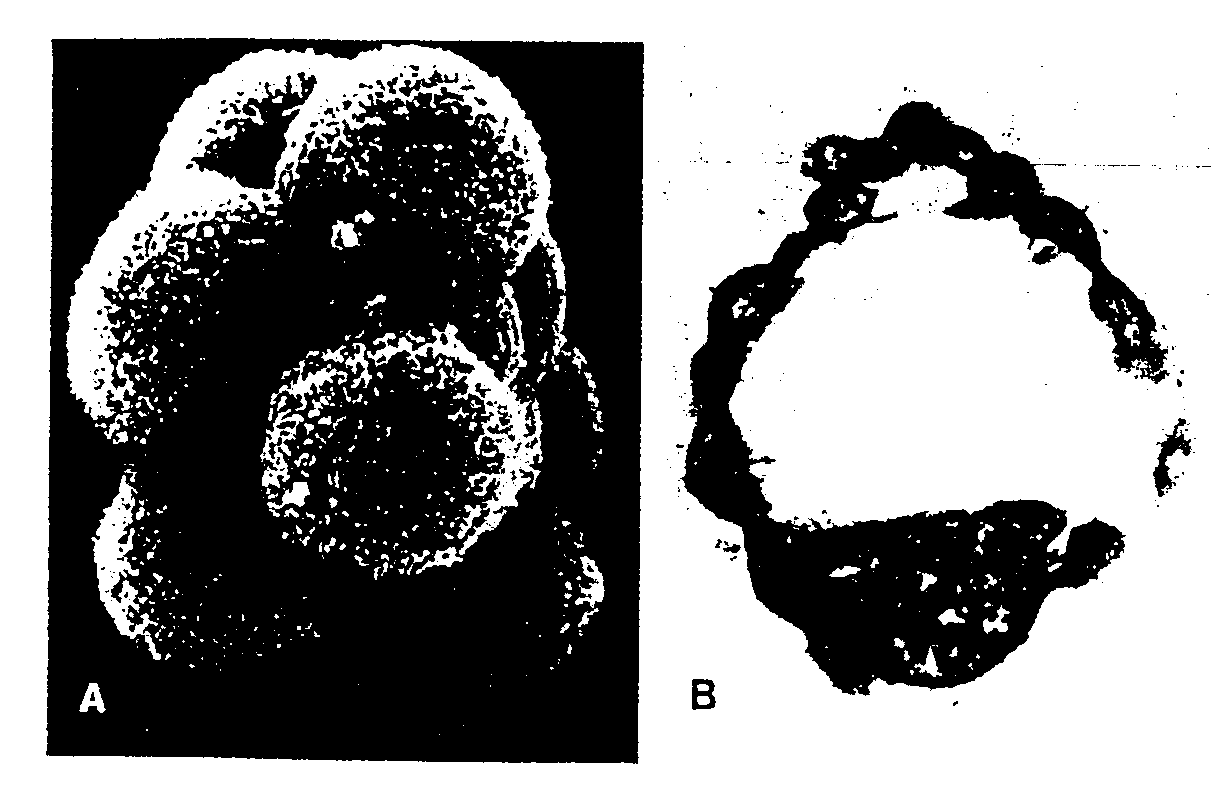
Ryć. 2-9. A, Elektronogram z mikroskopu skenującego moruli myszy po usunięciu osłonki przejrzystej. Wyraźnie widać zarysy wszystkich blastomerów i liczne mikrokosmki na ich powierzchni. (Z pracy J. Van Blerkoma i P. Motty: The Cellular Bafis oiMammalian Reproduction. Baltimore, Urban & Schwarzenberg, 1979). B, Skrawek 107 komórkowej ludzkiej blastocysty. Widać węzeł zarodkowy i komórki trofoblastu. (Z pracy A.T. Hertiga,). Rocka i E.C Adamsa: A description ot' 34 human ova within the first 17 days ot development. Am. /. Ann. 98:435, 1956. Dzięki uprzejmości Carnegie Institution ot Washington).
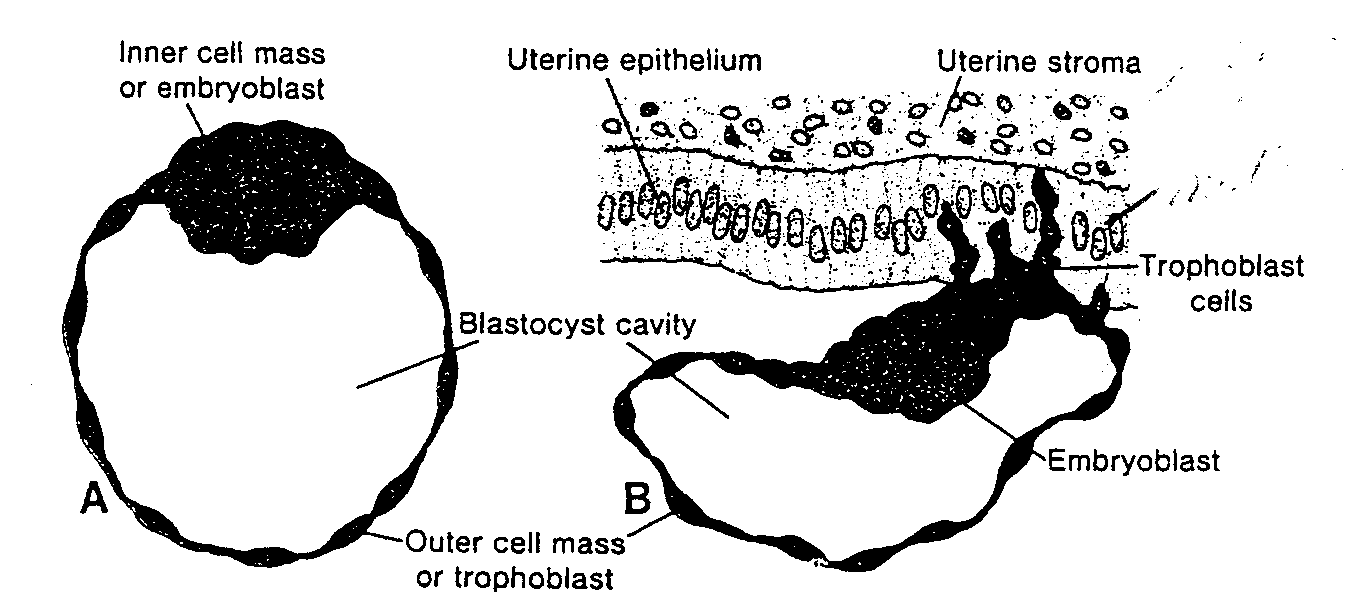
Ryć. 2-10. A, Schematycznie przedstawiony przekrój ludzkiej blastocysty znalezionej w jamie macicy około 4 i 1/2 dnia po zapłodnieniu. Niebieskie komórki przedstawiają węzeł zarodkowy, czyli embrioblast, a komórki brązowe trofoblast. (Zmodyfikowana rycina A.T. Hertiga i j. Rocka). B, Schematyczny rysunek przekroju przez blastocystę makaka w 9 dniu rozwoju. Komórki trofoblastu znajdujące się na zarodkowym biegunie blastocysty zaczynają wnikać do błony Śluzowej macicy (36). Ludzka blastocysta prawdopodobnie zaczyna wnikać do błony śluzowej macicy 5 lub 6 dnia rozwoju.
Inner celi mass or embryoblast — węzeł zarodkowy lub embrioblast: Blastocyst cavity — jama blastocysty: Outer celi mas or trophoblast"— zewnętrzne komórki lub trofoblast; Uterine epithelium — nabłonek macicy; Uterine stroma — zrąb macicy; Trophoblast cells — komórki trofoblastu; Embryoblast — embrioblast
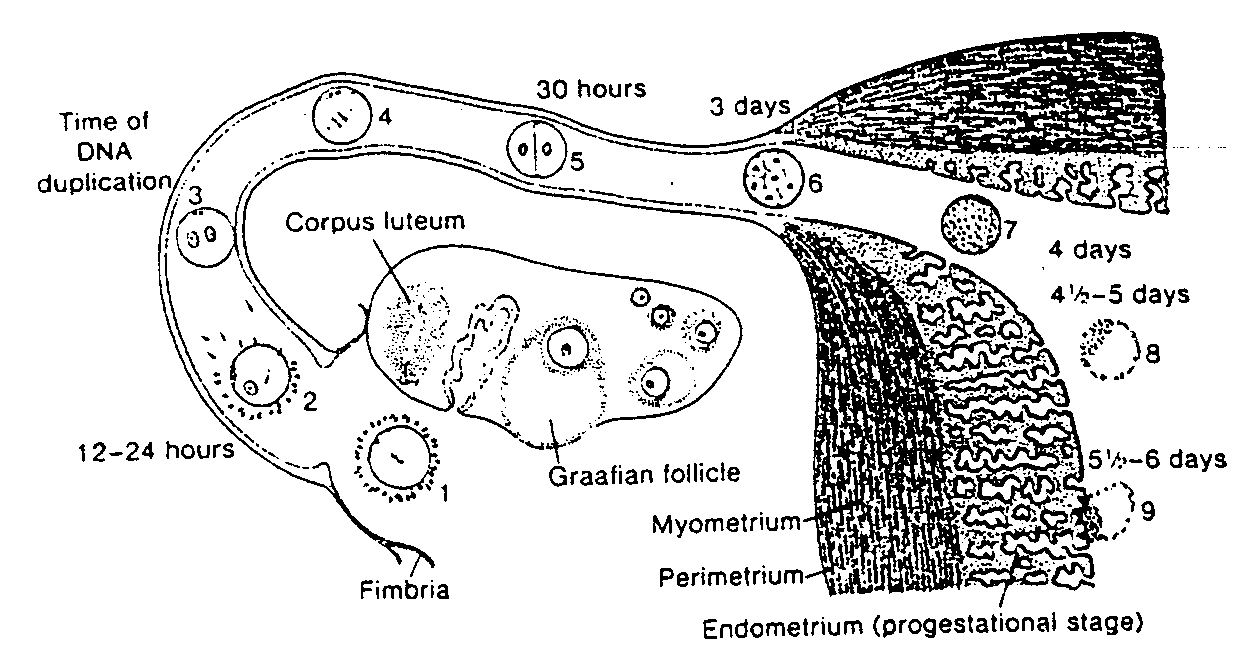
Ryć. 2-11. Schematycznie przedstawione zjawiska zachodzące w czasie 1 tygodnia rozwoju człowieka. 1. Owocyt bezpośrednio po owulacji. 2, Zapłodnienie około 12 do 24 godzin po owulacji. 3. Stadium męskiego i żeńskiego przedjądrza. 4. Wrzeciono pierwszego podziału mitotycznego. 5. Stadium dwukomórkowe (około 30 godzin po zapłodnieniu). 6, Morula zawierająca 12 do 16 blastomerów (około 3 dni po zapłodnieniu). 7, Późna morula przed dojściem do jamy macicy (około 4 dni po zapłodnieniu L 8, Wczesna blastocysta (około 4 i ' • 2 dnia po zapłodnieniu). 9. Wczesna faza implantacji (blastocysta około 6 dni po zapłodnieniu). W jajniku widać stadia przejściowe pomiędzy pierwotnym i dojrzałym pęcherzykiem jajnikowym oraz ciałko żółte. Błona śluzowa macicy przedstawiona jest w fazie wydzielniczej (progesteronowej).
Time of DNA replication — okres replikacji DNA; 12 - 24 hours — 12 - 24 godziny; Fimbria — strzępki; Corpus luteum — ciałko żółte; Graafian follicle — dojrzały pęcherzyk Graafa; 30 Hours — 30 godzin; 3 days — 3 dni; 4 days — 4 dni; 4 i V2-5 days — 4 i 1/2-5dni;5 i ½ -6 days — 5 ½ - 6 dni; Myometrium — błona mięśniowa macicy: Perimetrium — błona surowicza; Endometrium (progestational stage) — błona śluzowa macicy (faza wydzielnicza lub progesteronowa)
i współpracowników, cztery wyglądały prawidłowo, natomiast pozostałe były nieprawidłowe (28). Nieprawidłowe zygoty, w 3-5 dni po zapłodnieniu zawierały wielojądrowe blastomery i wykazywały różny stopień zwyrodnienia komórek. Chociaż wątpliwe jest, aby którakolwiek z tych zygot była zdolna do implantacji, wszystkie uzyskano od pacjentek wykazujących normalną płodność.
Dokładna liczba nieprawidłowych zygot nie jest znana, gdyż rozwijające się z nich zarodki przeważnie giną we wczesnym okresie ciąży (w 2-3 tygodnie po zapłodnieniu), zanim kobieta uświadomi sobie, że jest w ciąży, i dlatego pozostają nie wykryte. Ocenia się, że aż 50% wszystkich ciąż kończy się spontanicznym poronieniem i że połowa tych poronień jest spowodowana wadami chromosomowymi (39). Poronienia te stanowią jak gdyby naturalny sposób odsiewu uszkodzonych zarodków i w ten sposób zmniejszają częstość występowania wad wrodzonych. Bez tego zjawiska około 12% wszystkich noworodków, zamiast 2-3%, miałoby wady wrodzone (39).
Macica w czasie implantacji
Ściana macicy składa się z trzech warstw: (a) błony śluzowej (endometrium) wyścielającej jamę macicy, (b) błony mięśniowej (inyometrium) stanowiącej grubą
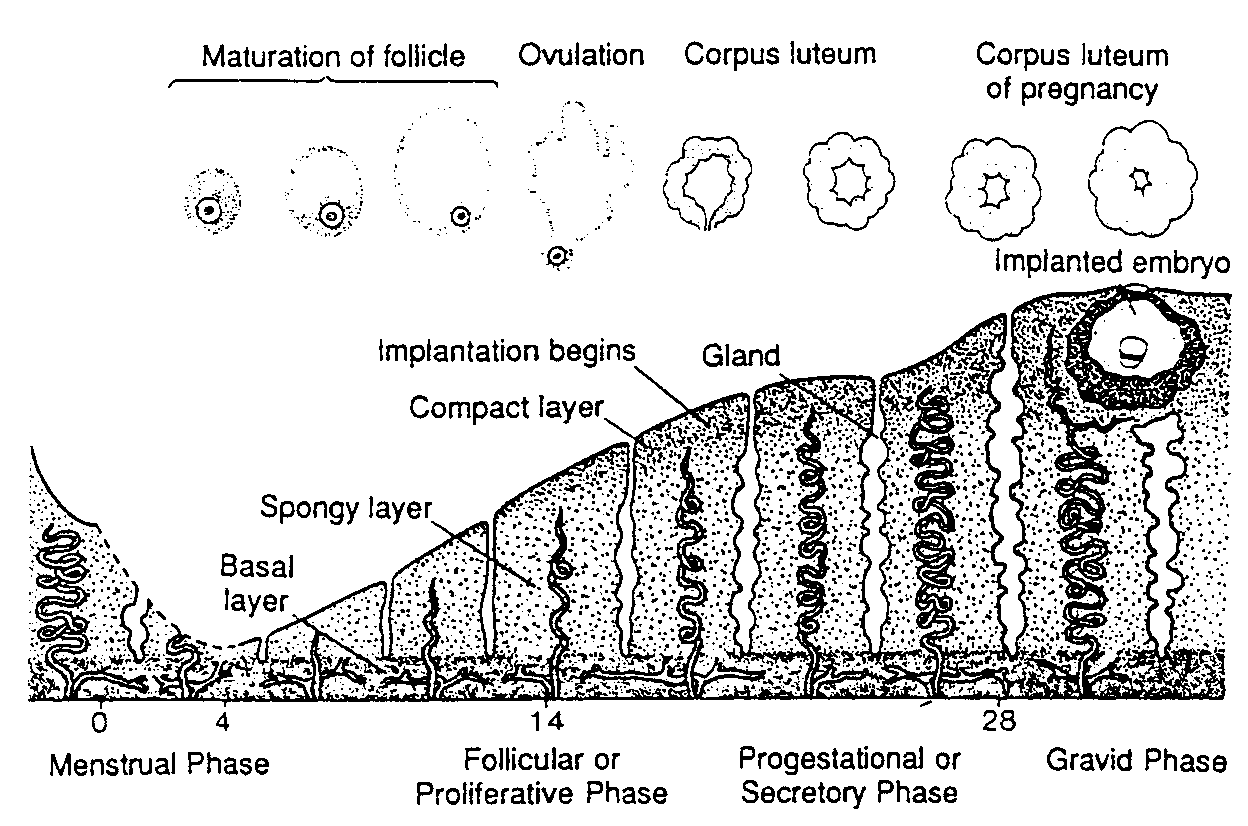
Ryć. 2-12. Schematycznie przedstawione zestawienie zmian zachodzących w błonie śluzowej macicy i w jajniku. Implantacja blastocysty spowodowała rozwój dużego ciałka żółtego ciążowego. Aktywność wydzielnicza błony śluzowej stopniowo wzrasta pod wpływem dużej ilości progesteronu wytwarzanego przez to ciałko.
Maturation of follicle — dojrzewanie pęcherzyka; Ovulation — owulacja: Corpus luteum — ciałko żółte; Corpus luteum of pregnancy — ciałko żółte cisowe; Implanted embryo — wszczepiony zarodek; Gland — gruczoł; Implantation begins — początek implantacji: Compact layer — warstwa zbita; Spongy laver — warstwa gąbczasta; Basal Inyer — warstwa podstawna; Menstrual phase — faza złuszczania (miesiączkowa); Follicular or proliferame phase — faza folikularna albo faza wzrostu: Progestational or secretory phase — faza progesteronowa albo faza wydzielnicza: Gravid phase — okres ciąży
warstwę komórek mięśniowych gładkich i (c) błony surowiczej (perimetrium), czyli otrzewnej pokrywającej macicę od zewnątrz (ryć. 2-11). Od okresu pokwitania (11-13 rok życia) aż do menopauzy (45-50 rok życia) błona śluzowa macicy podlega cyklicznym zmianom w cyklu trwającym w przybliżeniu 28 dni i kontrolowanym przez hormony jajnika. W czasie takiego cyklu, zwanego cyklem miesiączkowym, błona śluzowa macicy przechodzi przez trzy fazy, to znaczy fazę folikularna. czyli fazę wzrostu, fazę wydzielnicza, czyli fazę progesteronową i fazę złuszczania. czyli fazę miesiączkową (ryć. 2-11; 2-12 i 2-13). Faza wzrostu rozpoczyna się po zakończeniu fazy złuszczania, znajduje się pod wpływem hormonów estrogennych i przebiega równoległy ze wzrostem pęcherzyków jajnikowych. Faza wydzielnicza zaczyna się w 2 - 3 dni po owulacji w odpowiedzi na progesteron wytwarzany przez ciałko żółte. Jeśli nie dojdzie do zapłodnienia, to następuje złuszczanie błony śluzowej (warstwy zbitej i warstwy gąbczastej), wskazujące na rozpoczęcie się fazy miesiączkowej. W przypadku zapłodnienia błona śluzowa uczestniczy w implantacji i wchodzi w skład łożyska.
W czasie implantacji błona śluzowa znajduje się w fazie wydzielniczej (ryć. 2-11 i 2-12), podczas której gruczoły maciczne i tętnice ulegają spiralizacji, a błona ulega rozpulchnieniu. W rezultacie w błonie śluzowej można wyróżnić trzy odrębne warstwy: powierzchniową warstwę zbitą, środkową warstwę gąbczastą i cienką warstwę podstawna (ryć. 2-12). W normalnych warunkach ludzka blastocysta
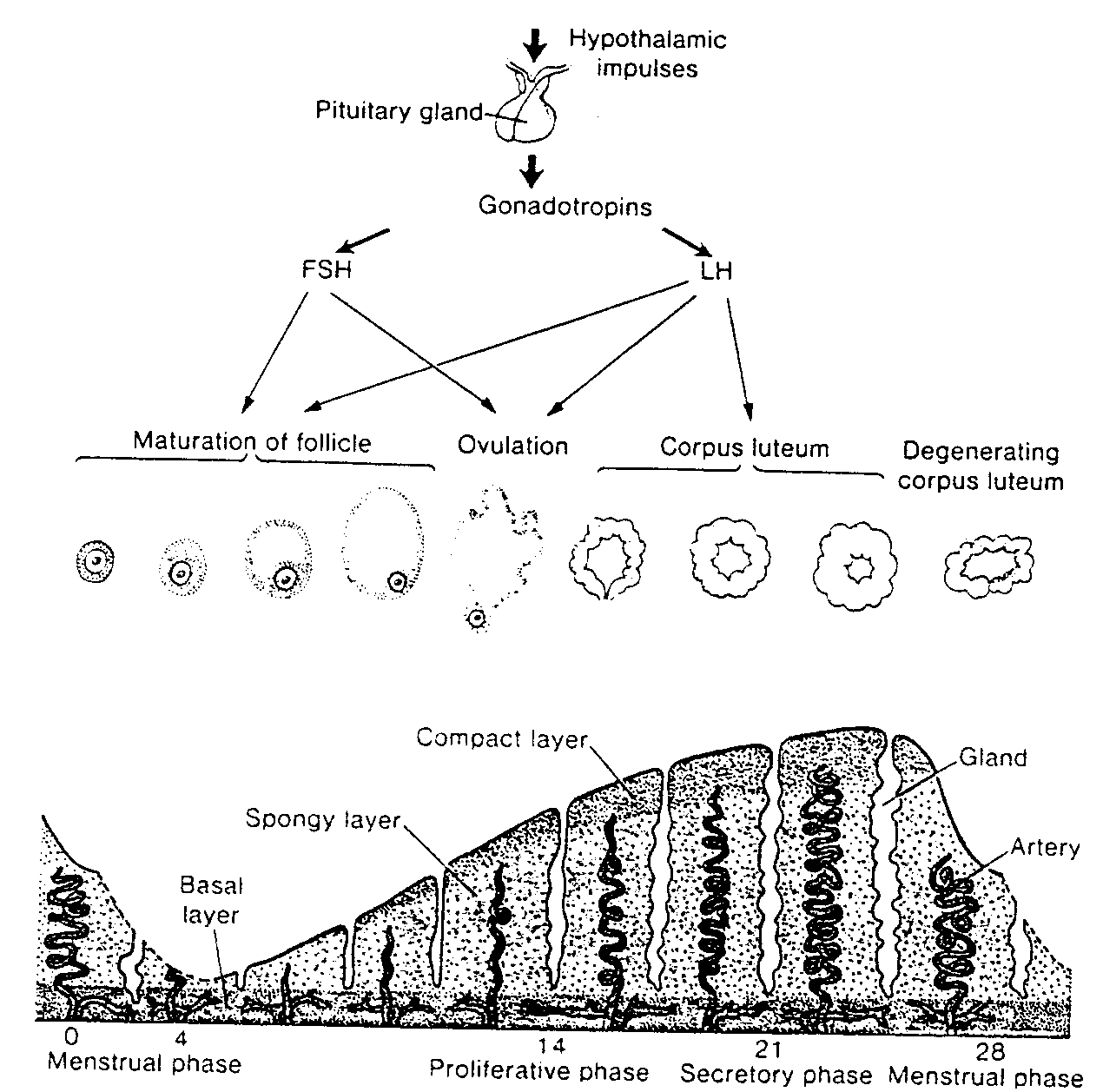
Ryć. 2-13. Schematyczny rysunek przedstawiający zmiany zachodzące w błonie śluzowej macicy (endometrium) w czasie regularnego cyklu miesiączkowego, w którym nie doszło do zapłodnienia. Należy zwrócić uwagę na równolegle przebiegające zmiany w jajniku.
Hypothalamic impułses — bodźce z podwzgórza; Pituitary gland — przysadka: Gonadotropins — gonado-tropiny; FSH — rolitropina; LH — lutropina; Maturation ot follicle — dojrzewanie pęcherzyka: Ovulation
— owulacja; Corpus luteum — ciałko żółte: Dctjcnerating corpus luteum — degenerujące się ciałko żółte; Basał layer — warstwa podstawna; Spongy layer — warstwa gąbczasta: Compact Layer — warstwa zbita; Gland
— gruczoł: Artery — tętnica: Menstrual phase — Faza miesiączkowa; Prolifcrativc phase — faza wzrostu: Secretory phase — faza wydzielnicza
wszczepia się do błony śluzowej w obrębie tylnej lub przedniej ściany trzonu macicy pogrążając się w niej pomiędzy ujściami gruczołów (ryć. 2-12).
Jeśli owocyt nie zostanie zapłodniony, to żyłki i sinusoidy w błonie śluzowej stopniowo ,wypełnią się krwinkami, które następnie zaczną przechodzić do otaczających tkanek. W fazie złuszczania, z powierzchownych tętnic wydobywa się krew i następuje odrywanie się małych fragmentów zrębu błony oraz gruczołów. Podczas następnych 3 lub 4 dni warstwa zbita i warstwa gąbczasta złuszczają się i zostają wydalone z macicy, a pozostaje jedynie warstwa podstawna błony śluzowej (ryć. 2-13). Warstwa ta zawiera własne tętnice, zwane tętnicami podstawnymi albo tętnicami prostymi i ma charakter warstwy regeneracyjnej, z której w czasie fazy wzrostu odtwarzają się gruczoły i tętnice (ryć. 2-13).
STRESZCZENIE
Mimo że w każdym cyklu jajnikowym zaczyna wzrastać kilkanaście pęcherzyków, tylko jeden z nich osiąga pełną dojrzałość i tylko jeden owocyt wydostaje się z jajnika podczas owulacji. W momencie owulacji owocyt znajduje się w drugim podziale mejotycznym i jest otoczony przez osłonkę przejrzystą i pewną liczbę komórek ziarnistych (ryć. 2-4). Wskutek zagarniających ruchów strzępków jajowodu owocyt dostaje się do jajowodu.
Plemniki, zanim staną się zdolne do zapłodnienia, muszą przejść (a) proces kapacytacji, podczas którego z główki plemników zostaje usunięta glikoproteinowa powłoczka i białka płynu nasiennego i (b) reakcję akrosomową, w czasie której zachodzi uwalnianie hialuronidazy i trypsynopodobnych enzymów umożliwiających plemnikom sforsowanie barier wokół owocytu. W czasie zapłodnienia plemnik musi przeniknąć przez (a) wieniec promienisty, (b) osłonkę przejrzystą i (c) błonę komórkową owocytu (ryć. 2-5). Natychmiast po wniknięciu plemnika do j owocytu (a) ten ostatni kończy drugi podział dojrzewania i wytwarza przedjądrze żeńskie; (b) osłonka przejrzysta staje się nieprzepuszczalna dla innych plemników; i (c) główka plemnika oddziela się od witki, pęcznieje i tworzy przedjądrze męskie (ryć. 2-6). Po replikacji DNA w obu przedjądrzach, ojcowskie i matczyne chromosomy mieszają się ze sobą, rozdzielają się wzdłuż i zachodzi podział mitotyczny prowadzący do utworzenia dwukomórkowego zarodka. Wynikiem zapłodnienia jest (a) przywrócenie diploidalnej liczby chromosomów; (b) zdeterminowanie płci chromosowej; i (c) zapoczątkowanie bruzdkowania.
Bruzdkowanie jest to seria podziałów mitotycznych, prowadząca do zwiększenia liczby komórek — blastomerów, i ich zmniejszania się po każdym podziale. Po 3-4 dniach zygota przybiera postać morwy (morula) i przedostaje się do jamy macicy. Następnie morula traci osłonkę przejrzystą i zaczyna formować się jama blastocysty. Komórki układają się w (a) zewnętrzną warstwę komórek, która utworzy trofoblast i (b) w wewnętrzną masę komórek (węzeł zarodkowy), z której powstanie zarodek. Zarodek w tym stadium rozwoju nazywa się blastocystą.
Rozdział 3
DWUBLASZKOWA TARCZKA ZARODKOWA
(DRUGI TYDZIEŃ ROZWOJU)
W poniższych podrozdziałach podano opis głównych zjawisk zachodzących dzień po dniu podczas 2 tygodnia rozwoju. Należy jednak zdawać sobie sprawę, że zarodki w tym samym wieku niekoniecznie rozwijają się z ta sama szybkością. Zaobserwowano znaczne różnice w tempie wzrostu zarodka, nawet we wczesnych stadiach rozwoju (1. 2).
Ósmy dzień rozwoju
W ósmym dniu rozwoju blastocysta jest już częściowo zagłębiona w błonie śluzowej macicy (3). Ponad embrioblastem, w trofoblaście powstały już dwie warstwy: (a) wewnętrzna warstwa jednojądrowych komórek, zwana cytotrofoblastem, i (b) zewnętrzna, wielojądrowa warstwa pozbawiona wyraźnych granic międzykomórkowych, zwana syncycjotrofoblastem, czyli syncycjum (zespólnią) (ryć. 3-1 i 3-2). Figury mitotycz ne spotyka się w cytotrofoblaście, natomiast nie ma ich w syncycjum, mimo że grubość utworzonej przez nie warstwy stopniowo znacznie wzrasta. Sugeruje to, że komórki trofoblastu mnożą się w obrębie cytotrofoblastu, migrują do syncycjotrofoblastu i łączą się z nim na drodze fuzji wchodząc w obręb syncycjum.
Komórki węzła zarodkowego, czyli embrioblastu, także wytwarzają dwie warstwy: (a) warstwę małych, sześciennych komórek sąsiadujących z jamą blastocysty, zwaną warstwą hipoblastyczną lub hipoblastem*; i (b) warstwę wysokich komórek walcowatych sąsiadujących z jamą owodni, zwaną warstwą epiblastyczną lub epiblastem* (ryć. 3-1 i 3-2). Komórki każdej z tych warstw układają się w płaskie krążki, a cała struktura nazywa się dwublaszkową tarczą zarodkową.
W tym samym czasie w obrębie epiblastu pojawia się mała jamka. Jamka ta powiększa się stale, stając się jamą owodniową (cavum umnioticum). Komórki epiblastu przylegające do cytotrofoblastu zwane są amnioblastami i wraz z resztą epiblastu wyścielają jamę owodniową (ryć. 3-1 i 3-3) (4).
Błona śluzowa macicy w okolicy miejsca implantacji jest obrzęknięta i silnie unaczyniona, a gruczoły maciczne, powiększone i skręcone, wydzielają dużo glikogenu i śluzu.
* Hipoblast zwany jest także endodermą pierwotna, a epiblast ektodermą pierwotną (przyp. tłum.).
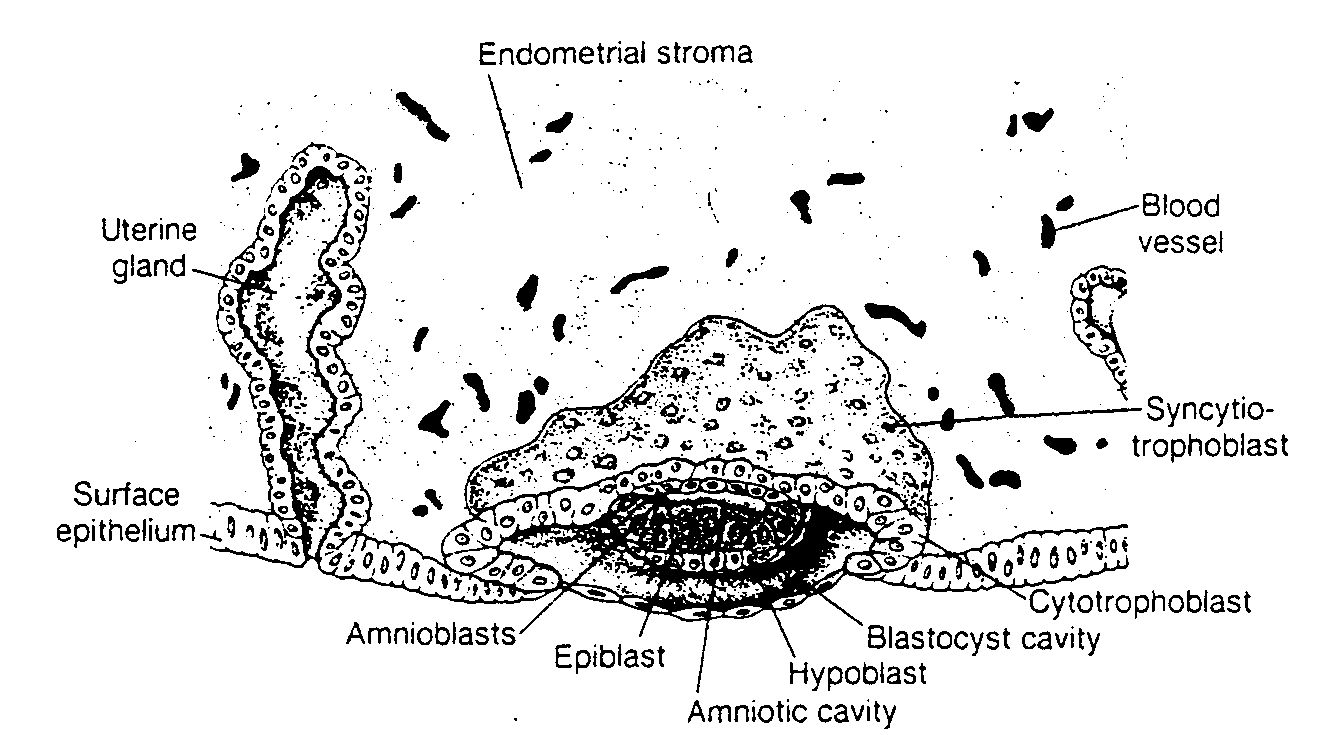
Ryć. 3-1. Rysunek przedstawia 7 i ½ -dniową ludzką blastocystę, częściowo zagłębioną w błonie śluzowej macicy. Trofoblast składa się z wewnętrznej warstwy komórek jednojadrowych, zwanej cytotrofoblastem i z warstwy zewnętrznej bez wyraźnych granic międzykomórkowych, zwanej syncycjotrofoblastem. Embrioblast jest utworzony przez warstwę epiblastu i warstwę hipoblastu. Jama owodniową ma postać niewielkiej szczeliny.
Uterine gland — gruczoł maciczny; Surface epithelium — nabłonek powierzchniowy; Amnioblasts — amniob-lasty; Epiblast — epiblast; Amniotic cavity — jama owodniową; Hypoblast — hipoblast; Blastocyst cavity — jama blastocysty; Cytotrophoblast — cytotrofoblast; Syncytiotrophoblast — syncycjotrofoblast: Blood vessel — naczynie krwionośne; Endometrial stroma — zrąb błony śluzowej macicy
Dziewiąty dzień rozwoju
Blastocysta głębiej wniknęła w błonę śluzową macicy, a ubytek powstały w nabłonku powierzchniowym w miejscu jej penetracji został zasklepiony przez
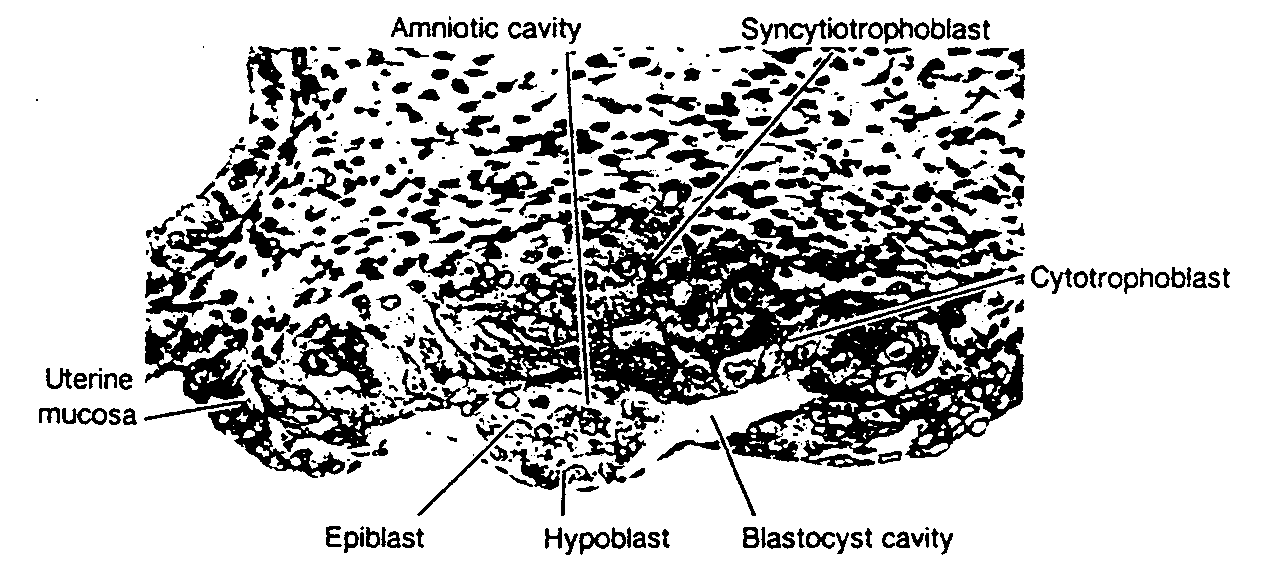
Ryć. 3-2. Przekrój przez 7 i ½ -dniową ludzką blastocystę (pow. 100x). Należy zwrocić uwagę na występowanie w syncycjotrofoblaście licznych jąder, na wielkość komórek cytotrofoblastu i na szczelinowatą jamę owodniową. (Z pracy A. T. Hgrtiga i J. Rocka: Two human ova of the previllous stage, having an ovulation agę ot e!even and twelve days respęctively. Contrib. Emfaryo/. 29:127,1941. Dzięki uprzejmości Carnegie Institution of Washington).
Uterine mucosa — błona śluzowa macicy; Epiblast — epiblast; Hypoblast — hipoblast; Blastocyst cavity — jama blastocysty; Cytotrophoblast — cytotrofoblast; Syncytiotrophoblast — syncycjotrofoblast; Amniotic cavity — jama owodniowa
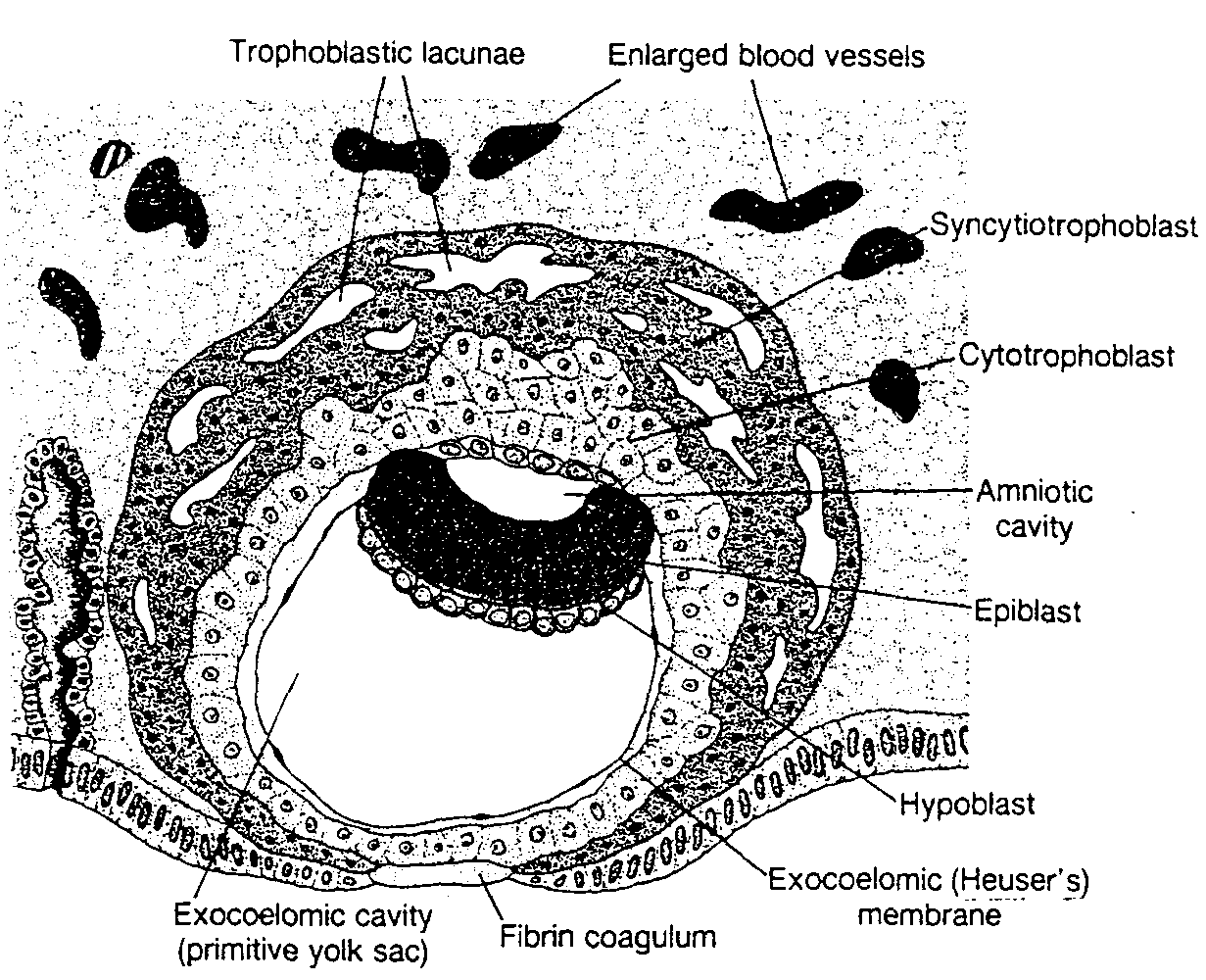
Ryć. 3-3. Rysunek 6 - dniowej ludzkiej blastocysty. Syncycjotrofoblast zawiera wiele lakun (zatok). Widać płaskie komórki tworzące błonę zewnątrzzarodkowej jamy ciała (exocoeloma). Dwublaszkowa tarcza zarodkowa składa się z warstwy walcowatych komórek epiblastu i z warstwy sześciennych komórek hipoblastu. Ubytek w nabłonku powierzchniowym macicy wypełnia skrzep.
Trophoblastic lacunae — lakuny trofoblastu; Exocoelomic cavity (primitive yolk sac) — zewnątrzzarodkowa jama ciała (pęcherzyk żółtkowy pierwotny); Fibrin coagulum — skrzep; Exocoelomic (Heuser's) membrane — błona zewnątrzzarodkowej jamy ciała (błona Heusera); Hypoblast — hipoblast; Epiblast — epiblast; Amniotic cavity — jama owodniowa; Cytotrophoblast — cytotrofoblast; Syncytiotrophoblast — syncycjotrofoblast; Enlarged blod vessels — powiększone naczynia krwionośne
skrzep (ryć. 3-3) (3). Trofoblast znacznie się rozwinął, zwłaszcza na biegunie zarodkowym, i w tym miejscu w syncycjum pojawiły się wakuole. Wakuole te łączą się ze sobą tworząc duże lakuny i dlatego ten okres rozwoju trofoblastu zwany jest stadium lakunowym (ryć. 3-3).
W tym samym czasie na biegunie przeciwzarodkowym spłaszczone komórki, wywodzące się prawdopodobnie z hipoblastu tworzą cienka błonę, zwaną błoną zewnątrzzarodkowej jamy ciała lub błoną Heusera, wyścielającą wewnętrzną powierzchnię cytotrofoblastu (ryć. 3-3). Błona ta, wraz z hipoblastem, wyściela zewnątrzzarodkową jamę ciała (exocoeloma), czyli pęcherzyk żółtkowy pierwotny (saccus vitellinus primitivus).
Jedenasty-dwunasty dzień rozwoju
W 11-12 dniu rozwoju blastocysta jest już całkowicie zagłębiona w błonie śluzowej macicy, a powierzchniowy nabłonek prawie zupełnie pokrywa ubytek powstały w czasie implantacji (ryć. 3-4 i 3-5). Blastocysta tworzy niewielkie uwypuklenie zwrócone do światła macicy.
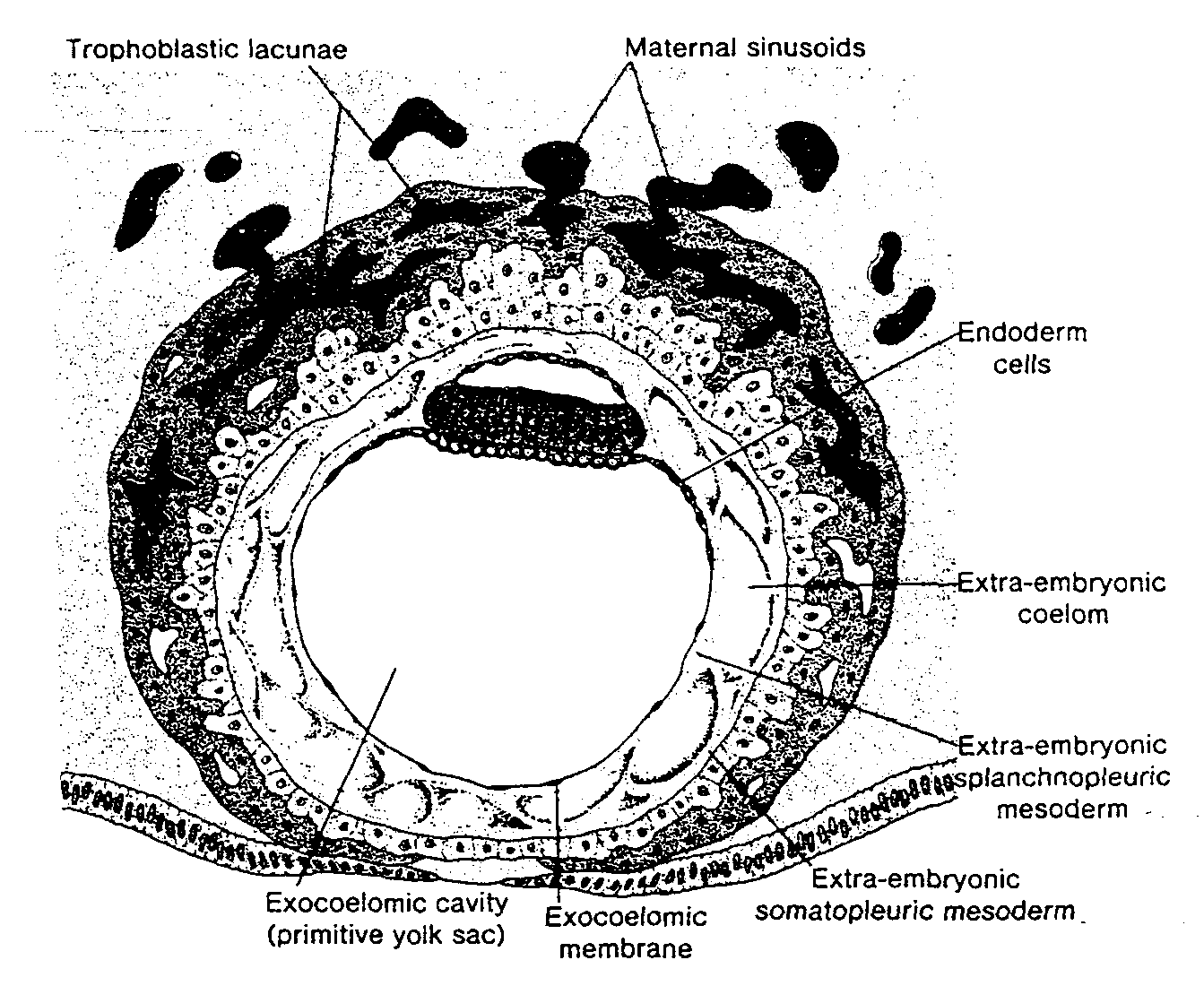
Ryć. 3-4. Rysunek 12-dniowej ludzkiej blastocysty. Lakuny trofoblastu na biegunie zarodkowym bezpośrednio łączą się z zatokowymi naczyniami włosowatymi (sinusoidami) matki w zrębie błony śluzowej macicy. Komórki mezodermy zewnątrzzarodkowej rozrastają się i wypełniają przestrzeń pomiędzy błoną zewnątrzzarodkowej jamy ciała i wewnętrzną powierzchnią trofoblastu.
Trophoblastic lacunae — lakuny trofoblastyczne; Exocoelomic cavity (primitiye yolk sac) — zewnątrzzarodkowa jama ciała (pierwotny pęcherzyk żółtkowy); Exocoelomic membrane — błona zewnątrzzarodkowej jamy ciała; Extra-embryonic somatopleuric mesoderm — pozazarodkowa mezoderma ścienna; Extra-embryonic splanchnopłeuric mesoderm — pozazarodkowa mezoderma trzewna; Extra-embryonic coelom — pozazarodkowa jama ciała; Endoderm cells — komórki endodermy; Maternal sinousoids — sinusoidy (naczynia zatokowe) matki
W syncycjum trofoblastu występują charakterystyczne lakuny, łączące się ze sobą (5). Jest to szczególnie widoczne na biegunie zarodkowym; na biegunie przeciwzarodkowym trofoblast ciągle jeszcze składa się głównie z komórek cytotrofoblastu (ryć. 3-4 i 3-5).
Jednocześnie z rozwojem lakun syncycjotrofoblast wrasta głębiej w błonę śluzową i niszczy śródbłonek naczyń włosowatych matki. Naczynia te, zwane naczyniami zatokowymi (sinusoidami), są rozszerzone i wypełnione krwią (6). Lakuny trofoblastu .łączą się z naczyniami zatokowymi i wpływa do nich krew matki (ryć. 3-4). W miarę jak trofoblast uszkadza coraz więcej naczyń zatokowych, krew matki zaczyna przepływać przez układ lakun, ustanawiając w ten sposób krażenie maciczno - łożyskowe.
W tym samym czasie pomiędzy wewnętrzną powierzchnią cytotrofoblastu i zewnętrzną powierzchnią zewnątrzzarodkowej jamy ciała pojawia się nowy rodzaj komórek. Wywodzą się one z komórek pęcherzyka żółtkowego i tworzą delikatną, luźną tkankę łączną, nazywaną mezodermą pozazarodkową. Mezoderma ta ostate-

Ryć. 3-5. Przekrój przez 12-dniową ludzką blastocystę, po ukończeniu implantacji (pow. x 100). Należy zwrócić uwagę na krwinki matki w lakunach, błonę zewnątrzzarodkowej jamy ciała wyścielającą pierwotny pęcherzyk żółtkowy oraz na epiblast i hipoblast. (Z pracy A. T. Hertiga i J. Rocka: Two human ova of the previllous stage, having an ovuiation agę of eleven and twelve days respectively. Contrib. Emfaryol. 29:127, 1941. Dzięki uprzejmości Carnegie Institution of Washington).
Uterine endometrium — błona śluzowa macicy: Epiblast — epiblast: Hypoblast — hipoblast: Exocoelomic cavity — zewnątrzzarodkowa jama ciała: Extra-embryonic coelom — pozazarodkowa jama ciała; Exocoelomic membranę — błona zewnątrzzarodkowej jamy ciała: Trophoblast lacunae filted with blood cells — lakuny trotoblastu wypełnione krwinkami
cznie wypełni całą przestrzeń pomiędzy trofoblastem od zewnątrz i owodnią oraz ściana, zewnątrzzarodkowej jamy ciała od wewnątrz (ryć. 3-4 i 3-5).
Wkrótce potem w mezodermie pozazarodkowej tworzą się duże rozstępy, które łączą się i wytwarzają nowa jamę zwaną pozazarodkowa jamą ciała Gamą kosmówkową) (ryć. 3-4). Jama ta otacza pierwotny pęcherzyk żółtkowy i jamę owodniową poza miejscem, w którym tarcza zarodkowa łączy się z trofoblastem za pomocą szypuły łączącej (ryć. 3-6). Mezoderma pozazarodkowa wyścielająca cytotrofoblast i owodnię zwana jest pozazarodkowa mezodermą ścienną, natomiast mezoderma pokrywająca pęcherzyk żółciowy nosi nazwę pozazarodkowej mezodermy trzewnej (ryć. 3-4) (7).
Wzrost dwublaszkowej tarczy zarodkowej jest stosunkowo powolny w porównaniu ze wzrostem trofoblastu i dlatego tarcza zarodkowa pozostaje bardzo niewielka (0,1 -0,2 mm). Komórki błony śluzowej macicy przybierają w tym czasie kształt wielokątny. Są one wypełnione glikogenem i lipidami. W przestrzeniach międzykomórkowych gromadzi się płyn przesiękowy, a zrąb błony śluzowej ulega
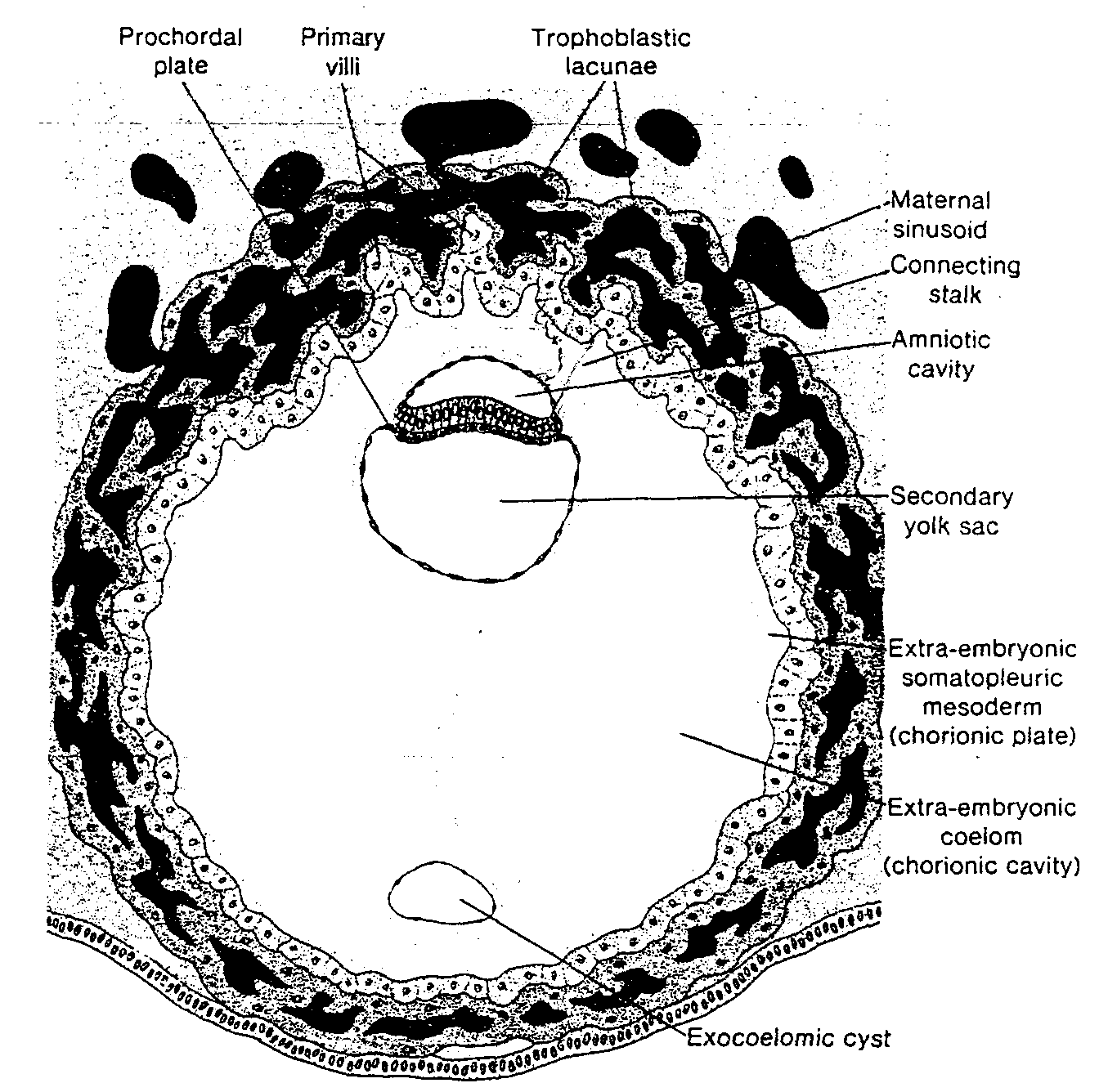
Rys. 3-6. Rysunek 13-dniowej blastocysty człowieka. Lakuny trofoblastyczne występują teraz zarówno na biegunie zarodkowym, jak i przeciwzarodkowym. Rozpoczęło się już krążenie maciczno-lożyskowe. Pokazane są kosmki pierwotne i pozazarodkowa jama ciała, czyli jama kosmówkową. Pęcherzyk żółtkowy wtórny jest całkowicie wysłany endodermą.
Prochordal plate — płytka przedstrunowa; Primary villi — kosmki pierwotne; Trophoblastic lacunae — lakuny trofoblastyczne; Maternal sinusoid — sinusoid matczyny; Connecting stalk — szypula łącząca; Amniotic cavity — jama owodniową; Extra-embryonic somatopleuric mesoderm (chorionic plate) — pozazarodkowa mezoderma ścienna (blaszka kosmówki); Secondary yolk sac — pęcherzyk żółtkowy wtórny; Extra-embryonic coelom (chorionic cavity) — pozazarodkowa jama ciała (jama kosmówkową); Exocoelomic cyst — torbiel po zewnątrzzarodkowej jamie ciała
rozpulchnieniu. Zmiany te, zwane reakcją doczesnową, początkowo są ograniczone do rejonu bezpośrednio otaczającego miejsce implantacji, ale po krótkim czasie rozprzestrzeniają się na całą błonę śluzową macicy.
Trzynasty dzień rozwoju
Do 13 dnia rozwoju błona śluzowa w obrębie ubytku zazwyczaj goi się. Niekiedy jednak w miejscu implantacji może nastąpić krwawienie spowodowane zwiększonym dopływem krwi do lakun. Ponieważ krwawienie to występuje około 28 dnia cyklu miesiączkowego, można je pomylić z normalnym krwawieniem miesiączkowym i w ten sposób błędnie określić spodziewana datę porodu.
W trofoblaście pojawiają się pierwsze kosmki Komórki cytotrofoblastu w niektórych miejscach mnożą się i wnikają do syncycjotrofoblastu, wytwarzając w ten sposób kolumny komórek otoczone przez syncycjum. Kolumny te wraz z pokrywającym je syncycjum zwane są kosmkami pierwotnymi (ryć. 3-6 i 4-8 A).
W tym samym czasie z hipoblastu powstają komórki wędrujące po wewnętrznej powierzchni błony zewnatrzzarodkowej jamy ciała (ryć. 3-4). Komórki te rozmnażają się i stopniowo tworzą nową jamę wewnątrz pozazarodkowej jamy ciała. Stanowi ona wtórny albo ostateczny pęcherzyk żółtkowy (saccus vitellinus defmitus) (ryć. 3-6 i 3-7).
Pęcherzyk żółtkowy wtórny jest znacznie mniejszy niż zewnątrzzarodkowa jama ciała lub pęcherzyk żółtkowy pierwotny. W czasie jego tworzenia się duże fragmenty pozazarodkowej jamy ciała ulegają odsznurowaniu. Tworzą one następnie torbiele zewnatrzzarodkowej jamy ciała, często napotykane w pozazarodkowej jamie ciała, czyli w jamie kosmówkowej (ryć. 3-6 i 3-7).
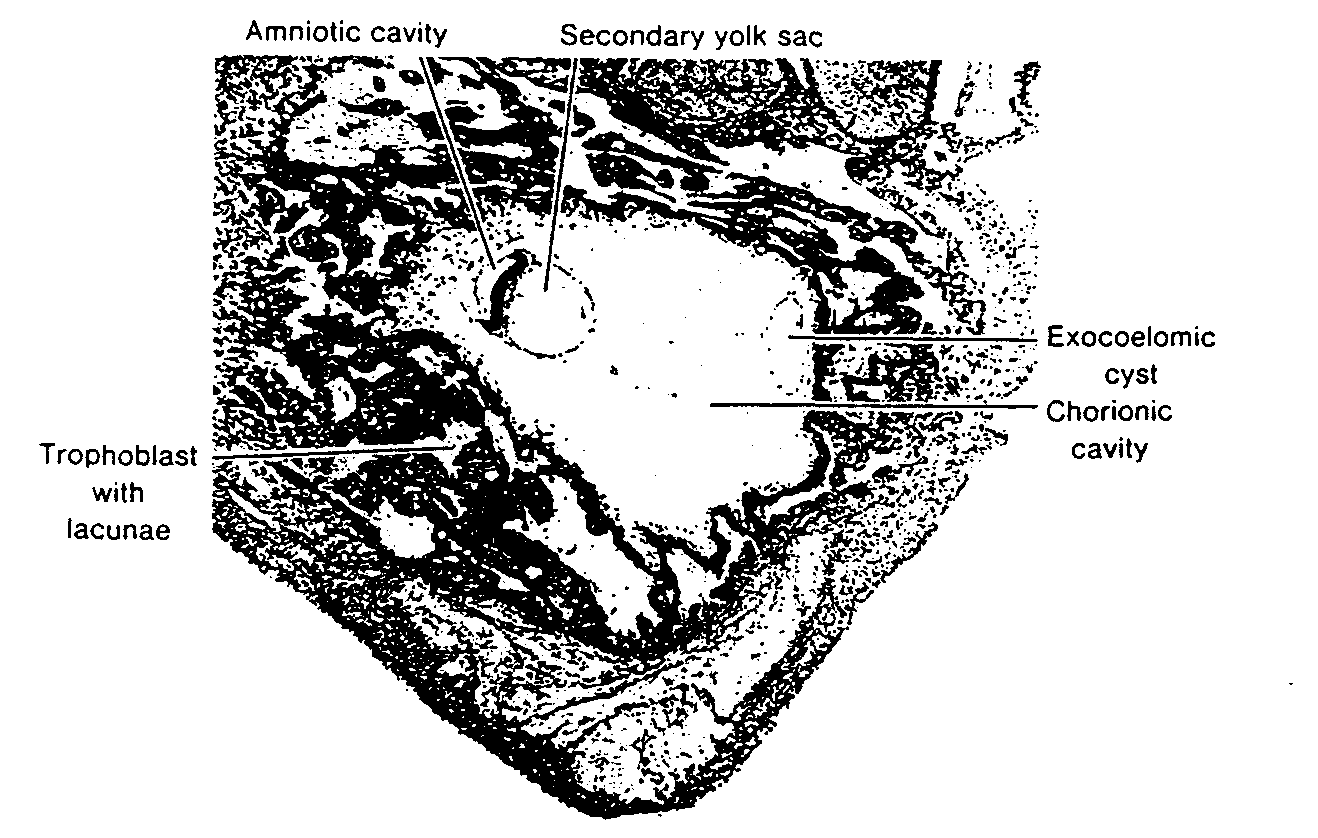
Jednocześnie z powstawaniem wtórnego pęcherzyka żółtkowego pozazarodkowa jama ciała znacznie się powiększa i tworzy dużą jamę. zwaną jama kosmówkowa (cavum chorionicum). Mezoderma zewnątrzzarodkowa pokrywająca wewnętrzną powierzchnię cytotrofoblastu nazywa się teraz blaszka kosmówki. Mezoderma pozazarodkowa przechodzi przez jamę kosmówkowa tylko w obrębie szypuły łączącej (caulis connectionis) (w podręcznikach polskich często nazywanej szypuła brzuszną, przyp. tłum.) (ryć. 3-6).
Ryć. 3-7. Przekrój przez miejsce implantacji w 13 dniu po zapłodnieniu. Widać jamę kosmówkowa, pęcherzyk żółtkowy i torbiele zewnatrzzarodkowej jamy ciała w jamie kosmówkowej. Większość lakun jest wypełniona krwią. (Z pracy A. T. Hertiga, J. Rocka i E. C. Adamsa: A description ot 34 human ova within the first 17 days of development. Am. /. Anat. 98:435, 1956. Dzięki uprzejmości Carnegie Institution of Washington).
Amniotic cavity — jama owodniowa; Secondary yolk sac — pęcherzyk żółtkowy wtórny; Exocoelemic cyst — torbiel po zewnatrzzarodkowej jamie ciała; Chorionic cavity — jama kosmówkowa; Trophoblast with lacunae — trofoblast z lakunami
W miarę rozwoju naczyń krwionośnych szypuła łącząca (brzuszna) przekształca się w sznur pępowinowy (pępowinę) (funiculus wnbilicalis).
Do końca drugiego tygodnia rozwoju tarcza zarodkowa składa się z dwóch przylegających do siebie krążków: epiblastu, tworzącego dno stale powiększającej się jamy owodniowej i hipoblastu, tworzącego sklepienie ostatecznego pęcherzyka żółtkowego. W części głowowej tarczy hipoblast wykazuje niewielkie zgrubienie zwane płytka przedstrunowa (lamina prochordalis). W tym miejscu występują walcowate komórki ściśle przylegające do leżącego powyżej epiblastu (ryć. 3-6).
Nieprawidłowe miejsca implantacji
Blastocysta człowieka zazwyczaj implantuje się na tylnej lub przedniej ścianie trzonu macicy. Niekiedy miejsce implantacji leży w pobliżu ujścia wewnętrznego cieśni macicy (ryć. 3-8). Wówczas w późniejszym okresie ciąży łożysko rozciąga się ponad cieśnią (łożysko przodujące, placenta previa) i może spowodować obfite krwawienie w drugiej połowie ciąży i podczas porodu.
Implantacja nierzadko następuje poza macicą, co prowadzi do wystąpienia ciąży pozamacicznej (graviditas extrauterina s. ectopica). Ciąża taka może być zlokalizowana w dowolnym miejscu jamy brzusznej, w jajniku lub w jajowodzie (ryć. 3-8). Ciąża pozamaciczna zazwyczaj prowadzi do obumarcia zarodka i wystąpienia u matki silnego krwotoku w 2 miesiącu ciąży. W jamie brzusznej
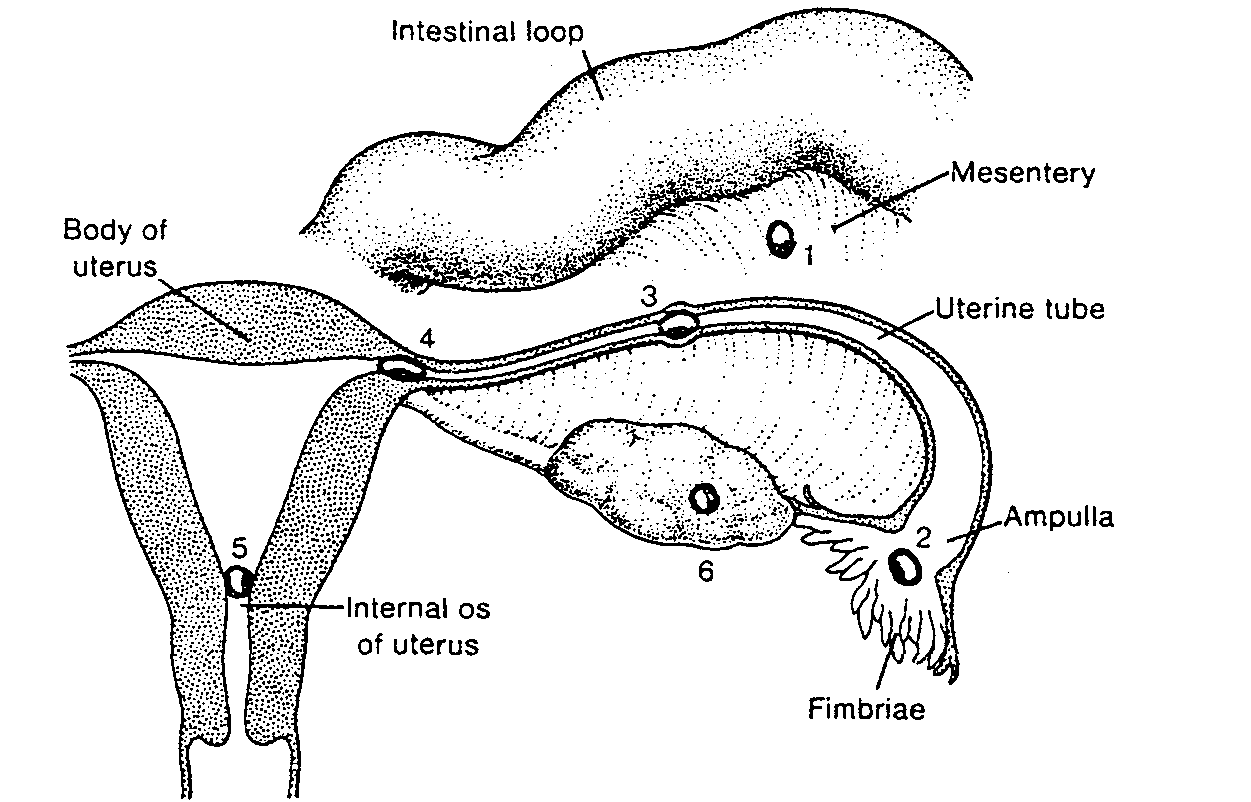
Ryć. 3-8. Rysunek pokazuje miejsca nieprawidłowej implantacji blastocysty. 1, Miejsce implantacji w jamie brzusznej. Blastocysta najczęściej wszczepia się w zagłębieniu odbytniczo-macicznym (kieszonce Douglasal, ale może wszczepić się w dowolnym miejscu pokrytym otrzewną. 2. Implantacja w bańce jajowodu. 3, Implantacja w jajowodzie. 4. Implantacja śródmiąższowa, to jest w miejscu ujścia jajowodu do macicy. 5, Implantacja w obrębie cieśni, często prowadząca do powstania łożyska przodującego. 6, Implantacja w jajniku. (Zmodyfikowane, wg W. J. Hamiltona i H. W. Mossmana: Human embryology, Baltimore, Williams & Wilkins, 1972).
Body of uterus — trzon macicy: Internal os of uterus — ujście wewnętrzne-desni macicy; Fimbrine — strzępki; Ampulla — bańka jajowodu: Utorine tube — jajowód; Mesentery — krezka; Intestinal loop — pętla jelitowa
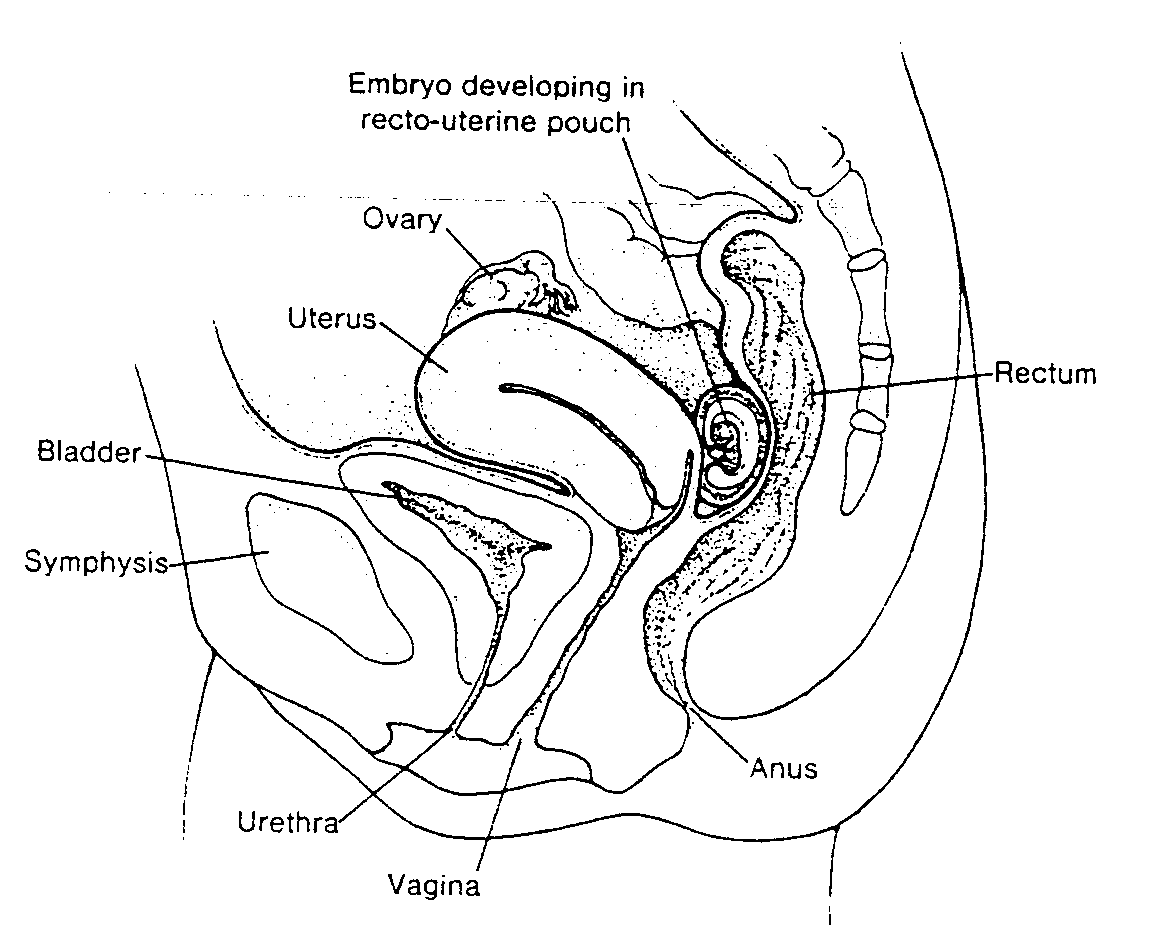
Ryć. 3-9. Przekrój pęcherza moczowego, macicy i odbytnicy w linii pośrodkowej, ukazujący ciążę pozamaciczną i brzuszną) w zagłębieniu odbytniczo-madcznym.
Bladder — pęcherz moczowy; Symphysis — spojenie łonowe; Urethra — cewka moczowa; Vagina — pochwa; Anus — odbyt: Rectum — odbytnica; Embryo developing in recto-uterine pouch — zarodek rozwijający się w zagłębieniu odbytniczo-macicznym; Ovary — jajnik; Uterus — macica
blastocysta najczęściej przyczepia się do otrzewnej wyścielającej zagłębienie odbytniczo-maciczne (kieszonkę Douglasa) (ryć. 3-9). Blastocysta może przyczepić się do otrzewnej pokrywającej jelito lub do sieci. Zarodek wszczepiony poza macica rzadko osiąga pełny rozwój.
Czasami blastocysta rozwija się w jajniku jako pierwotna ciąża jajnikowa (gravulitas primaria ovaricci). Znacznie częściej jednak ciąża pozamaciczna rozwija się w jajowodzie (ciąża jajowodowa, graviditas tubalis). W tym ostatnim przypadku jajowód pęka około 2 miesiąca ciąży, doprowadzając do ciężkiego krwotoku wewnętrznego (ryć. 3-10).
Nieprawidłowe blastocysty
Hertig, Rock i Adams (1) opisali unikatowa serię 26 zaimplantowanych blastocyst w wieku od 7 i '/: do 17 dni po zapłodnieniu. Wszystkie blastocysty pochodziły od pacjentek wykazujących normalna płodność. Niespodziewanie, dziewięć (36,6%) blastocyst było nieprawidłowych. Niektóre zawierały jedynie syncycjum, natomiast inne wykazywały różnego stopnia hipoplazję trofoblastu. W dwóch blastocystach brakowało embrioblastu. a w kilku tarcza zarodkowa miała niewłaściwe położenie.
Większość nieprawidłowych blastocyst prawdopodobnie nie wywołałaby żadnych objawów ciąży, gdyż ich trofoblast był zbyt słabo rozwinięty, aby wytworzyć wystarczającą ilość hormonów niezbędną do utrzymania ciałka żółtego. Zarodki te zapewne zostałyby poronione w czasie następnego cyklu miesiączkowego.
Ryć. 3-10. Zdjęcie ciąży jajowodowej. Zarodek mający około 2 miesięcy wkrótce wydostanie się jajowodu przez pękniętą ścianę.
Trophoblast — trofoblast; Fimbriae — strzępki; Rupture in oviduct — pęknięcie jajowodu; Yolk sac — pęcherzyk żółtkowy.
Na podstawie wieloletniego doświadczenia w badaniu zarodków w materiale uzyskanym po chirurgicznym usunięciu macicy Hertig (8) w następujący sposób podsumowuje swoje obserwacje nad przyczynami niepowodzeń rozrodu, u płodnych kobiet, mających optymalne warunki do zajścia w ciążę, 15% owocytówjiie ulega zapłodnieniu mimo kontaktu z plemnikami, a 10-15% zygot rospoczyna bruzdkowanie, ale nie jest zdolne do implantacji. Spośród 70-75% zarodków, które dokonały implantacji tylko 58% dożyje do 2 tygodnia ciąży i wśród nich będzie 16% zarodków nieprawidłowych. W rezultacie do dnia, w którym powinna wystąpić miesiączka, przeżyje tylko 42% jaj będących uprzednio w kontakcie z plemnikami (9). Spośród tego odsetka pewna liczba zarodków ulegnie poronieniu w czasie następnych tygodni, a część płodów urodzi się z wadami.
STRESZCZENIE
Na początku 2 tygodnia ciąży blastocysta jest częściowo zagłębiona w błonie śluzowej macicy. Z trofoblastu powstaje (a) warstwa wewnętrzna, z aktywnie dzielącymi się komórkami, zwana cytotrofoblastem i (b) warstwa zewnętrzna, zwaną syncycjotrofoblastem, który wrasta w tkanki matki (ryć. 3-1). W 9 dniu rozwoju w syncycjotrofoblaście powstają rozstępy, zwane lakunami. Następnie syncycjotrofoblast przeżera sinusoidy matki, krew wpływa do lakun i pod koniec 2 tygodnia od zapłodnienia powstaje pierwotne krążenie maciczno-łożyskowe (ryć. 3-6). W tym samym czasie cytotrofoblast tworzy kolumny komórek wrastające w syncycjotrofoblast. Kolumny te stanowią kosmki pierwotne. W końcu 2 tygodnia rozwoju blastocysta jest już całkowicie zagłębiona w błonie śluzowej macicy, a ubytek błony powstały w czasie implantacji wygoił się (ryć. 3-6).
Węzeł zarodkowy, czyli embrioblast różnicuje się na (a) epiblast i (b) hipoblast, tworząc wspólnie dwublaszkową tarczę zarodkową (ryć. 3-1). Komórki ektodermalne wraz z amnioblastami otaczają nowo utworzoną jamę, zwaną jamą owodniową. Komórki endodermalne przechodzą w ciągły sposób w błonę zewnątrzzarodkowej jamy ciała i wspólnie wyścielają jamę pęcherzyka żółtkowego pierwotnego (ryć. 3-4). Do końca 2 tygodnia rozwoju powstaje także pozazarodkowa mezoderrna wypełniająca przestrzeń pomiędzy trofoblastem i owodnią od zewnątrz i błoną zewnątrzzarodkowej jamy ciała od wewnątrz. Po utworzeniu w mezodermie rozstępów powstaje pozazarodkowa jama ciała, zwana także jamą kosmówkową (ryć. 3-6). Pozazarodkowa mezoderma wyścielająca cytotrofoblast i owodnię stanowi mezodermę ścienną, a mezoderma pokrywająca pęcherzyk żółtkowy mezodermę trzewną (ryć. 3-6).
Implantacja zachodzi w końcu 1. tygodnia ciąży. Komórki trofoblastyczne wrastają w nabłonek i leżący pod nim zrąb błony śluzowej macicy z pomocą wytwarzanych przez siebie enzymów proteolitycznych. Implantacja może również zajść poza macicą, np. w zagłębieniu odbytniczo-macicznym, w obrębie krezki, w jajowodzie lub w jajniku (ciąże pozamaciczne).
Rozdział 4
TRÓJBLASZKOWA TARCZKA ZARODKOWA
(TRZECI TYDZIEŃ ROZWOJU)
Gastrulacja: tworzenie mezodermy i endodermy zarodkowej
Najbardziej charakterystycznym zjawiskiem zachodzącym w 3 tygodniu rozwoju jest gastrulacja, czyli proces prowadzący do utworzenia w zarodku trzech listków zarodkowych. Gastrulacja zaczyna się od utworzenia smugi pierwotnej (linea primitiva) na powierzchni epiblastu (ryć. 4-1, 4-2 A i 4-7). Początkowo smuga jest słabo zaznaczona (ryć. 4-1), ale już u 15-16-dniowego zarodka jest wyraźnie widoczna w postaci wąskiej rynienki z lekko uwypuklonym obwałowaniem po obu stronach (ryć. 4-2 A). W dogłowowym końcu smugi, zwanym węzłem pierwotnym (nodits primitivus) znajduje się zgrubienie otaczające mały dołek pierwotny (fovea primitiva) (ryć. 4-2). Na przekroju poprzecznym przez okolicę smugi pierwotnej.
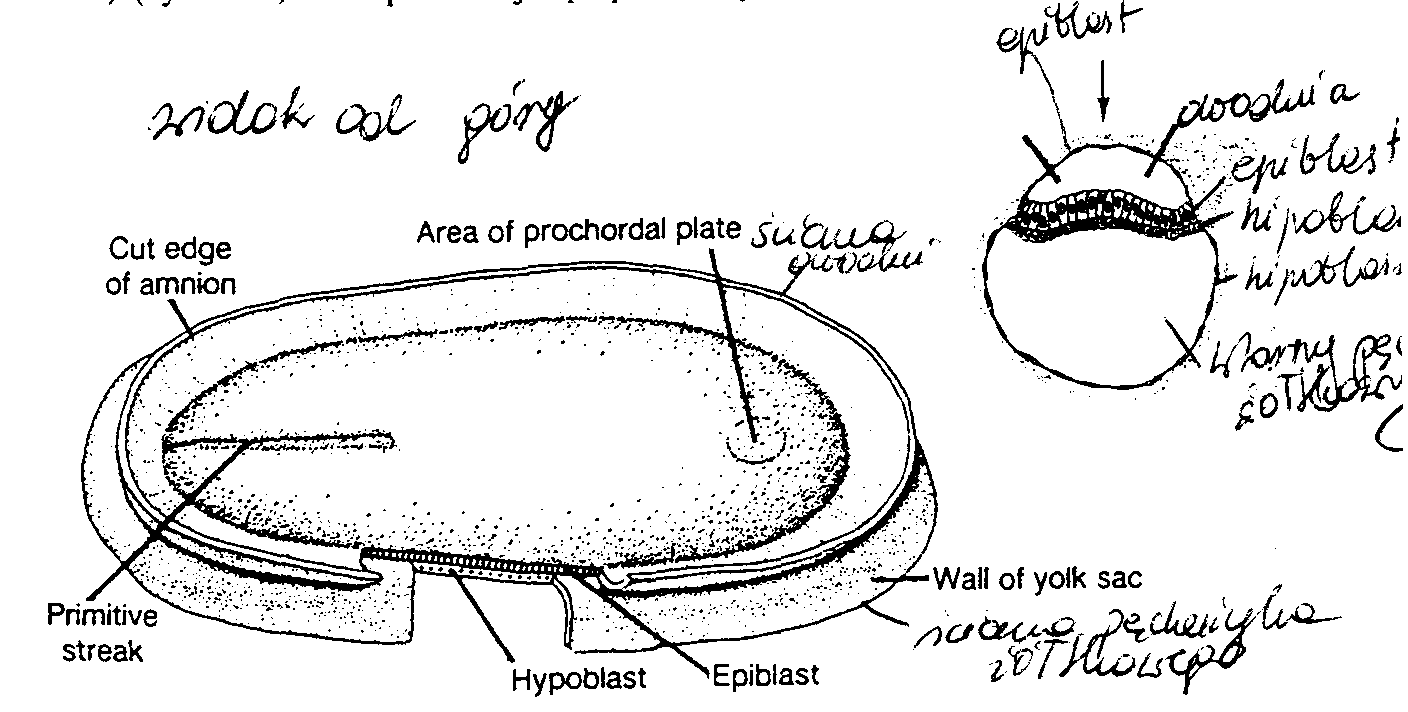
Ryć. 4-1. Schematycznie przedstawiona tarcza zarodkowa w końcu 2 tygodnia rozwoju. Jama owodniową została otwarta (por. wstawka), aby umożliwić obejrzenie grzbietowej powierzchni epiblastu; Hipoblast i epiblast stykają się ze sobą.
Cut edge of amnion — krawędź odciętej owodni; Primitive streak — smuga pierwotna; Hypoblast — hipoblast; Epiblast — epiblast; Wall ot yolk sac — ściana pęcherzyka żółtkowego; Area of prochordal plate — region płytki przedstrunowej
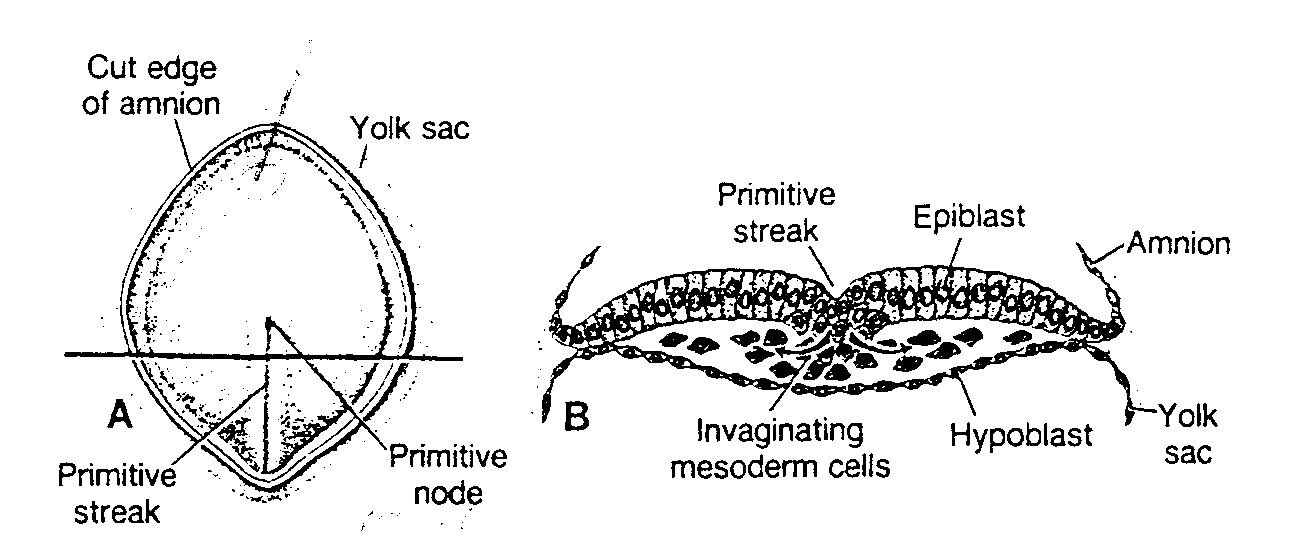
Ryć. 4-2. A. Schematyczny rysunek grzbietowej powierzchni 16-dniowego zarodka przed utworzeniem somitów (zmodyfikowane wg Streetera). Wyraźnie widać smugę pierwotną i węzeł pierwotny. B, Przekrój poprzeczny przez okolicę smugi pierwotnej pokazany na rysunku A. ukazujący wklęśnięcie (inwaginację) i następującą później wędrówkę komórek epiblastu w kierunku bocznym. Komórki te utworzą następnie mezodermę i endodermę.
Cut edge ot amnion — krawędź odciętej uwodni; Primicive streak — smuga pierwotna: Primitive node — węzeł pierwotny: Yolk sac — pęcherzyk żółtkowy: Invaginating mesoderm cell — inwaginacja komórek mezodermalnych; Hypoblast — hipoblast; Amnion — owodnia: Epiblast — epiblast
widać, że występujące tu komórki maja butelkowy kształt i że pomiędzy epiblastem i hipoblastem rozwija się nowa warstwa komórek (ryć. 4-2 B). Komórki epiblastu wędrują w kierunku smugi pierwotnej (ryć. 4-3), aby utworzyć mezodermę i wewnątrzzarodkową endodermę (1,2). Po dotarciu do regionu smugi pierwotnej przybierają one butelkowaty kształt, odłączają się od epiblastu i wnikają pod epiblast (ryć. 4-2B). Proces ten nazywa się wklęśnięciem (inwaginacja). Część
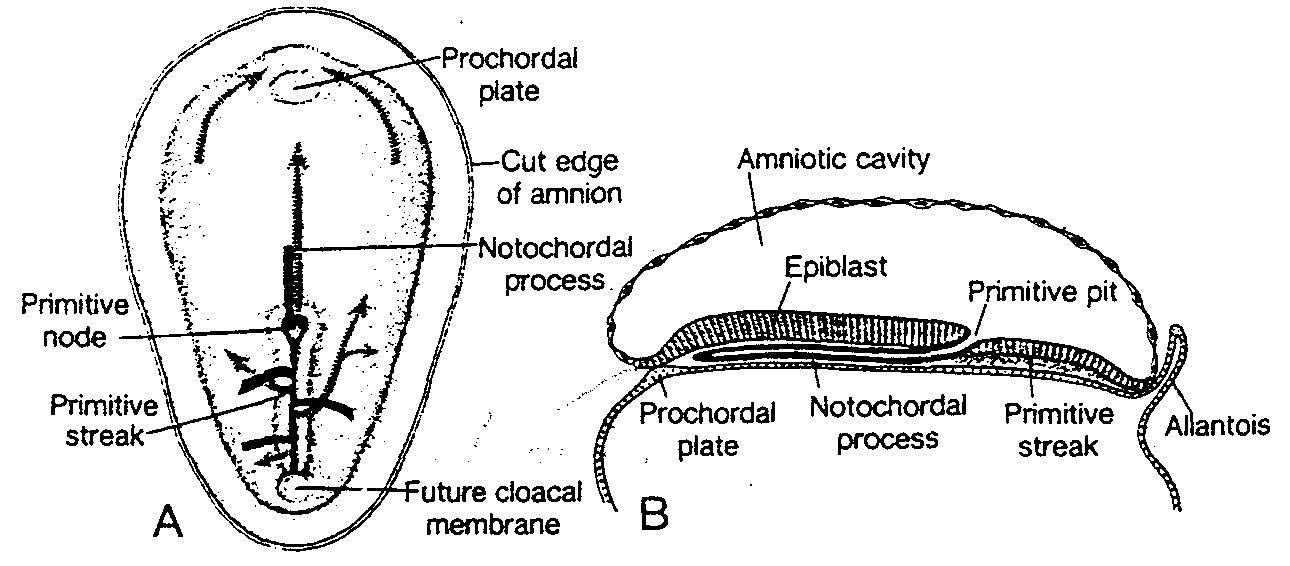
Ryć. 4-3. A, Schematycznie przedstawiona powierzchnia grzbietowa tarczy zarodkowej z zaznaczeniem wędrówki powierzchniowych komórek (ciągłe czarne linie) w kierunku smugi pierwotnej i węzła pierwotnego, a następnie wsuwanie się ich pomiędzy epiblast i hipoblast (linie przerywane). B, Głowowo-ogonowy przekrój 16-dniowego zarodka w linii pośrodkowej. W okolicy pośrodkowej występuje wyrostek struny grzbietowej rozciągający się od płytki przedstrunowej do węzła pierwotnego. W środku wyrostka struny grzbietowej występuje kanał struny grzbietowej.
Primitive node — węzeł pierwotny; Primitive streak — smuga pierwotna; Future cloacal membrane — przyszła błona stekowa; Notochordal process — wyrostek struny grzbietowej; Cut edge ot amnion — krawędź odciętej owodni; Prochordal plate — płytka przedstrunowa; Amniotic cavity — jama owodniowa; Epiblast — epiblast; Primitive pit — dołek pierwotny, Allantois — omocznia
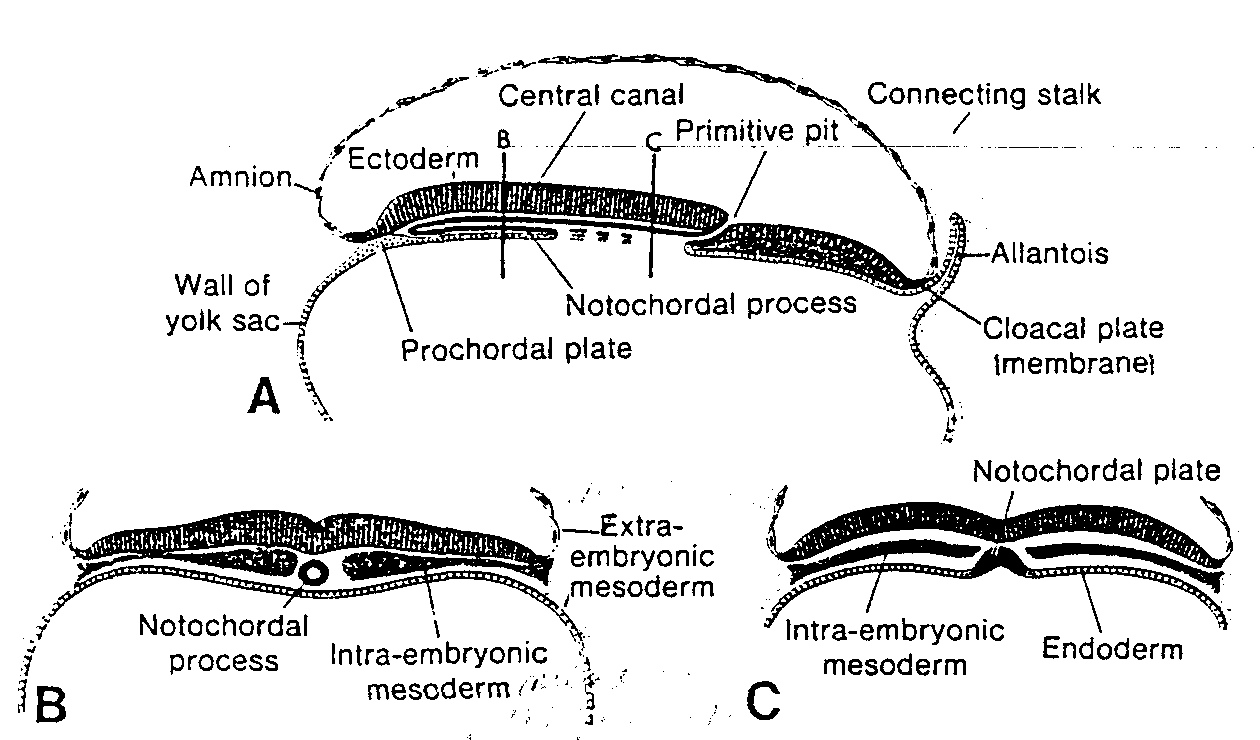
Ryć. 4-4. A, Rysunek przedstawia głowowo-ogonowy przekrój 17-dniowego zarodka w linii pośrodkowej. Wyrostek struny grzbietowej istnieje krótko i często ulega fragmentacji, zanim jeszcze zostanie w pełni utworzony. B, Przekrój poprzeczny przez okolicę, w której przetrwał jeszcze kanał struny grzbietowej. Mezoderma wewnątrzzarodkową łączy się z mezodermą pozazarodkową, pokrywającą pęcherzyk żółtkowy i owodnię. C, Przekrój poprzeczny przez okolicę, w której przetrwała część wyrostka struny grzbietowej jest przejściowo wklinowana w obręb endodermy.
Amnion — owodnia, Wall ot yolk sac — ściana pęcherzyka żółtkowego; Prochordal plate — płytka przedstrunowa; Notochordal process — wyrostek struny grzbietowej, Cloacal plate (membranę) — błona stekowa; Allantois — omocznia; Connecting stalk — szypuła łącząca: Primitive pit — dołek pierwotny; Central canal — kanał struny grzbietowej; Ectoderm — ektoderma; Notochordal process — wyrostek struny grzbietowej; Intraembryonic mesoderm — mezodermą wewnątrzzarodkową; Extra-embryonic mesoderm
— mezodermą pozazarodkową; Intra-embryonic mesoderm — mezodermą wewnątrzzarodkową; Endoderm
— endoderma; Notochordal plate — płytka struny grzbietowej
komórek po inwaginacji zajmuje miejsce hipoblastu tworząc w ten sposób endodermę zarodkową, a inne układają się pomiędzy epiblastem a nowo powstała endodermą i stanowią mezodermę. Komórki pozostające w epiblaście tworzą następnie ektodermę. W ten sposób epiblast, w czasie gastrulacji jest źródłem wszystkich listków zarodkowych zarodka (to jest ektodermy, mezodermy i endodermy (ryc. 4-2B i 4-6B) (l, 2).
W miarę wywędrowywania coraz to większej liczby komórek do przestrzeni l między warstwą epiblastu i hipoblastu komórki te zaczynają się przesuwać na boki i w kierunku dogłowowym (ryć. 4-3). Stopniowo przechodzą one poza granicę tarczy i stykają się z mezodermą pozazarodkową, pokrywającą pęcherzyk żółtkowy i owodnię (ryć. 4-4B i 4-5B). W kierunku dogłowowym omijają one po obu stronach płytkę przedstrunową, stykając się poza jej obrębem i tworząc tam mezodermalne pole (płytkę) sercotwórcze (ryć. 4-5A i 12-2).
Powstawanie struny grzbietowej
Komórki wchodzące do dołka pierwotnego przesuwają się w linii prostej w kierunku dogłowowym aż do płytki przedstrunowej (ryć. 4-3). W ten sposób
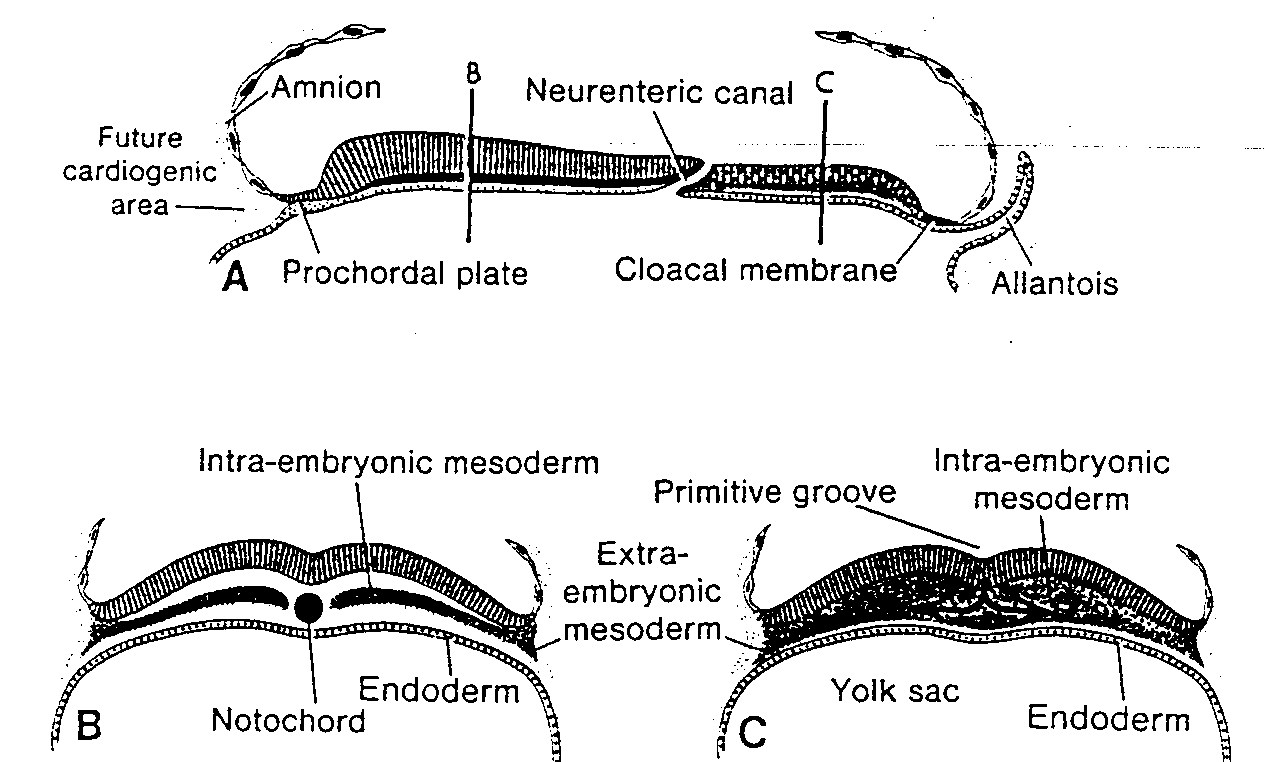
Ryć. 4-5. A, Rysunek przekroju głowowo-ogonowego 18-dniowego zarodka u linii pośrodkowej. Widać ostateczną strunę grzbietową. Kanał nerwowo-jelitowy łączy jamę owodniową z pęcherzykiem żółtkowym. B, Przekrój poprzeczny przez część głowową zarodka, pokazujący ostateczną strunę grzbietową i występującą po jej bokach mezodermę wewnatrzzarodkową. C, Przekrój poprzeczny przez okolice smugi pierwotnej. Formowanie mezodermy w części ogonowej przeciąga się do 4 tygodnia rozwoju. Amnion — owodnia; Future cardiogenic area — przyszłe miejsce powstawania serca; Prochordal plate — płytka przedstrunowa; Cloacal membranę — błona stekowa; Allantois — omocznia; Neurenteric canal — kanał nerwowo-jelitowy; Intra-embryonic mesoderm — mezoderma wewnątrzzarodkowa; Notochord — struna grzbietowa; Endoderm — endoderma; Extra-embryonic mesoderm — mezoderma pozazarodkowa; Yolk sac — pęcherzyk żółtkowy; Primitive groove — rynienka pierwotna
tworzą one cewkowaty wyrostek, zwany wyrostkiem struny grzbietowej lub wyrostkiem głowowym (ryć. 4-3B). Występujący w nim niewielki, pośrodkowy kanał stanowi przedłużenie dołka pierwotnego (ryć. 4-3B).
W 17 dniu rozwoju warstwa mezodermy i wyrostek struny grzbietowej całkowicie oddzielają warstwę endodermy od warstwy ektodermy z wyjątkiem płytki przedstrunowej w okolicy głowowej i błony stekowej w regionie położonym doogonowo od smugi pierwotnej (ryć. 4-4A). W obu tych miejscach endoderma i ektoderma ściśle przylegają do siebie.
W 18 dniu rozwoju dno struny grzbietowej zlewa się z leżącą pod nim endoderma, a następnie obie warstwy wyrostka rozpadają się w miejscu połączenia (ryc.. 4-4A). Stopniowo światło wyrostka struny grzbietowej całkowicie zanika (ryć. 4-4A i 4-5A). Pozostała cześć wyrostka struny grzbietowej wytwarza wąską płytkę, której komórki wklinowane są w endodermalny listek zarodkowy (ryć. 4-4C).
W czasie dalszego rozwoju komórki struny grzbietowej rozmnażają się i tworzą litą strukturę, zwaną ostateczną struną grzbietową (ryć. 4-5) (4). Struktura ta odłącza się następnie od endodermy, która ponownie wytwarza ciągłą warstwę będąca sklepieniem pęcherzyka żółtkowego (ryć. 4-5B). Struna grzbietowa (notochorda) stanowi teraz pośrodkową oś, wokół której powstanie następnie szkielet osiowy (5). Rozciąga się ona od płytki przedstrunowej (przyszłej

Ryć. 4-6. A, Elektronogram z mikroskopu skenującego pokazujący od strony grzbietowej zarodek myszy (odpowiadający w przybliżeniu 18-dniowemu zarodkowi ludzkiemu). Widoczne są uwypuklone fałdy nerwowe (CF). Smuga pierwotna leży dalej w kierunku doogonowym i jest niewidoczna. B, Przekrój poprzeczny zarodka pokazanego na rycinie A. gdzie jest zaznaczona linia przekroju. Widać trzy listki zarodkowe; wielorzedową warstwę komórek walcowatych neuroektodermy (Ec), spłaszczoną endodermę (En) i wpasowaną pomiędzy nie mezodermę (Me). Komórki w mitozie oznaczone *. (Dzięki uprzejmości Dr. K.K. Sulika, z Zakładu Biologii Komórki i Anatomii Uniwersytetu Północnej Karoliny).
błony gębowo-gardłowej (membrana stomatopharyngealis) do węzła pierwotnego. Przez pewien czas pęcherzyk żółtkowy i jama owodniowa są połączone wąskim kanałem, zwanym kanałem - nerwowo-jelitowym (canalis neurentericus) (ryć. 4-5A).
Jednocześnie z powstaniem błony stekowej w tylnej ścianie pęcherzyka żółtkowego powstaje mały uchyłek wnikający do szypuły łączącej. Uchyłek ten, zwany uchyłkiem omoczniowo-jelitowym lub omocznią (allantois), pojawia się około 16 dnia rozwoju (ryć. 4-4A i 4-5A) (6). U niektórych niższych kręgowców omocznia stanowi zbiornik dla produktów wydalanych przez układ moczowy. U człowieka jest narządem szczątkowym, ale może mieć pewne znaczenie przy powstawaniu zaburzeń rozwojowych pęcherza moczowego (patrz Rozdział 15).
Rozwój tarczy zarodkowej
Tarcza zarodkowa początkowo płaska i niemal okrągła (ryć. 4-2A), stopniowo przybiera wydłużony kształt z szerokim końcem głowowym i wąskim ogonowym (ryć. 4-6A i 4-7A, B). Powiększanie się tarczy zarodkowej zachodzi głównie w okolicy głowowej, okolica smugi pierwotnej prawie nie zmienia wymiarów. Należy jednak pamiętać, że powiększanie się i wydłużanie głowowej części tarczy spowodowane jest ciągłą migracją komórek z okolicy smugi pierwotnej w kierunku
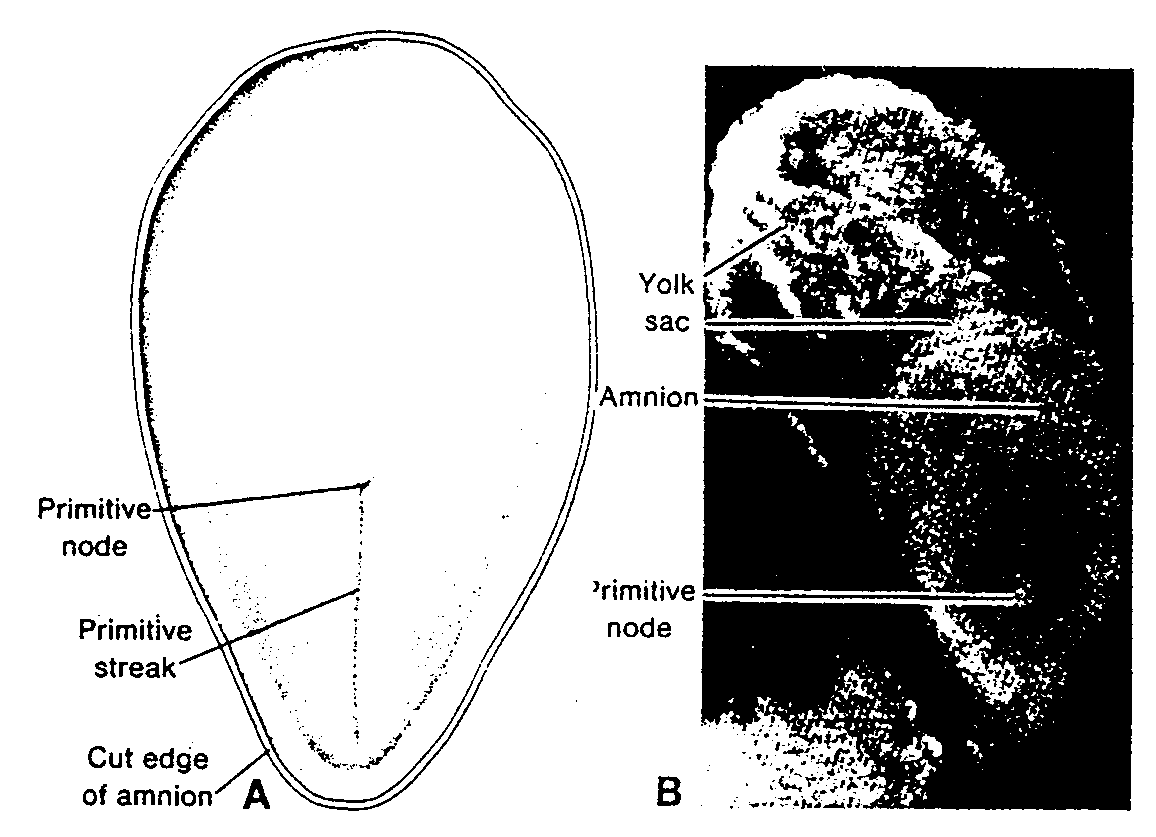
Ryć. 4-7. A. Rysunek grzbietowej powierzchni 18-dniowego zarodka. Zarodek ma kształt gruszkowaty i zawiera w końcu doogonowym smugę i węzeł pierwotny. B, Zdjęcie od strony grzbietowej 18-dniowego zarodka człowieka. Widać węzeł pierwotny i skierowaną do przodu strunę grzbietową. Pęcherzyk żółtkowy wykazuje nieco pofałdowaną powierzchnię. Długość zarodka wynosi 1,25 mm, a największa szerokość 0,68 mm. (Z pracy C. H. Heusera: A presomite embryo with a definite chorda canal. Contrib. Embcyol. 23:253, 1932. Dzięki uprzejmości Carnegie Institution of Washingtonl.
Primitive node — węzeł pierwotny; Primitive streak — smuga pierwotna; Cut edge of amnion — krawędź odciętej owodni; Yolk sac — pęcherzyk żółtkowy; Amnion — owodnia
dogłowowym. Wklęśnięcie (invaginatio) powierzchniowych komórek w obrębie smugi pierwotnej i ich późniejsza wędrówka ku przodowi i na boki trwa aż do końca 4 tygodnia rozwoju. Po osiągnięciu tego etapu smuga pierwotna wykazuje zmiany regresyjne, gwałtownie zmniejsza się i wkrótce zanika. Niekiedy zdarza się jednak, że jakaś pozostałość smugi pierwotnej utrzymuje się i po urodzeniu powoduje powstawanie guzów w okolicy krzyżowo-ogonowej (7). Guzy te często zawierają tkanki wywodzące się ze wszystkich trzech listków zarodkowych.
Fakt, że doogonowy koniec tarczy zarodkowej aż do końca 4 tygodnia stale dostarcza nowe komórki ma doniosłe znaczenie dla późniejszego rozwoju zarodka. W części głowowej listki zarodkowe zaczynają różnicować się w połowie 3 tygodnia, natomiast w części ogonowej w końcu 4 tygodnia. Niniejszy rozdział jest poświęcony opisowi tworzenia się listków zarodkowych, ale należy pamiętać, że powstawanie somitów z mezodermy i powstawanie ośrodkowego układu nerwowego z ektodermy także rozpoczyna się w 3 tygodniu rozwoju.
Dalszy rozwój trofoblastu
Na początku 3 tygodnia ciąży trofoblast wytwarza kosmki pierwotne składające się z cytotrofoblastycznego rdzenia pokrytego warstwą syncycjum (ryć. 3-6 i 4-8A). W czasie dalszego rozwoju do rdzenia kosmków wnikają komórki mezodermalne i rosną w kierunku doczesnej. Tak utworzona struktura stanowi kosmek drugorzędowy (ryć. 4-8B).
W końcu 3 tygodnia rozwoju z komórek mezodermalnych w rdzeniu kosmka zaczynają powstawać komórki układu krwiotwórczego i małe naczynia krwionośne, tworzące następnie układ naczyń włosowatych kosmka (ryć. 4-8C). Unaczyniony kosmek nazywa się kosmkiem trzeciorzędowym lub ostatecznym kosmkiem łożyskowym. Naczynia włosowate kosmków trzeciorzędowych łączą się z naczyniami włosowatymi rozwijającymi się w mezodermie blaszki kosmówki i w szypule łączącej (ryć. 4-9 i 4-10). Z kolei te ostatnie naczynia nawia-
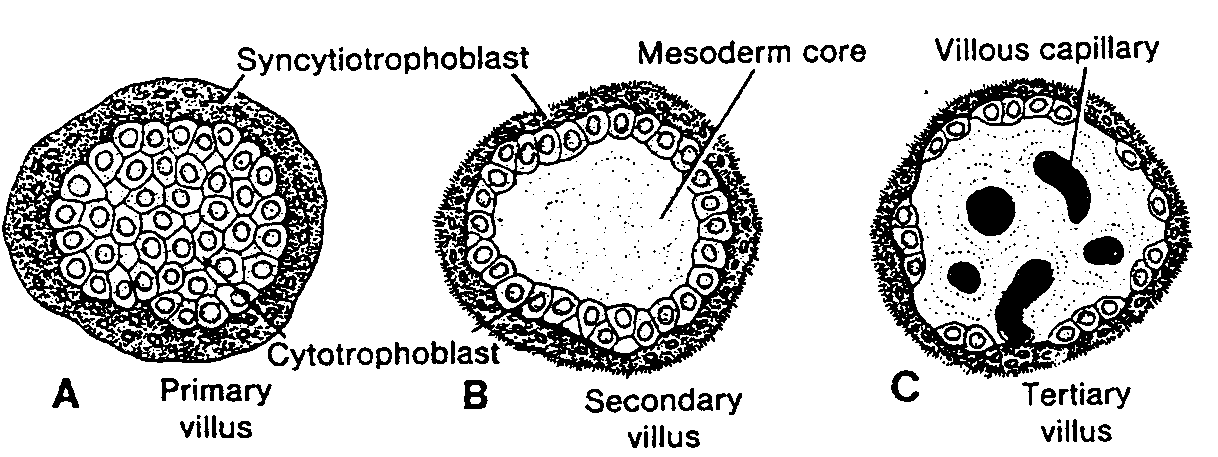
Ryc. 4-8. Schematyczne rysunki pokazujące rozwój kosmka. A, Przekrój poprzeczny przez kosmek pierwotny, składający się z cytotrofoblastycznego rdzenia pokrytego warstwą syncycjum. B, Przekrój poprzeczny przez kosmek drugorzędowy z mezodermalnym rdzeniem pokrytym pojedynczą warstwą komórek cytotrofoblastu, na której z kolei znajduje się syncycjum. C, Mezoderma kosmka z naczyniami włosowatymi i żyłkami.
Syncytiotrophoblast — syncycjotrofoblast; Cytotrophoblast — cytotrofoblast; Primary villus — kosmek pierwotny: Mesoderm core — rdzeń mezodermalny; Secondary villus — kosmek drugorzędowy; Villous paptllary — naczynie włosowate kosmka; Tertiary villus — kosmek trzeciorzędowy
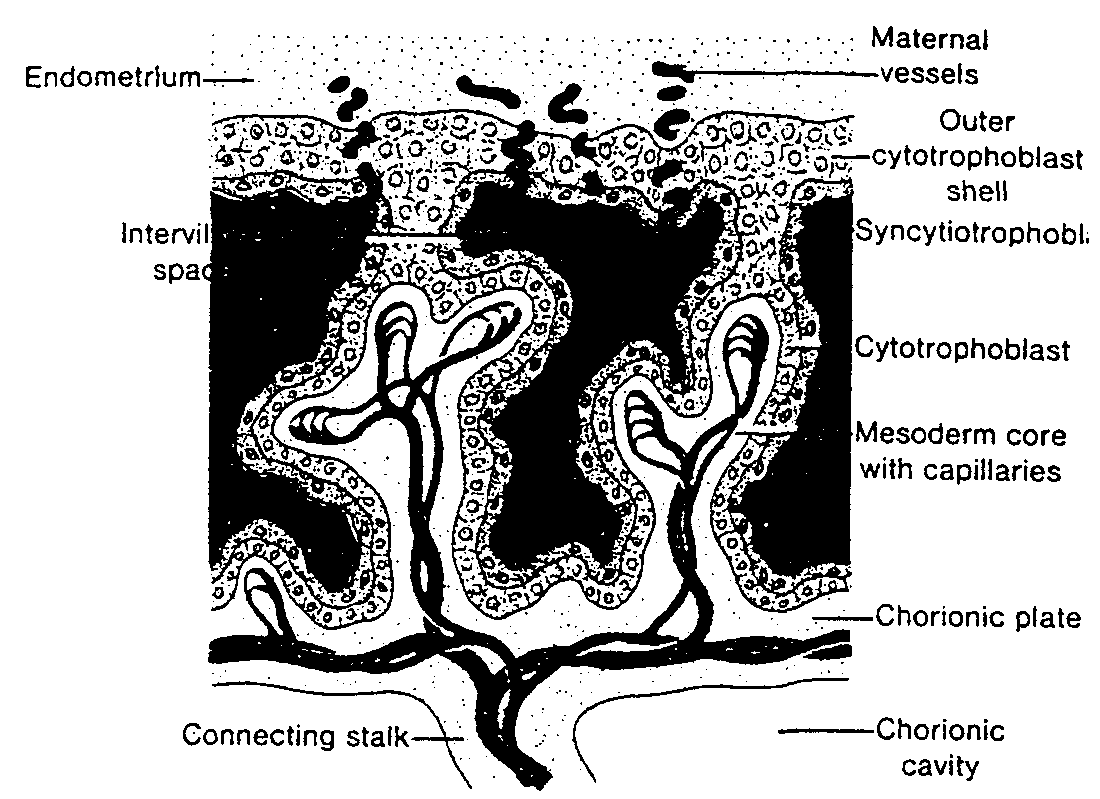
Ryć. 4-9. Schematyczny rysunek podłużnego przekroju kosmka z końca 3 tygodnia rozwoju. Widać, że naczynia krwionośne matki przechodzą przez pokrywę cytotrofoblastyczną do przestrzeni międzykosmkowych, otaczających kosmki. Naczynia włosowate w kosmkach łączą się z naczyniami w blaszce kosmówki i w szypule łączącej, a te z kolei z naczyniami wewnątrz zarodka.
Endometrium — błona śluzowa macicy; Intervillous space — przestrzeń międzykosmkowa; Connecting stalk — szypuła łącząca; Chorionic cavity — jama kosmówkowa; Chorionic plate — blaszka kosmówki: Mesoderm córę with capillaries — mezodermalny rdzeń kosmka z naczyniami włosowatymi; Cytotrophoblast — cytotrofoblast; Syncytiotrophoblast — syncycjotrofoblast; Outer cytotrophoblast shell — zewnętrzna pokrywa cytotrofoblastyczną; Maternal vessels — naczynia krwionośne matczyne
zują kontakt z wewnątrzzarodkowym układem krwionośnym, łącząc w ten sposób łożysko z zarodkiem (patrz Rozdział 5 i 12). Dlatego też, gdy w 4 tygodniu rozwoju serce zarodka podejmuje prace, układ kosmków jest gotowy do zaopatrywania zarodka w niezbędne substancje odżywcze i w tlen.
W tym samym okresie rozwoju komórki cytotrofoblastu kosmków stopniowo wnikają w leżące nad nimi syncycjum i dochodzą do błony śluzowej macicy. Tutaj łączą się z podobnymi pasmami cytotrofoblastu pochodzącymi z sąsiednich kosmków i wytwarzają cienką zewnętrzną pokrywę cytotrofoblastyczną (ang. outer cytotrophoblastic shell) (ryć. 4-9 i 4-10). Pokrywa ta stopniowo otacza cały trofoblast i mocno zakotwicza kosmówkę w tkance błony śluzowej macicy (ryć. 4-10) (8, 9). Kosmki biegnące od blaszki kosmówki do doczesnej podstawnej (blaszki doczesnej) zwane są kosmkami palowymi lub kosmkami czepnymi. Od ich bocznych powierzchni odchodzą, podobne do gałęzi drzewa kosmki, zwane kosmkami wolnymi (końcowymi), przez które zarodek pobiera substancje odżywcze (ryć. 4-11) (10).
Jednocześnie z przebiegiem powyższych procesów powiększa się jama kosmówkowa, tak że w 19 lub w 20 dniu rozwoju zarodek łączy się z trofoblastem tylko za pośrednictwem wąskiej szypuły łączącej (brzusznej) (ryć. 4-10). Z szypuły tej w późniejszym okresie rozwija się sznur pępowinowy łączący zarodek z łożyskiem.
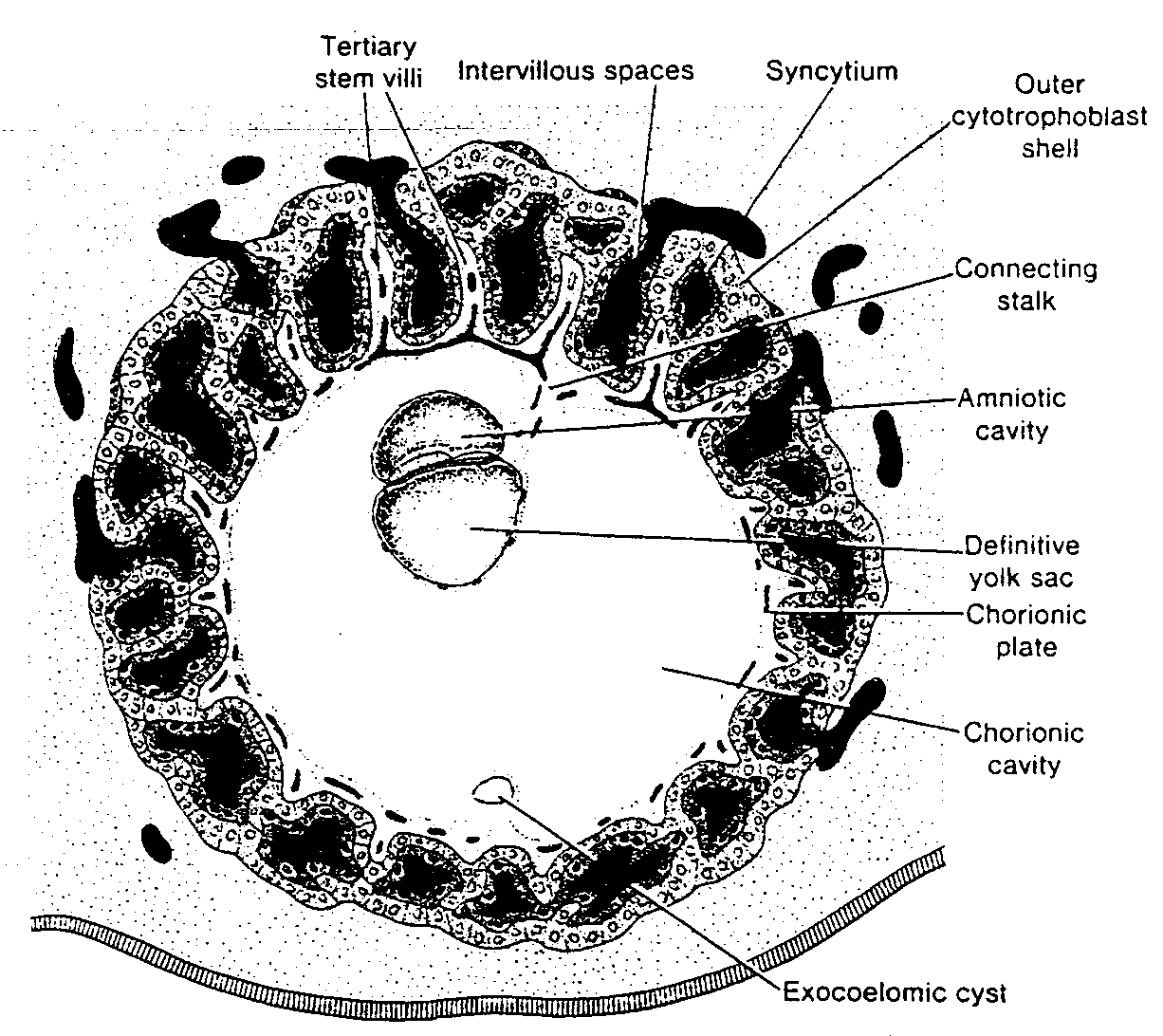
Ryć. 4-10. Diagram pokazujący zarodek w stadium przedsomitowym i trofoblast w końcu 3 tygodnia rozwoju. Trzeciorzędowe i drugorzędowe kosmki palowe nadają trofoblastowi charakterystyczny, gwiaździsty wygląd. W obrębie trofoblastu występują przestrzenie międzykosmkowe, wysłane przez syncycjum. Komórki cytotrofoblastyczne całkowicie otaczają trofoblast i bezpośrednio kontaktują się z błoną śluzową macicy. Zarodek jest zawieszony w jamie kosmówkowej na szypule łączącej.
Tertiary stem villi — trzeciorzędowe kosmki palowe; Intervillous spaces — przestrzenie międzykosmkowe; Syncytium — syncycjum; Outer cytotrophoblastic shell — zewnętrzna skorupa cytotrofoblastyczną; Connecting stalk — szypuła łącząca; Amniotic cavity — jama owodniowa; Definite yolk sac — ostateczny pęcherzyk żółtkowy; Chorionic plate — blaszka kosmówki: Chorionic cavity — jama kosmówkowa; Exocoelomic cyst — torbiel po zewnątrzzarodkowej jamie ciała
STRESZCZENIE
Najbardziej charakterystycznym procesem zachodzącym podczas 3 tygodnia rozwoju jest gastrulacja rozpoczynająca się od powstania smugi pierwotnej i występującego w jej końcu głowowym węzła pierwotnego. W okolicy węzła i smugi komórki epiblastu wędrują do wewnątrz (inwaginacja) i tworzą dwie nowe warstwy komórek — endodermę i mezodermę. W ten sposób z epiblastu powstają wszystkie trzy listki zarodkowe. Komórki mezodermy wewnątrzzarodkowej (ryć. 4-6B) wędrują pomiędzy pozostałymi listkami zarodkowymi aż do zetknięcia się z rnezodermą zewnątrzzarodkową pokrywającą pęcherzyk żółtkowy i owodnię (ryć. 4-2 i 4-3).
Ryć. 4-11. Kosmki palowe (SV) rozciągają się od blaszki kosmówki (CP) do blaszki doczesnej (BP). Kosmki końcowe (strzałki) występują w postaci cienkich odgałęzień kosmków palowych. (Z pracy B. F. Kinga i).). Maisa: Developmental changes in Rhesus monkey placental villi and cell columns. Anat Embriol 165:361 -376,1982).
Komórki inwaginujące w obrębie węzła pierwotnego migrują w linii prostej do przodu aż do płytki przedstrunowej. Tworzą one cewkowaty twór zwany wyrostkiem struny grzbietowej lub przedłużeniem głowowym (ryć. 4-4). W miarę dalszego rozwoju światło wyrostka zanika i powstaje lite pasmo komórek zwane struną grzbietową. Tworzy ona pośrodkową oś, będącą zaczątkiem szkieletu osiowego (ryć. 4-5). W ten sposób w końcu 3 tygodnia zostają ukształtowane trzy podstawowe listki zarodkowe — ektoderma, mezoderma i endoderma i może rozpocząć się dalsze różnicowanie tkanek i narządów.
W tym samym czasie szybko rozwija się trofoblast. W pierwotnych kosmkach pojawia się mezenchymatyczny rdzeń, w którym następnie powstają naczynia włosowate (ryć. 4-8). Po nawiązaniu przez te naczynia kontaktu z naczyniami włosowatymi blaszki kosmówki i szypuły łączącej kosmki są gotowe do zaopatrywania zarodka w substancje odżywcze i tlen (ryć. 4-10).
Rozdział 5
OKRES ZARODKOWY
(OD TRZECIEGO DO ÓSMEGO TYGODNIA ROZWOJU)
W okresie od 3 do 8 tygodnia rozwoju, zwanym okresem zarodkowym*, z każdego listka zarodkowego powstaje pewna liczba swoistych dla niego tkanek i narządów. W końcu okresu zarodkowego istnieją już główne układy narządów. W wyniku powstawania narządów kształt zarodka ulega znacznej zmianie, tak że w końcu 2 miesiąca rozwoju można już rozpoznać główne zewnętrzne cechy ciała.
Tkanki i narządy pochodzące z ektodermalnego listka zarodkowego
Na początku 3 tygodnia rozwoju ektodermalny listek zarodkowy ma kształt płaskiej tarczy, z okolica głowową szerszą od ogonowej (ryć. 5-1A-C). Po pojawieniu się struny grzbietowej i pod jej indukcyjnym wpływem ektoderma, leżąca ponad struną grzbietową, grubieje, tworząc płytkę nerwową (lamina neuralis) (ryć. 5-2). Komórki tej płytki stanowią neuroektodermę, a jej indukcja jest początkowym etapem procesu neurulacji (neurulatio).
Wydłużona, mająca kształt podeszwy, płytka nerwowa stopniowo powiększa się w kierunku smugi pierwotnej (ryć. 5-2B, C). W końcu 3 tygodnia rozwoju boczne brzegi płytki nerwowej unoszą się ku górze tworząc fałdy nerwowe (plicae neurales), a obniżona okolica środkowa płytki wytwarza rynienkę nerwową (sulcus neuralis) (ryć. 5-2 i 5-3A, B). Fałdy nerwowe stopniowo zbliżają się do siebie i łączą w linii pośrodkowej (ryć. 5-3C). Połączenie to rozpoczyna się w okolicy przyszłej szyi (czwartego somitu) i postępuje w kierunku dogłowowym i doogonowym (ryć. 5-4A, B i 5-5). W rezultacie powstaje cewa nerwowa (tubus neuralis). Na dogłowowym i doogonowym końcu zarodka cewa pozostaje przez pewien czas otwarta, łącząc się z jamą owodniową za pośrednictwem otworu cewy nerwowej przedniego (neuroporus rostralis) i tylnego (neuroporus caudalis) (ryć. 5-4B, 5-5A, i 5-7A). Zamknięcie otworu przedniego cewy nerwowej zachodzi około 25 dnia (stadium 18-20 somitów), a otworu tylnego 27 dnia (stadium 25 somitów). Stanowi to zakończenie neurulacji. Ośrodkowy układ nerwowy ma wówczas postać zamkniętej, cewkowatej struktury z wąską częścią doogonową, czyli rdzeniem kręgowym, i znacznie szersza częścią dogłowową z charakterystycznymi rozszerzeniami będącymi pęcherzykami mózgowia (patrz Rozdział 20).
* Niektórzy autorzy okresem zarodkowym nazywają okres od zapłodnienia do 8 tygodnia rozwoju (przyp. tłum.).
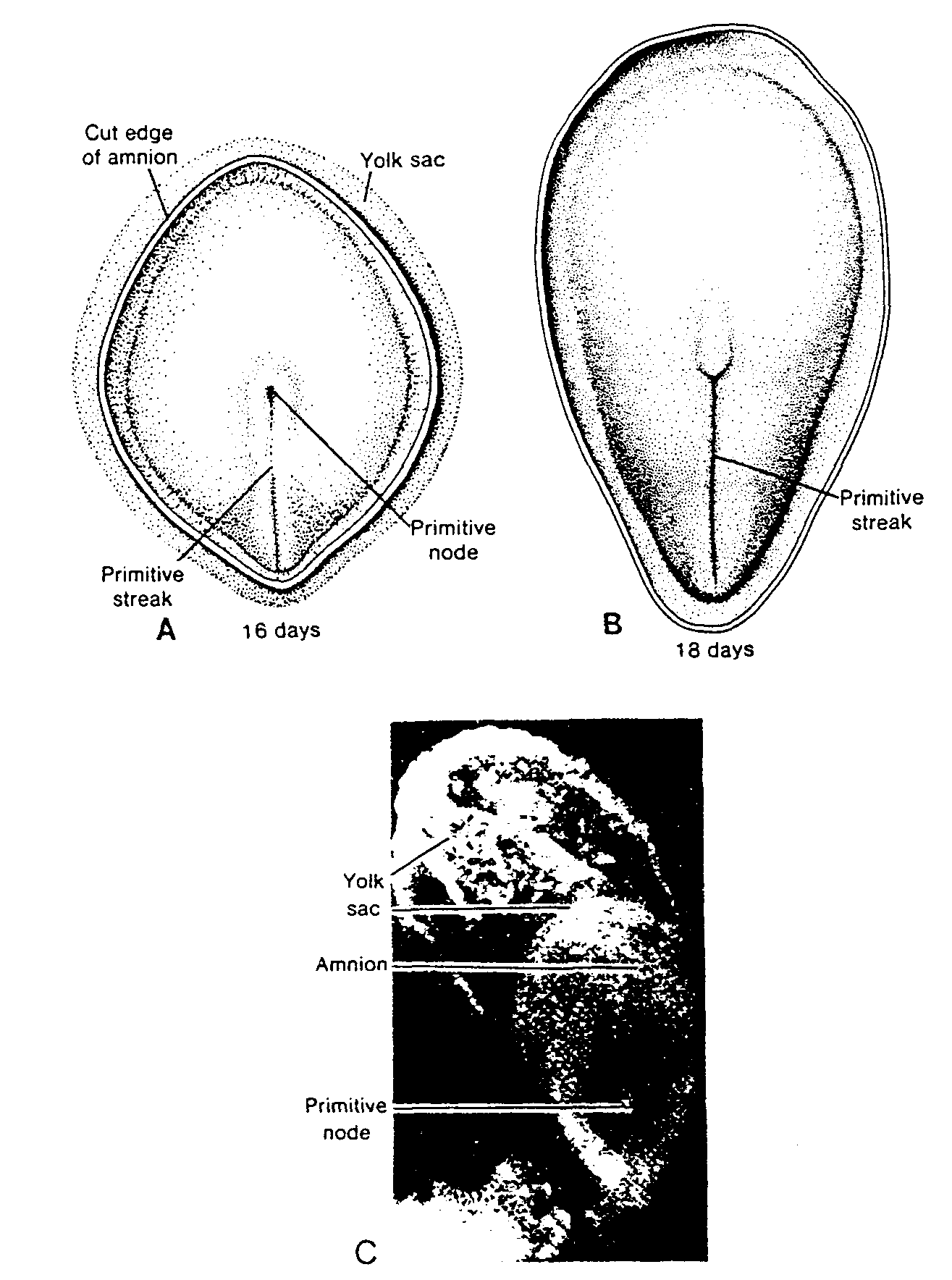
Ryć. 5-1. A, 16-dniowy zarodek w stadium przedsomitarnym widoczny od strony grzbietowej. Widać smugę pierwotną i węzeł pierwotny. B, 18-dniowy zarodek w stadium przedsomitarnym widoczny od strony grzbietowej. Zarodek ma gruszkowaty kształt z okolicą głowową nieco szerszą od ogonowej. C. zdjęcie 18-dniowego ludzkiego zarodka od strony grzbietowej. Widać węzeł pierwotny i odchodzącą od niego strunę grzbietową. Długość zarodka wynosi 1,25 mm, a największa szerokość 0,6 mm. (Z pracy C. H. Heusera: A presomite embryo with a definite chorda canal. Conlrib Embryol 23:253,1932, dzięki uprzejmości Carnegie Institution of Washington.
A Cut edge of amnion — krawędź odciętej owodni; Primitive streak — smuga pierwotna; 16 days — 16 dni; Primitive node — węzeł pierwotny; Yolk sac — pęcherzyk żółtkowy; B 18 days —18 dni; C Amnion — owodnia

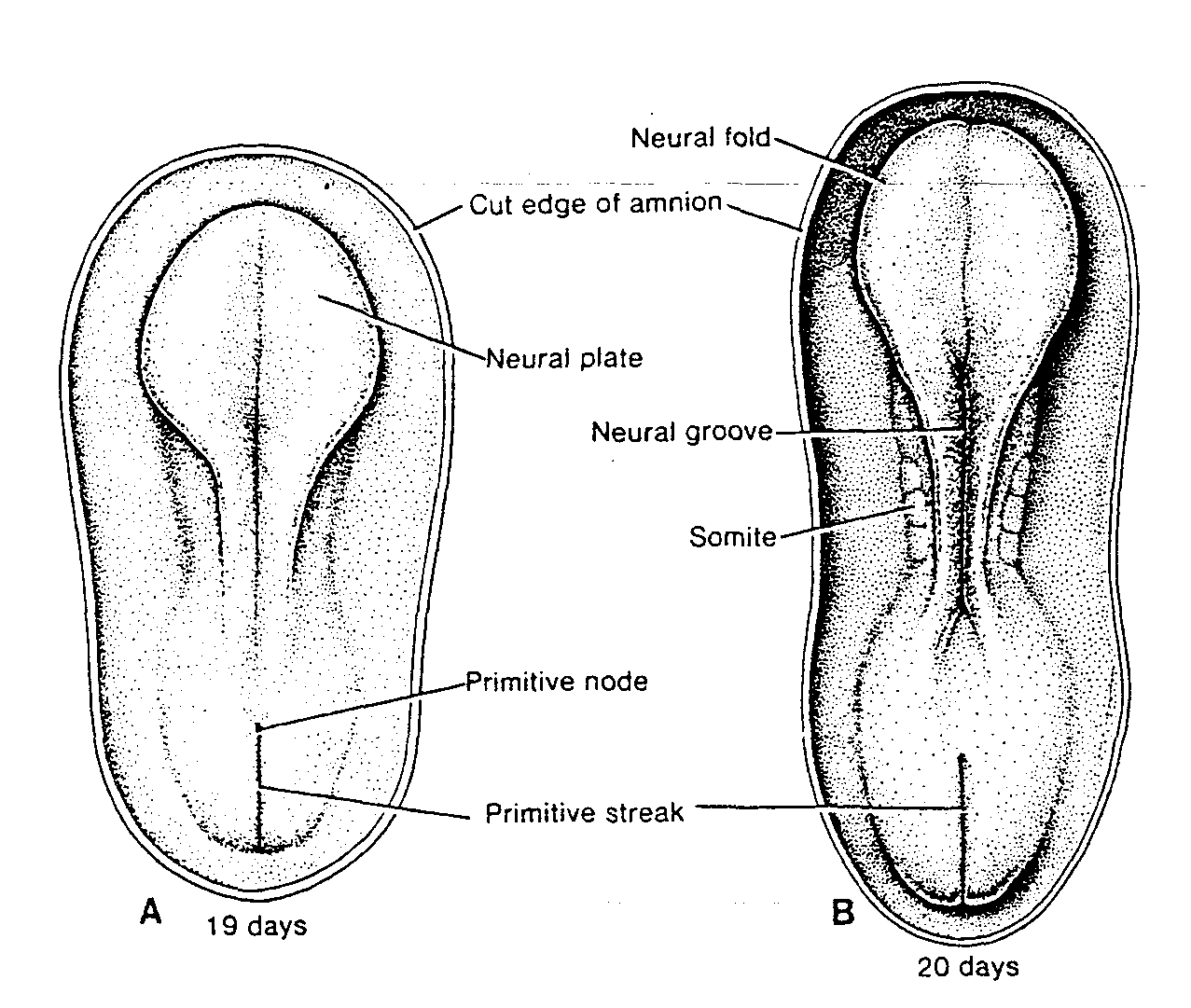
Ryć. 5-2. A, Zarodek z późnego stadium przedsomitarnego (19 dzień rozwoju) widoczny od strony grzbietowej. (Zmodyfikowano wg Davisa). Po usunięciu owodni wyraźnie widać płytkę nerwową. B, Ludzki zarodek w 20 dniu rozwoju widoczny od strony grzbietowej (Zmodyfikowano wg Ingailsa). Należy zwrócić uwagę na pojawienie się somitów, rynienki nerwowej i fałdów nerwowych. C, elektronogram zarodka myszy z mikroskopu skenującego izarodek odpowiada w przybliżeniu 20-dniowemu zarodkowi człowieka), pokazujący typowy wygląd zarodka w stadium rynienki nerwowej. Z fałdów nerwowych w odcinku głowowym wyodrębniła się już okolica przodomózgowia (F, prosencephalon). śródmózgowia (M, me-sencephalon) i tylomózgowia (H, rhombencephalon). (Dzięki uprzejmości Dr. K. K. Sulika z Zakładu Biologii Komórki i Anatomii Uniwersytetu Północnej Karoliny). A, 8 19 days — 19 dni, 20 days — 20 dni; Neural fold — fatd nerwowy; Cut edge of amnion — krawędź odciętej owodni; Neural plate — płytka nerwowi; Neural groove — rynienka nerwowa; Somite — somit; Primitive node — węzeł pierwotny. Primitive streak — smuga pierwotna

Ryć. 5-3. Schematy przedstawiające przekroje poprzeczne zarodków w kolejnych stadiach rozwoju, pokazujące powstawanie fałdów nerwowych, rynienki nerwowej i cewy nerwowej. Komórki grzebienia nerwowego, początkowo tworzące warstwę pośrednią pomiędzy cewą nerwową i powierzchniową ektodermą (C) wytwarzają korzenie rdzeniowe i zwoje czuciowe nerwów czaszkowych (D).
A Notochord — struna grzbietowa; Neural fold — fałd nerwowy; Neural crest — grzebień nerwowy; B Neural groove — rynienka nerwowa; C Surface ektoderm — ektodermą powierzchniowa: Neural tube — cewa nerwowa: Intermediate zone of neural crest — warstwa pośrednia utworzona przez grzebień nerwowy; D Dorsal root ganglion — zwój kręgowy
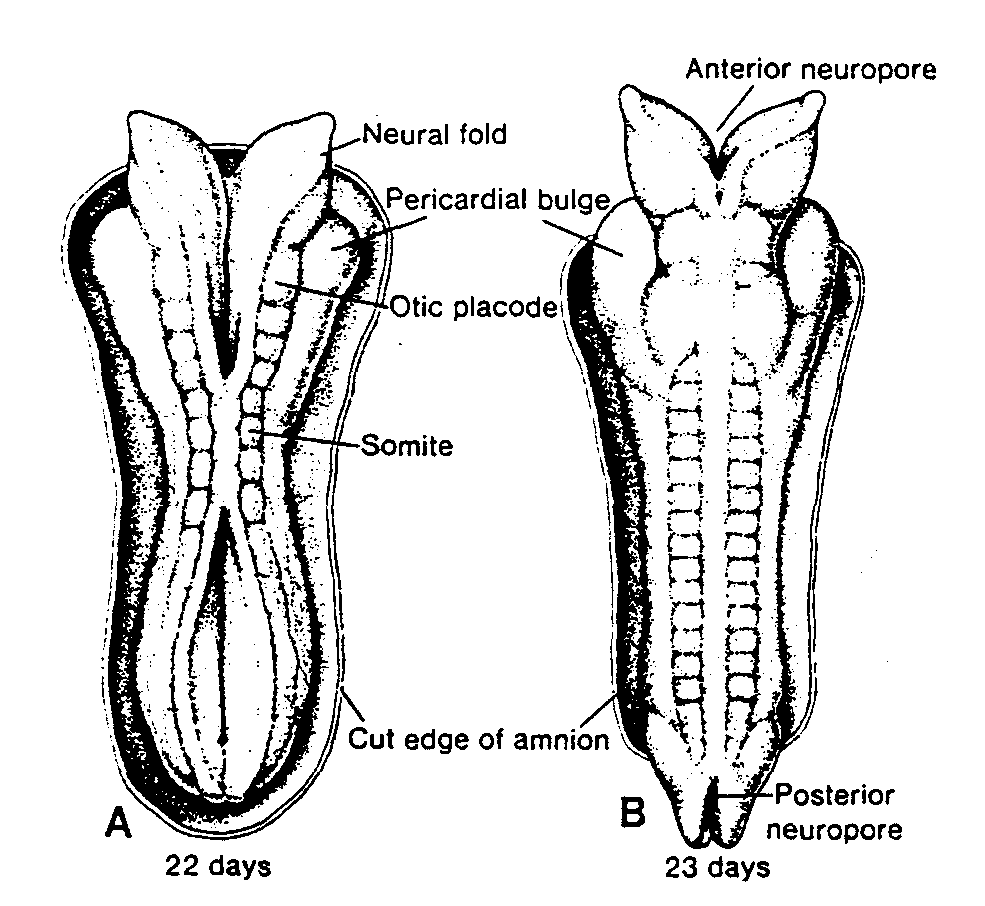
Ryć. 5-4. A, Zarodek ludzki w 22 dniu rozwoju widoczny od strony grzbietowej. (Zmodyfikowano wg Payne'go). Po każdej stronie cewy nerwowej widać siedem wyraźnie zaznaczonych somitów. B, Zarodek ludzki w 23 dniu rozwoju widoczny od strony grzbietowej. (Zmoo'vfikowano wg Cornera). Po obu stronach linii pośrodkowej w głowowej części zarodka widać wyniosłość serca.
A, B 22 days — 22 dni; Cut edge of amnion — krawędź odciętej owodni; Somite — somit; Otic placode — płyta (plakoda) uszna; Pericardial bulge — wyniosłość serca; Neural fold — fałd nerwowy; Anterior neuropore — otwór nerwowy przedni; Posterior neuropore — otwór nerwowy tylny; 23 days — 23 dni
Ryć. 5-5. Elektronogram z mikroskopu skenującego pokazujący od strony grzbietowej (A) i od strony brzusznej (B) zarodek myszy (odpowiadający wiekiem 22-dniowemu zarodkowi człowieka). A, Rynienka nerwowa zamyka się w kierunku dogłowowym i doogonowym, a na jej bocznej powierzchni widać pary somitów (S), B, Ten sam zarodek od strony brzusznej z widocznym formującym się jelitem pierwotnym z przednim i tylnym ujściem (groty strzałek), sercem (H) w jamie osierdzia C), i przegrodą poprzeczna (strzałka) stanowiącą zawiązek przepony (patrz Rozdział 11). Fałdy nerwowe pozostają rozwarte, co umożliwia dostrzeżenie regionu przodo- i śródmózgowia. (Dzięki uprzejmości Dr. K. K. Sulika z Zakładu Biologii Komórki i Anatomii Uniwersytetu Północnej Karoliny).
W miarę wznoszenia się i zlewania fałdów nerwowych komórki położone przy ich bocznych brzegach, czyli komórki neuroektodermalne zaczynają oddzielać się od fałdów. Komórki te wytwarzają grzebień nerwowy (crista neitralis) (ryć. 5-3) i będą przekształcać się w komórki nabłonkowe lub mezenchymatyczne opuszczając neuroektodermę i przemieszczając się do leżącej pod nią mezodermy. (Termin mezoderma odnosi się do komórek powstałych z epiblastu i do tkanki pozazarodkowej. Luźno zorganizowaną zarodkową tkankę łączną, niezależnie od jej pochodzenia, nazywa się mezenchymą). Komórki grzebienia nerwowego biorą udział w wytwarzaniu różnych struktur, w tym zwojów kręgowych (czuciowych) i zwojów autonomicznych oraz niektórych elementów zwojów, nerwów czaszkowych V, VII, IX i X. Powstają z nich także lemmocyty (komórki Schwanna), opona miękka i pajęczynówka, melanocyty, rdzeń nadnercza, kości i tkanka łączna struktur twarzoczaszki oraz komórki grzebieni pnia tętniczego i stożka, tętniczego w rozwijającym się sercu (patrz Rozdział 16).
Podczas zamykania się cewy nerwowej w okolicy głowowej zarodka uwidaczniają się dwa parzyste zgrubienia ektodermy, to jest płyta (plakoda) uszna (placoda otica) i płyta (plakoda) oczna (placoda optica) (ryć. 5-7B). W czasie dalszego rozwoju plakoda uszna wpukla się i tworzy pęcherzyk uszny (vesicula otica), z którego następnie rozwinie się narząd przedsionkowo-ślimakowy (patrz Rozdział 17).

Ryć. 5-6. Zdjęcie zarodka w stadium 12 - 13 somitów okolo 23 dnia rozwoju. Zarodek znajduje się w jamie owodni i jest połączony z kosmówką za pośrednictwem szypuły łączącej. Widać dobrze rozwinięte kosmki kosmówki. (Z pracy E. Blechschmidta: The Srages of Human Development before Birth. Philadelphia. W. B. Saunders, 1961. Dzięki uprzejmości E. Blechschmidta, profesora anatomii Uniwersytetu w Getyndze). Connecting stalk — szypuła łącząca; Amnion — owodnia; Villi — kosmki
Niemal w tym samym czasie pojawia się parzysta płyta soczewki. Płyta ta również się wpukla i w 5 tygodniu rozwoju wytworzy soczewkę (patrz Rozdział 18).
Uogólniając, można powiedzieć, że z ektodermalnego listka zarodkowego powstają te narządy i struktury, które służą do utrzymywania kontaktu ze światem zewnętrznym: (a) ośrodkowy układ nerwowy; (b) obwodowy układ nerwowy; (c) nabłonek zmysłowy ucha, nosa i oka i (d) naskórek, łącznie z włosami i paznokciami Ponadto powstają z niego gruczoły potowe i łojowe, gruczoł mlekowy, przysadka i szkliwo.
Tkanki i narządy pochodzące z mezodermalnego listka zarodkowego
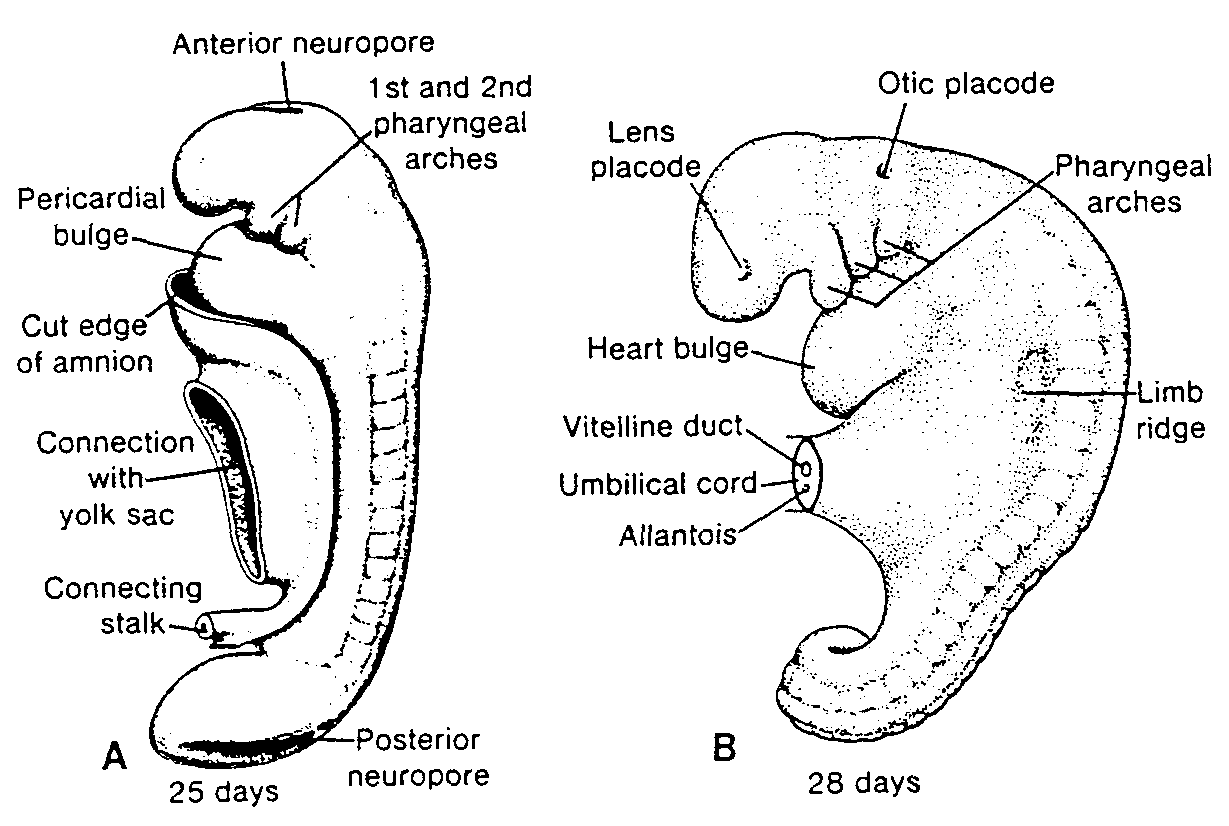
Komórki mezodermalnego listka zarodkowego tworzą początkowo cienką warstwę luźno ułożonej tkanki po obu stronach linii pośrodkowej ciała (ryć. 5-8A). Komórki umiejscowione w pobliżu tej linii zaczynają się intensywnie rozmnażać i tworzą zgrubiałą płytkę zwaną mezodermą przyosiową (mesoderma paraxiale) (ryc. 5 - 8 B). Od strony bocznej mezoderma, zwana tutaj mezoderma boczną, pozostaje w postaci cienkiej płytki. Następnie pomiędzy komórkami w mezodermie bocznej stopniowo pojawiają się szczeliny i po ich zlaniu się rozdziela się ona na dwie warstwy (ryć. 5-8B, C): (a) warstwę łączącą się z. mezoderma pokrywającą owodnię, zwaną mezoderma ścienną (mesoderma somaticus s. parietale) i (b)
Ryć. 5-7. A, Zarodek w stadium 14 somitów i w 25 dniu rozwoju, widoczny od strony bocznej. Widać wyniosłość serca oraz łuk gardłowy I i II (skrzelowy I i II). B, Schematyczny rysunek pokazujący od lewej strony zarodek w stadium 25 somitów, w 28 dniu rozwoju. Widać łuki gardłowe I, II i III oraz płytkę soczewki. (Zmodyfikowano wg G. L. Streetera: Developmental horizons in human embryos: age group XI, 13 - 20 somites, and age group XII, 21-29 somites. Contrib. Embryol. 30:211. 1942).
A 25 days — 25 di; Posterior neupore — otwór cewy nerwowej tylny; Ist and 2nd pharyngeal arcnes — łuk gardłowy liii; Anterior neuropore — otwór struny nerwowej przedni; Pericardial bulge — wyniosłość serca; Cut edge ot amnion — krawędź odciętej owodni; Connection with yolk sac — połączenie z pęcherzykiem żółtkowym; Connecting stalk — szypuła łącząca: B 28 days — 28 dni: Limb ridge — pączek kończyny; Otic placode — płyta uszna; Lens placode — płyta soczewki; Heart bulge — wyniosłość serca; Yitelline duet — przewód żółtkowy; Umbilical cord — pępowina; Allantois — omocznia
warstwę łączącą się z mezoderma pokrywająca pęcherzyk żółtkowy, zwaną mezodermą trzewną (mesoderma splanchnicum s. viscerale) (ryć. 5-8C, D i 5-9). Wspólnie obie te warstwy wyścielają nowo powstałą przestrzeń, zwana jamą ciała wewnątrzzarodkową (coeloma intraembryonicnm), łączącą się po obu stronach zarodka z jamą ciała zewnątrzzarodkową. Tkanka łącząca mezodermę przyosiową i mezodermę boczną nazywa się mezodermą pośrodkowa (mesoderma intermedium) (ryć. 5-8B, D i 5-9).
Na początku 3 tygodnia rozwoju mezoderma przyosiową zaczyna organizować się w segmenty. Pierwsze takie segmenty, zwane somitomerami, pojawiają się w okolicy głowowej zarodka, a następne tworzą się w kierunku doogonowym. Każdy somitomer składa się ze spiralnie ułożonych warstw komórek mezodermalnych. W okolicy głowowej somitomery powstają w powiązaniu z neuromerami wyodrębniającymi się z płytki nerwowej i są źródłem większości mezenchymy występującej w obrębie głowy (patrz Rozdział 16). W kierunku doogonowym od okolicy potylicznej somitomery przechodzą w somity (l, 2). Pierwsza para somitów powstaje w okolicy szyjnej zarodka około 20 dnia rozwoju. Począwszy od tego miejsca, w kierunku doogonowym pojawiają się nowe somity,. w przybliżeniu .my. dziennie, aż do końca 5 tygodnia, kiedy to jest ich w sumie 42-44 pary (ryć. 5-4, 5-5 i 5-7) (3). Ostatecznie powstają 4 pary somitów
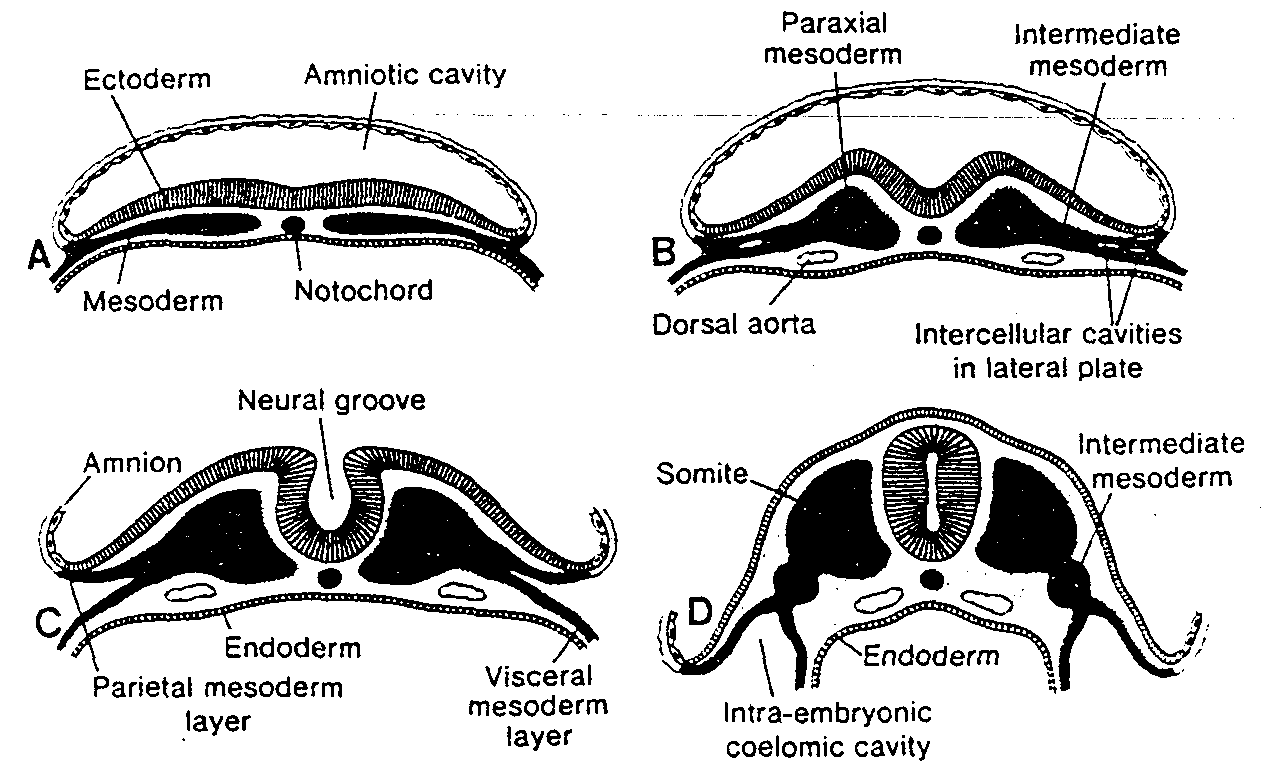
Ryć. 5-8. Przekroje poprzeczne pokazujące rozwój mezodermalnego listka zarodkowego. A, 17 dzień rozwoju. B, 19 dzień rozwoju. C, 20 dzień rozwoju. D, 21 dzień rozwoju. Z cienkiego płata mezodermalnego powstaje mezoderma przyosiową (przyszłe somity), mezoderma pośrodkowa (przyszłe jednostki wydzielnicze) i mezoderma boczna, rozdzielająca się na mezoderme ścienną i trzewną, wyścielające jamę ciała wewnątrzzarodkową.
A Ectoderm — ektoderma: Amniotic cavity — jama owodniowa; Notochord — struna grzbietowa: Mesoderm
— mezoderma; B Dorsal aorta — aorta grzbietowa; Intercellular cavities in lateral plate — międzykomórkowe jamki w mezodermie bocznej; Intermediate mesoderm — mezoderma pośrodkowa; Paraxial mesoderm
— mezoderma przyosiową; C Amnion — owodnia: Parietal mesoderm layer — mezoderma ścienna; Endoderm
— endoderma; Visceral mesoderm layer — mezoderma trzewną: Neural groove — rynienka nerwowa; D Somite — somit; Intraembryonic coelomic cavity — jama ciała wewnątrzzarodkowa: Intermediate mesoderm — mezoderma pośrodkowa
politycznych, 8 szyjnych, 12 piersiowych, 5 lędźwiowych i 8 do 10 ogonowych. Pierwsza para somitów potylicznych i ostatnie 5-7 par somitów ogonowych w późniejszym okresie zanikają, natomiast pozostałe wytwarzają, szkielet osiowy (patrz Rozdział 9). W tym okresie rozwoju wiek zarodka określa się, podając, jaką ma liczbę somitów. Tabela 5-1 zawiera zestawienie przybliżonego wieku zarodka z liczbą somitów (4, 5).
RÓŻNICOWANIE SOMITU
Na początku 4 tygodnia rozwoju komórki brzusznej i przyśrodkowej ściany somitu przestają ściśle przylegać do siebie i stają się wielokształtne i układają się wokół struny grzbietowej (ryć. 5-1 OB). Komórki te, tworzące wspólnie sklerotom, stanowią luźne utkanie, zwane mezenchymą. W przyszłości otoczą one rdzeń kręgowy i strunę grzbietową i uformują kręgosłup (patrz Rozdział 9).
Z grzbietowej ściany somitu, teraz określanej mianem dermomiotomu, powstaje nowa warstwa komórek (ryć. 5-10 C) zawierająca jasne jądra z silnie barwiącymi się jąderkami. Komórki te stanowią miotom. Każdy miotom wytwarza umięśnienie swojego segmentu (patrz Rozdział 10).
Komórki dermomiotomu po utworzeniu miotomu tracą cechy komórek nabłonkowych i rozprzestrzeniają się pod leżącą ponad nimi ektodermą

Ryć. 5-9. Przekroje poprzeczne przez region somitów zarodków myszy (odpowiadających wiekiem 21-dniowemu zarodkowi człowieka), widziane w mikroskopie skenującym. A. Przekrój przez somity szyjne. B, Przekrój przechodzący pomiędzy somitami bezpośrednio za tylomózgowiem. Gwiazdka — mezoderma pośrednia; So — mezoderma ścienna; Se — mezoderma trzewna: Ne — neuroektoderma: grot strzałki — kanał nerwowy; Ic
— jama ciała wewnątrzzarodkowa; strzałka — struna grzbietowa; En — endoderma; E — ektoderma. (Dzięki uprzejmości Dr. K. K. Sulika z Zakładu Biologii Komórki i Anatomii Uniwersytetu Północnej Karoliny).
(ryć. 5-10 D), wytwarzając skórę właściwą i tkankę podskórna (patrz Rozdział 19). W ten sposób z każdego somitu powstaje sklerotom (z którego rozwija się chrząstka i kość), miotom (tworzący mięśnie danego segmentu) i dermatom, będący źródłem komórek dla odpowiadającego mu segmentu skóry. Podobnie, jak to zostanie przedstawione dalej, każdy miotom i dermatom ma własny nerw segmentowy.
MEZODERMA POŚRODKOWA
Tkanka ta, łącząca przejściowo mezodermę przyosiową z mezoderma boczną (ryć. 5-8D i 5-9A), różnicuje się całkowicie odmiennie od somitów. W re-
Tabela 5-1.
Korelacja liczby somitów z przybliżonym wiekiem zarodka (w dniach)
Przybliżony wiek |
Liczba somitów |
Przybliżony wiek |
Liczba somitów |
Dni |
|
Dni |
|
20 |
1 - 4 |
25 |
17 - 20 |
21 |
4 - 7 |
26 |
20 - 23 |
22 |
7 - 10 |
27 |
23 - 26 |
23 |
10 - 13 |
28 |
26 - 29 |
24 |
13 - 17 |
30 |
34 - 35 |
Ryć. 5-10. Kolejne stadia rozwoju somitu. A, Komórki mezodermy układają się wokół małej jamki. B, Komórki brzusznej i przyśrodkowej ściany somitu przestają ściśle przylegać do siebie i wędrują w kierunku struny grzbietowej. Zbiór tych komórek nazywa się sklerotomem. C, Z grzbietowej ściany somitu powstaje nowe ugrupowanie komórek zwane miotomem. D, Po rozrośnięciu się miotomu w kierunku brzusznym komórki dermatomu tracą cechy komórek nabłonkowych i rozprzestrzeniają się pod leżącą nad nimi ektoderma, tworząc skórę właściwą.
A Neural groove — rynienka nerwowa; Central somite wali — ściana brzuszna somitu; Notochord — struna grzbietowa; B Sclerotome — sklerotom; Intraembryonic coelom — jama ciała wewnątrzzarodkowa; Dorsal aorta — aorta grzbietowa; Neural tube — cewa nerwowa; C Dermomyotome — dermomiotom; Myotome — miotom
gionie szyi i w górnym odcinku piersiowym powstają z niej, ułożone w segmenty, skupienia komórek (przyszłe nefrotomy), natomiast bardziej doogonowo mezoderma pośrodkowa tworzy tkankę niesegmentowaną, zwaną pasmem nerkotwórczym. Z tej częściowo segmentowanej i częściowo nie rozdzielonej na segmenty mezodermy rozwijają się elementy wydzielnicze układu moczowego (patrz ryć. 15-2).
MEZODERMA ŚCIENNA l MEZODERMA TRZEWNA
Mezoderma ta wyściela jamę ciała wewnątrzzarodkową (ryć. 5-8C, D 5-9, i 5-11 A). Mezoderma ścienna wraz z leżąca nad nią ektodermą wytworzy boczną i brzuszną ścianę tułowia. Z mezodermy trzewnej oraz z endodermy wewnątrzzarodkowej powstanie ściana_ przewodu pokarmowego (ryć. 5-11 B). Z komórek zwróconych ku powierzchni jamy ciała wytworzy się cienka błona surowicza wyścielająca jamę otrzewnej, jamę opłucnej i jamę osierdzia (ryć. 5-11B) (patrz Rozdział 11).
KREW l NACZYNIA KRWIONOŚNE
Na początku 3 tygodnia rozwoju komórki mezodermy trzewnej pokrywającej ścianę pęcherzyka żółtkowego różnicują się w komórki .krwiotwórcze i komórki naczyń krwionośnych. Te ostatnie, zwane angioblastami tworzą skupienia i pasma (wyspy naczyniotwórcze) stopniowo ulegające kanalizacji poprzez łączenie się szczelin międzykomórkowych (ryć. 5-12). Z komórek zlokalizowanych w środkowej części powstają następnie pierwotne komórki krwiotwórcze, natomiast komórki obwodowe spłaszczają się i wytwarzają komórki 
śródbłonka na obwodzie
Ryć. 5-11. A, Przekrój poprzeczny przechodzący przez okolicę śródnercza 21-dniowego zarodka. Widać mezodermę ścienną i mezodermę trzewną. jama ciała wewnątrzzarodkowa łączy się z jamą ciała pozazarodkową (jamą kosmówkową). B, Przekrój z końca 4 tygodnia rozwoju. Mezoderma ścienna i leżąca nad nią ektodermą tworzą brzuszną i boczną ścianę tułowia. Widać błonę surowiczą (otrzewną). A, B Parietal mesoderm layer — mezoderma ścienna; Endoderm of yolk sac — endoderma pęcherzyka żółtkowego; Intraembryonic coelom — jama ciała wewnątrzzarodkowa; Body wall — ściana tułowia; Mesonephros — śródnercze; Ectoderm — ektoderma; Dorsal mesentery — krezka grzbietowa; Visceral mesoderm layer — mezoderma trzewną; Serous membrane (peritoneum) — błona surowicza (otrzewna); Amniotic cavity — jama owodniowa
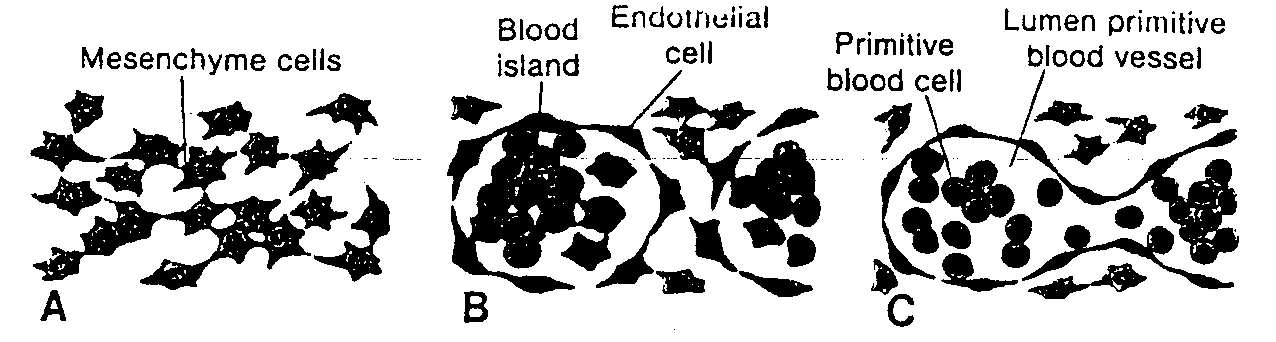
Ryć. 5-12. Kolejne stadia rozwoju naczyń krwionośnych. A, Niezróżnicowane komórki mezenchymatyczne. B, Powstawanie wysp krwiotwórczych. C, Pierwotne naczynie włosowate. Pokazane różnicowanie komórek mezenchymatycznych w pierwotne komórki krwiotwórcze i komórki śródbłonka.
A Mesenchyme cells — komórki mezenchymatyczne; B Blood island — wyspa krwiotwórcza; Endothelial cell — komórka śródbłonka; C Primitive blood cell — pierwotna komórka krwiotwórcza; Lumen primitive blood vessel — światło pierwotnego naczynia krwionośnego
wysp krwiotwórczych (ryć. 5-12B, C). Wyspy krwiotwórcze szybko zbliżają się do siebie dzięki pączkowaniu komórek śródbłonka i po zlaniu się wytwarzają małe naczynia krwionośne. W tym samym czasie w mezodermie pozazarodkowej kosmków palowych i w szypule łączącej rozwijają się komórki krwiotwórcze i naczynia włosowate (ryć. 5-13). Naczynia rozrastają się wskutek pączkowania, pozazarodkowe naczynia krwionośne zlewają się z naczyniami wewnątrz zarodka i w ten sposób łączą go z łożyskiem.
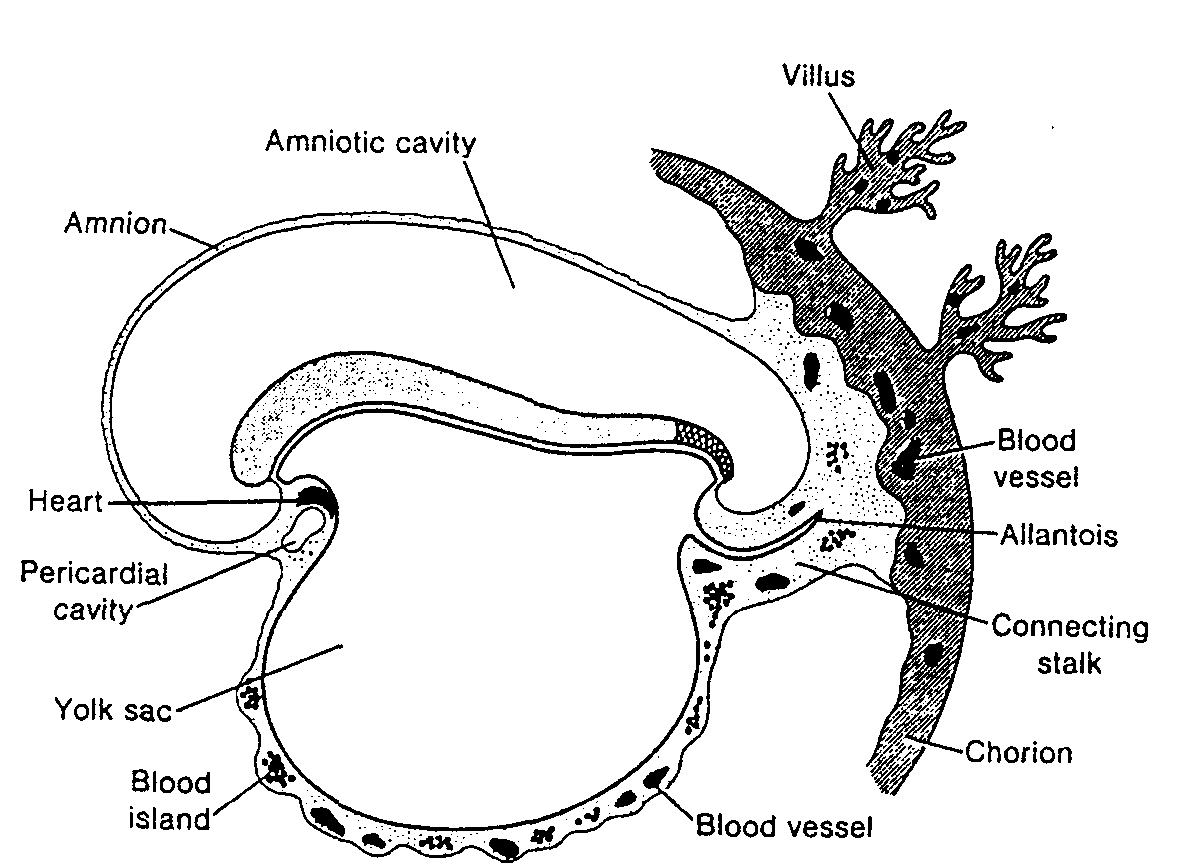
Ryć. 5-13. Wytwarzanie pozazarodkowych naczyń krwionośnych w kosmkach, kosmówce, szypule łączącej i w ścianie pęcherzyka żółtkowego u zarodka w stadium przedsomitarnym w wieku około 19 dni.
Amniotic cavity — jama owodniowa; Amnion — owodnia; Heart — serce; Pericardial cavity — jama osierdzia; Yolk sac — pęcherzyk żółtkowy; JBIood island — wyspa krwiotwórcza; Blood vessel — naczynie krwionośne; Chorion — kosmówka; Connecting stalk — szypula lecząca; Allantois — omocznia; Villus — kosmek
Wewnątrzzarodkowe komórki krwiotwórcze i naczynia krwionośne, łącznie z cewą sercowa powstają dokładnie w ten sam sposób co naczynia pozazarodkowe (patrz Rozdział 12).
W sumie, następujące tkanki i narządy- pochodzą z me2odermy:-(«) tkanki podporowe, to znaczy tkanka łączna wraz z chrząstką i kością; (b) mięśnie gładkie i mięśnie poprzecznie prążkowane; (c) komórki krwi i limfy oraz ściana serca, naczyń krwionośnych i naczyń limfatycznych; (d) nerki i gonady wraz z należącymi do nich przewodami; (e) kora nadnercza i (/) śledziona.
Tkanki i narządy powstające z endodermalnego listka zarodkowego
Główną strukturą wywodzącą się z endodermalnego listka zarodkowego jest przewód pokarmowy. Jego formowanie w znacznej mierze związane jest z powstawaniem fałdów zarodka \v kierunku głowowo-ogonowym oraz bocznym. Powstawanie fałdów w pierwszym kierunku jest spowodowane głównie szybkim wydłużaniem się ośrodkowego układu nerwowego, natomiast utworzenie fałdów bocznych ciała zależy od pojawienia się gwałtownie rosnących somitów. Dlatego też powstawanie jelita, mającego w przybliżeniu kształt cewy, stanowi bierny proces polegający na włączeniu części wysłanego endodermą pęcherzyka żółtkowego w obręb jamy ciała. Dodatkowym efektem powstawania fałdów jest zwężenie początkowo szerokiego połączenia pomiędzy zarodkiem i pęcherzykiem żółtkowym (odsznurowanie) i powstanie wąskiego, długiego przewodu, zwanego przewodem żółtkowym (ductus vitellinus).
Początkowo endodermalny listek zarodkowy ma kształt płaskiego krążka, stanowiącego sklepienie pęcherzyka żółtkowego i ściśle przylegającego do ektodermy (ryć. 5-14A). W miarę formowania się i wzrostu pęcherzyków mózgowia tarcza zarodkowa zaczyna uwypuklać się do jamy owodniowej i wytwarzać fałdy w kierunku głowowo-ogonowym. Najintensywniejsze wytwarzanie fałdów występuje w okolicy głowy i ogona, a w jego wyniku powstaje fałd głowowy i fałd ogonowy (ryć. 5-14).
W rezultacie wytwarzania fałdów w kierunku głowowo-ogonowym coraz większa część wysłanej endodermą jamy pęcherzyka żółtkowego włączana jest w obręb ciała zarodka (ryć. 5-14C). W przedniej części zarodka endodermą tworzy jelito przednie (proenteron), a w tylnej jelito tylne (metenteron). Odcinek pomiędzy jelitem przednim i tylnym nazywa się jelitem środkowym (mesenteron). Łączy się ono przez pewien okres z pęcherzykiem żółtkowym za pośrednictwem szerokiej szypuły, zwanej przewodem pępkowo-jelitowym (ductus omphalomesentericus) lub przewodem żółtkowym (ductus vitellinus) (ryć. 5-14D). Przewód ten, początkowo szeroki, w miarę dalszego wzrostu zarodka zwęża się i znacznie wydłuża (patrz ryć. 5-19).
Jelito, przednie w swym końcu dogłowowym jest przejściowo zamknięte przez płytkę przedstrunową, zwaną na tym etapie rozwoju błoną gębowo-gardłową lub ustno-gardłową (membrana stomatopharyngealiś) (ryć. 5-14A, C). W końcu 3 tygodnia błona ta ulega przerwaniu i w ten sposób powstaje połączenie pomiędzy jelitem pierwotnym i jamą owodniową (ryć. 5-14D). Jelito tylne również jest przejściowo zamknięte przez błonę zwaną błoną stekową (membrana cloacalis) (ryć. 5-14C).
Ryć. 5-14. Przekroje przez zarodki w różnym okresie rozwoju w płaszczyźnie strzałkowej w linii pośrodkowej pokazujące zgięcie zarodka w kierunku głowowo-ogonowym i jego wpływ na pozycję wysianej endodermą jamy. A, Zarodek w stadium przedsomitarnym; B, Zarodek w stadium 7 somitów; C, Zarodek w stadium 14 somitów; D, zarodek w końcu 1 miesiąca rozwoju. Widać umiejscowienie wyspy naczyniotwórczej w pobliżu płytki przedstrunowej (błony gębowo-gardlowej).
A Ectoderm — ektoderma; Angiogenetic celi cluster — wyspa naczyniotwórcza; Prochordal plate — płytka przedstrunową; Endoderrfl — endodermą; Cloacal membranę — błona stekową; Allantois — omocznia; Connecting stalk — szypuła łącząca; Amnrotic cavity — jama owodniową; B Foregut — jelito przednie; Pericardial cavity — jama osierdzia; Heart tube — cewa sercowa; Hindgut — jelito tylne; C Buccopharyngeal membrane — błona gebowo-gardłowa; D Rests of the bucco-phiryngeal membrane — resztki błony gębowo-gardlowej; Vitelline duet — przewód żółtkowy; Yolk sac — pęcherzyk żółtkowy; Midgut — jelito środkowe; Liver bud — pączek wątrobowy; Lung bud — pączek płucny

Ryć. 5-15. Schematy przekrojów poprzecznych przez zarodki w różnych okresach rozwoju, pokazujące wpływ powstawania fałdów bocznych ciała na formowanie wysianej endodermą jamy. B, Przekrój poprzeczny na poziomie jelita środkowego, pokazujący połączenie pomiędzy jelitem i pęcherzykiem żółtkowym. C, Przekrój przechodzący nieco poniżej jelita środkowego, na którym widać zamkniętą przednią ścianę jamy brzuszne] i jelito zawieszone na krezce odchodzącej od tylnej ściany jamy brzusznej.
Yolk sac — pęcherzyk żółtkowy; Connection betwen gul and yolk sac — poleczenie pomiędzy jelitem i pęcherzykiem żółtkowym; Intraembryooic coelomic cavity — jama ciała wewnątrzzarodkowa; Gut — jelito: Surface ectoderm — ektoderma powierzchniowa; Amniotic cavity — jama owodniowa
W wyniku szybkiego powiększania się somitów początkowo płaska tarcza zarodkowa zaczyna wytwarzać boczne fałdy ciała i zarodek zaokrągla się (ryć. 5-15). Jednocześnie formuje się przednia ściana tułowia z wyjątkiem małej części w okolicy brzusznej, w miejscu występowania szypuły pęcherzyka żółtkowego.
Podczas formowania się jelita przedniego i jelita tylnego, zachodzącego głównie w wyniku utworzenia, odpowiednio, fałdu głowowego i fałdu ogonowego, jelito środkowe pozostaje połączone z pęcherzykiem żółtkowym. Początkowo połączenie to jest szerokie (ryć. 5-15A), ale w rezultacie wytwarzania fałdów bocznych ciała stopniowo wydłuża się i zwęża (odsznurowuje się), przechodząc w przewód żółtkowy (ryć. 5-15B i 5-16). Dopiero znacznie później, po zarośnięciu przewodu żółtkowego, jelito środkowe traci połączenie z jamą ciała zewnątrzzarodkową, wysianą pierwotna endodermą i leży swobodnie w jamie brzusznej (ryć. 5-15C).
Innym ważnym skutkiem fałdowania zarodka w kierunku głowowo-ogonowym i bocznym jest częściowe włączenie omoczni w obręb zarodka i przekształcenie jej w stek (cloaca) (ryć. 5-16A). Dystalna część omoczni pozostaje w szypule łączącej. W 5 tygodniu rozwoju szypuła pęcherzyka żółtkowego i szypuła łącząca zlewają się, tworząc sznur pępowiny (ryć. 5-16 i 7-9).
Pęcherzyk żółtkowy u człowieka jest narządem szczątkowym i prawdopodobnie odgrywa rolę w odżywianiu zarodka tylko we wczesnyrn okresie rozwoju. Od 2 miesiąca rozwoju znajduje się w jamie owodniowej (patrz ryć. 5-20 i 7-3).
W ten sposób endoderrnalny listek zarodkowy początkowo tworzy wyś-ciółkę jelita pierwotnego oraz wewnątrzzarodkowej części omoczni i przewodu
Ryć. 5-16. Schematy przekrojów zarodków w różnych stadiach rozwoju w płaszczyźnie strzałkowej pokazujące tkanki i narządy pochodzące z endodermalnego listka zarodkowego. Są to: kieszonki gardłowe, nabłonkowe wysianie pączków płucnych i tchawicy, wątroba, pęcherzyk żółciowy i trzustka. Pęcherz moczowy powstaje ze steku i w tym stadium rozwoju ma drożne połączenie z omocznią. A Stomodeum — zatoka gębowa; Livęr — wątroba; Gall bladder — pęcherzyk żółciowy; Vitelline duet — przewód żółtkowy; Allantois — omocznia; Cloaca — stek; Hindgut — jelito tylne; Primiliye inleslinal loop — pierwotna pętla jelitowa; Pancreas — trzustka; Stomach — żołądek; Luny bud — pą< zek płucny; Pharyngeal gut — gardło; B Heart bulge — wyniosłość serca; Urinary bladder — pęcherz moczowy; Cloacal membrane — błona stekowa; Pharyngeal pouches — kieszonki gardłowe
żółtkowego (ryć. 5-16A, B). W czasie dalszego rozwoju powstaje z niej (u) nabłonkowe wysłanie dróg oddechowych; (b) miąższ tarczycy, gruczołów przytarczycznych, wątroby i trzustki (patrz Rozdział 14 i 16); (c) część zrębu migdałków i grasicy; (d) nabłonek wyścielający pęcherz moczowy i cewkę moczową (patrz Rozdział 15) i (e) nabłonek wyścielający jamę bębenkową i trąbkę słuchową (patrz Rozdział 17).
Zewnętrzny wygląd zarodka w drugim miesiącu rozwoju
W końcu 4 tygodnia rozwoju, gdy zarodek ma około 28 somitów, głównymi jego cechami zewnętrznymi są somity i tuki gardłowe (skrzelowe) (ryć. 5-17). Dlatego też wiek zarodka przeważnie wyraża się za pomocą liczby somitów (tab. 5-1). Ponieważ liczenie somitów podczas 2 miesiąca rozwoju jest trudne, za wskaźnik wieku zarodka przyjmuje się wówczas długość ciemieniowo-siedzeniową* (ang. crown-rump, CR) wyrażaną w milimetrach (tab. 5-2).
* Polskie terminy określające długość zarodka podano zgodnie z mianownictwem antropologicznym (przyp. tłum.)

Ryć. 5-17. A, Widok z boku zarodka ludzkiego w stadium 28 somitów. Głównymi cechami zewnętrznymi są łuki gardłowe i somity. Widać również wyniosłość serca i wyniosłość wątrobową, natomiast nie widać pączków kończyn. B, Zdjęcie tego samego zarodka wykonane pod innym kątem w celu pokazania rozmiarów pęcherzyka żółtkowego. (Z pracy C. L. Streetera: Developmental horizons in human embryos: age groups XV XVI, XVII i XVIII The third issue ot a siuvey ot the Carnegie Collection). Contrib. Embryol 32:133,1948. Dzięki uprzejmości Carnegie Institution ot Washington).
Długość ciemieniowo-siedzeniową mierzy się od szczytu (vertex) głowy do punktu środkowego pomiędzy wierzchołkami pośladków. Ze względu jednak na znaczna, zmienność stopnia zgięcia ciała u różnych zarodków oczywiste jest, że pomiary podane w tabeli 5-2 tylko w przybliżeniu określają rzeczywisty wiek zarodka.
W 2 miesiącu rozwoju zewnętrzny wygląd zarodka bardzo się zmienia ze względu na znaczne powiększenie wymiarów głowy i uformowanie się kończyn, twarzy, uszu, nosa i oczu. Na początku 5 tygodnia kończyny górne i dolne maja postać płetwopodobnych pączków (ryć. 5-18). Zawiązki kończyn górnych występują grzbietowo od wyniosłości serca na poziomie od czwartego kręgu szyjnego do pierwszego piersiowego, co tłumaczy dlaczego uzyskują unerwienie ze splotu ramiennego. Pączki kończyn dolnych pojawiają się nieco później, tuż za przyczepem szypuły łączącej, w kierunku doogonowym, na poziomie somitów lędźwiowych i górnych krzyżowych. W miarę dalszego wzrostu końcowe odcinki pączków spłaszczają się i oddzielają pierścieniowym przewężeniem od bliższego.
Tabela 5-2.
Korelacja wymiaru ciemieniowo-siedzeniowego z przybliżonym wiekiem zarodka
(w tygodniach)
Wymiar ciemieniowo-siedzeniowy |
Przybliżony wiek |
Wymiar ciemieniowo-siedzeniowy |
Przybliżony wiek |
mm |
tygodnie |
mm |
tygodnie |
5-8 |
5 |
17-22 |
7 |
10-14 |
6 |
28-30 |
8 |
Ryć. 5-18. Zdjęcie ludzkiego zarodka (długości 9,8 mm, w 5 tygodniu rozwoju) (pow. x 29,9). Zwraca uwagę płetwowaty wygląd kończyn górnych. (Z pracy E. Blechschmidta: The Stages ot Human Development before Birth. Philadelphia, W. B. Saunders, 1961. Dzięki uprzejmości E. Blechschmidta, profesora anatomii Uniwersytetu w Getyndze).
bardziej walcowatego segmentu (ryć. 5-19). Następnie w dalszej części pączków pojawiają się cztery promieniście ułożone bruzdy rozdzielające pączek na pięć nieco zgrubiałych części i zapoczątkowujące wyodrębnianie się palców.

Wspomniane powyżej bruzdy, zwane promieniami, najpierw pojawiają się w obrębie dłoni i wkrótce potem w obrębie stopy, co ponownie wskazuje na szybszy rozwój kończyny górnej niż dolnej. W czasie formowania się palców u rąk i stóp (ryć. 5-20) pojawia się drugie przewężenie rozdzielające bliższą część pączków na dwa segmenty. Od tego czasu można rozpoznać trzy odcinki charakterystyczne dla kończyn dorosłego osobnika (ryć. 5-21).
Jak wynika z przedstawionych informacji, wszystkie główne narządy i układy narządów powstają pomiędzy 4 i 8 tygodniem rozwoju. Z tego względu okres ten nazywa się również okresem organogenezy. W tym czasie zarodek jest najbardziej wrażliwy na oddziaływanie czynników zakłócających rozwój i dlatego większość
Ryć. 5-19. Zdjęcie ludzkiego zarodka (długość ciemieniowo-siedzeniowa 13 mm, 6 tydzień rozwoju). W jamie kosmówkowej widać pęcherzyk żółtkowy. (Z pracy E. Blechschmidta: JVie Stages ol Human Development before Birth. Philadelphia, W. B. Saunders, 1961. Dzięki uprzejmości E. Blechsmidta, profesora anatomii Uniwersytetu w Getyndze).
Amnion — owodnia; Chorionic villi — kosmki kosmówki; Chorionic plate — blaszka kosmówki; Umbiltcal cord — sznur pępowiny; Yolk sac — pęcherzyk żółtkowy
wrodzonych zniekształceń spotykanych po urodzeniu bierze początek w tym krytycznym okresie. Zaznajomienie się z głównymi procesami organogenezy znacznie pomaga w identyfikowaniu okresu powstania poszczególnych nieprawidłowości rozwoju. Na przykład w przypadku dziecka z brakiem mózgowia (anencephalia) można szybko ustalić, że powstanie tej wady zostało zapoczątkowane w 23-25 dniu rozwoju. Podobnie u dziecka urodzonego bez kończyn (amelia) czynnik wywołujący musiał zadziałać na zawiązki kończyn w 5 tygodniu rozwoju. (Patrz rysunkowe zestawienia na początku i końcu tego podręcznika).

Ryć. 5-20. Zdjęcie ludzkiego zarodka (długość ciemieniowo-siedzeniowa 21 mm, 7 tydzień rozwoju) (pow. x 4). Worek kosmówkowy szeroko rozwarty w celu ukazania zarodka położonego w jamie owodniowej. Wyraźnie widać pęcherzyk żółtkowy, sznur pępowiny i naczynia krwionośne w blaszce kosmówki, wchodzącej w skład łożyska. Zwracają uwagę niezwykle duże rozmiary głowy w porównaniu z pozostałymi częściami ciała. (Z podręcznika W. J. Hamiltona i H. W. Mossmana: Humin Emnryology. Baltimore, Williams & Wilkins, 1972).
Yolk sac — pęcherzyk żółtkowy: Chorionic cavity — jama kosmówkowa; Amnion — owodnia; Umbilical cord — sznur pępowiny
STRESZCZENIE
Okres zarodkowy trwa od 3 do 8 tygodnia rozwoju. Jest to okres, w którym ze wszystkich trzech listków zarodkowych rozwijają się typowe dla nich tkanki i narządy. W wyniku powstania narządów zostają uformowane główne elementy budowy ciała (tab. 5-3).
Z ektodermalnego listka zarodkowego powstają te narządy i struktury, które umożliwiają kontakt ze światem zewnętrznym: (a) ośrodkowy układ nerwowy; (b) obwodowy układ nerwowy; (c) zmysłowy nabłonek uszu, nosa i oczu; (d) naskórek, łącznie z włosami i paznokciami; (e) z ektodermy wywodzi się także

Ryć. 5-21. Zdjęcie ludzkiego zarodka (długość ciemieniowo-siedzeniowa 25 mm. 7-8 tydzień rozwoju) Otwarta jama kosmówkowa i jama owodniowa. Widać duże rozmiary głowy, oko, małżowinę, dobrze ukształtowane palce nóg, uwypuklenie w pępowinie spowodowane przez pętle jelitowe oraz pęcherzyk żółtkowy w jamie kosmówkowej. Z podręcznika D. Starcka: Embryologie. Stuttgart, Ceorg Thieme Verlag, 1965 Dzięki uprzejmości Dietricha Starcka, profesora anatomii z Uniwersytetu we Frankfurcie n. Menem.
przysadka, gruczoł mlekowy oraz gruczoły potowe i szkliwo. Każdy z tych układów będzie omówiony w oddzielnym rozdziale.
Z mezodermalnego listka zarodkowego powstaje mezoderma przyosiowa, mezoderma pośrodkowa i mezoderma boczna. Mezoderma przyosiowa tworzy somitomery, z których powstanie większa część mezenchymy głowy oraz somity. Z somitów wyodrębniają się miotomy (tkanka mięśniowa), sklerotomy (chrząstka i kość) oraz dermatomy (skóra właściwa i tkanka podskórna), stanowiące wspólnie tkanki podporowe organizmu. Z mezodermy powstaje także układ naczyniowy, to znaczy serce, tętnice, żyły, naczynia limfatyczne oraz wszystkie rodzaje komórek krwi i limfy. Ponadto z mezodermy rozwija się układ moczowo-płciowy — nerki, gonady i ich przewody (ale nie pęcherz moczowy). Wreszcie pochodzenie mezodermalne mają nadnercza i śledziona.
Z endodermalnego listka zarodkowego rozwija się nabłonek wyścielający przewód pokarmowy, drzewo oddechowe i pęcherz moczowy oraz miąższ tarczycy, gruczołów przytarczycznych, wątroby i trzustki. Ponadto pochodzenie endodermalne ma nabłonek jamy bębenkowej i trąbki słuchowej.
Kształt ciała. W wyniku utworzenia narządów i szybkiego wzrostu ośrodkowego układu nerwowego początkowo płaska tarcza zarodkowa wytwarza fałdy w kierunku głowowo-ogonowym, co prowadzi do powstania fałdu głowowego i fałdu ogonowego. Powstają również fałdy tarczy w kierunku poprzecznym, co powoduje zaokrąglenia ciała zarodka. Połączenie zarodka z pęcherzykiem żółtkowym utrzymuje się za pośrednictwem przewodu żółtkowego, a z łożyskiem przez sznur pępowiny.
Tabela 5-3.
Zestawienie kluczowych procesów zachodzących w okresie zarodkowym
Dni |
Somity |
Długość mm |
Rycina |
Cechy charakterystyczne |
14-15 |
0 |
0,2 |
5-1A |
Pojawienie się smugi pierwotnej |
16-18 |
0 |
0,4 |
5-1B |
Pojawienie się wyrostka struny grzbietowej i komórek krwiotwórczych w ścianie pęcherzyka żółtkowego |
19-20 |
0 |
1 - 2,0 |
5-2A |
Mezoderma wewnątrzzarodkowa rozprzestrzenia się pod całą ektodermą; smuga pierwotna jest całkowicie ukształtowana, zaczynają się tworzyć naczynia pępkowe i fałdy nerwowe |
20-21 |
1-4 |
2,0 - 3,0 |
5-2B,C |
Pogłębienie brzegów fałdów nerwowych, utworzenie głębokiej rynienki nerwowej, początek zginania się zarodka |
22-23 |
5-12 |
3,0 - 3,5 |
5-4A,B 5-5, 5-6 |
Zaczyna się łączenie brzegów fałdów nerwowych w odcinku szyjnym; szeroko otwiera się przedni i tylny otwór cewy nerwowej, łuki gardłowe 1 i II, początek zginania się cewy sercowej |
24-25 |
13-20 |
3,0-4,5 |
5-7 A |
Trwa wytwarzanie fałdów — głowowego i ogonowego, zamyka się lub zamknął się przedni otwór cewy nerwowej, powstał pęcherzyk oczny, pojawiła się płyta uszna |
26-27 |
21-29 |
3,5-5,0 |
5-7B 5-17A, B |
Zamyka się lub zamknął się przedni otwór cewy nerwowej, pojawił się pączek kończyny górnej, obecne 3 pary łuków gardłowych |
28-30 |
30-35 |
4,0-6,0 |
5-7B |
Tworzy się łuk gardłowy IV, pojawiają się pączki kończyn dolnych, obecny pęcherzyk uszny i płyta soczewki |
31-35 |
— |
7,0-10,0 |
5-18 |
Kończyny przednie płetwopodobne, powstały dołki nosowe, zarodek ma kształt litery C |
36-42 |
— |
9,0-14,0 |
5-19 |
W płytce dłoni i stopy obecne promienie palczaste, wyraźne pęcherzyki mózgowia, ze wzgórków usznych powstaje małżowina, tworzenie się przepukliny pępkowej |
43-49 |
— |
13,0-22,0 |
5-20 16-18 |
Widoczny barwnik siatkówki, rozdzielanie się promieni palczastych, utworzenie brodawek sutkowych i powiek; wyniosłości szczękowe łączą się z wyniosłościami nosowymi środkowymi podczas formowania górnej wargi; wydatna przepuklina pępkowa |
50-56 |
— |
21,0-31,0 |
5-21 |
Kończyny zgięte w łokciach i w kolanach; swobodne palce rąk i stóp, twarz przybiera ludzki wyraz; ogon znika; przepuklina pępkowa utrzymuje się do końca 3 miesiąca |
Rozdział 6
OKRES PŁODOWY
(OD TRZECIEGO MIESIĄCA CIĄŻY DO URODZENIA)
Rozwój płodu
Okres od początku 3 miesiąca ciąży do końca życia wewnątrzmacicznego nazywa się okresem płodowym (tempus fetale). Cechuje go różnicowanie tkanek i narządów oraz szybki wzrost całego organizmu (l). W okresie tym albo już nie powstają, albo powstają tylko nieliczne wady rozwojowe, niemniej jednak obumieranie komórek w ośrodkowym układzie nerwowym spowodowane czynnikami cytotoksycznymi może doprowadzić do zaburzeń w jego czynności w życiu pozapłodowym.
Długość płodu zazwyczaj przedstawia się za pomocą długości ciemieniowo-siedzeniowej (ang. crown-rump, CR) (pozycja siedząca) lub długości całkowitej (ang. crown-heel, CH), mierzonej od szczytu czaszki (vertex) do pięty (pozycja stojąca). Wymiary te, podane w centymetrach, koreluje się z wiekiem płodu wyrażonym w dniach lub miesiącach księżycowych (tab. 6-1). Przyrost długości płodu jest szczególnie wyraźny w 3, 4 i 5 miesiącu, a przyrost masy ciała podczas ostatnich dwóch miesięcy ciąży. Ogólnie uważa się że ciąża trwa 280 dni lub 40 tygodni od początku ostatniej miesiączki lub bardziej precyzyjnie, 266 dni lub 38 tygodni od zapłodnienia. Przy omawianiu dalszych etapów rozwoju wiek płodu będzie obliczany od dnia zapłodnienia i podawany w tygodniach lub miesiącach kalendarzowych.
Tabela 6-1.
Przyrost długości i wagi płodu w okresie płodowym
Wiek |
Długość ciemieniowo-siedzeniowa |
Waga |
|
tygodnie |
miesiące księżycowe |
cm |
g |
9-12 |
3 |
5-8 |
10-45 |
13-16 |
4 |
9-14 |
60-200 |
17-20 |
5 |
15-19 |
250-450 |
21-24 |
6 |
20-23 |
500-820 |
25-28 |
7 |
24-27 |
900-1300 |
29-32 |
8 |
28-30 |
1400-2100 |
33-36 |
9 |
31-34 |
2200-2900 |
37-40 |
10 |
35-36 |
3000-3400 |
Zmiany w budowie płodu w poszczególnych miesiącach okresu płodowego
Jedną z najbardziej uderzających zmian w okresie płodowym jest względne spowolnienie wzrostu głowy w porównaniu z resztą ciała. Na początku 3 miesiąca ciąży głowa zajmuje w przybliżeniu połowę długości ciemieniowo-siedzeniowej (ryć. 6-1). Na początku 5 miesiąca długość głowy wynosi około jednej trzeciej, a w momencie urodzenia około jednej czwartej długości ciemieniowo-siedzeniowej (ryć. 6-2). Jak z tego wynika, wzrost ciała ulega przyspieszeniu, natomiast wzrost głowy — spowolnieniu.
Podczas 3 miesiąca twarz płodu nabiera bardziej ludzkich cech (ryć. 6-3 i 6-4). Oczy, początkowo skierowane w bok, znajdują się teraz na przedniej powierzchni twarzy, a uszy na powierzchniach bocznych głowy, w pobliżu miejsc, które zajmą po zakończeniu rozwoju (ryć. 6-3). Kończyny osiągają długość proporcjonalną w stosunku do reszty ciała, chociaż dolne kończyny są jeszcze nieco krótsze i w mniejszym stopniu uformowane niż górne. Zewnętrzne narządy płciowe rozwijają się do tego stopnia, że już od 12 tygodnia ciąży można

Ryć. 6-1. Zdjęcie 9-tygodniowego płodu. Zwracają uwagę duże rozmiary głowy w porównaniu z resztą ciała. W jamie kosmówkowej widać pęcherzyk żółtkowy i bardzo długą szypułę pęcherzyka żółtkowego. W sznurze pępowinowym znajdują się jeszcze pętle jelitowe. Po jednej stronie kosmówki widać liczne kosmki (kosmówka kosmata — chorion frongiosum), natomiast druga strona jest prawie zupełnie gładka (kosmówka gładka — chorion laeve).
Chorion frongiosum — kosmówka kosmata; Chorion laeve — kosmówka gładka; Intestinal loops in umbilical cord — pętle jelitowe w sznurze pępowinowym; Yolk sac stalk — szypuła pęcherzyka żółtkowego; Yolk sac — pęcherzyk żółtkowy
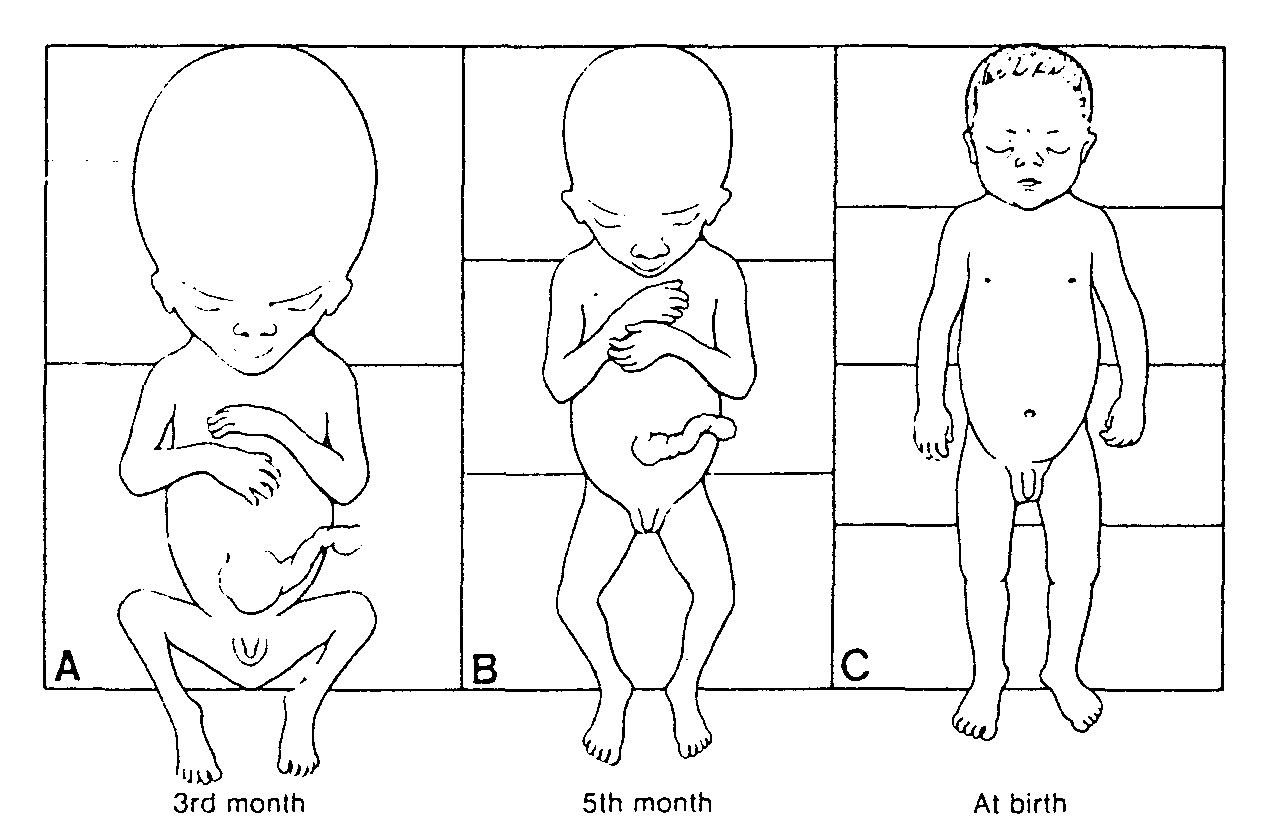
Ryć. 6-2. Schematyczne rysunki pokazują wielkość głowy w stosunku do reszty ciała w różnych stadiach rozwoju.
3rd month — 3 miesiąc; 5th month — 5 miesiąc; At birth — w okresie urodzeniowym
określić pleć płodu na podstawie oględzin zewnętrznych. Pętle jelitowe początkowo powodują duże rozszerzenie pępowiny, ale w 11 tygodniu cofają się do jamy brzusznej.
U poronionych płodów z końca 3 miesiąca ciąży można wywołać reakcje odruchowe wskazujące na aktywność mięśni (2). Ruchy te są jednak zbyt słabe, aby matka mogła je zauważyć.
Podczas 4 i 5 miesiąca ciąży długość płodu szybko wzrasta (ryć. 6-5), tak że w końcu pierwszej połowy życia, wewnątrzmacicznego długość szczytowo-siedzeniowa wynosi 15 cm, to jest około połowy długości noworodka. Natomiast waga płodu wzrasta w tym okresie tylko nieznacznie i w końcu 5 miesiąca nie osiąga jeszcze 500 g.
Płód jest pokryty delikatnymi włosami, zwanymi meszkiem (lanugo), oraz ma brwi i włosy na głowie. Zazwyczaj w 5 miesiącu ciąży matka wyraźnie czuje ruchy płodu.
W drugiej połowie życia wewnątrzmacicznego znacznie wzrasta waga płodu, szczególnie w okresie ostatnich 2,5 miesięcy, kiedy płód zwiększa swą wagę o około 50% wagi donoszonego płodu (w przybliżeniu 3200 g). W 6 miesiącu ciąży płód ma czerwonawą i pomarszczoną skórę ze względu na brak tkanki podskórnej. Płód urodzony w 6 miesiącu lub w pierwszej połowie 7 miesiąca jest bardzo trudno utrzymać przy życiu. Niektóre narządy takich płodów są co prawda zdolne do podjęcia czynności, ale ich układ oddechowy i ośrodkowy układ nerwowy nie są wystarczająco dojrzałe i nie współdziałają we właściwy sposób.

Ryć. 6-5. Zdjęcie 18-tygodniowego płodu połączonego sznurem pępowinowym z łożyskiem. Płód ma cienka, skórę, ze względu na brak tkanki tłuszczowej podskórnej. Widać również liścienie łożyska i owodnię.
Maternal side of placenia with cotyledons — matczyna powierzchnia łożyska z liścieniami; Amnion — owodnia
Określanie czasu porodu
Datę porodu najdokładniej określa się podając, że następuje on w 266 dni lub w 38 tygodni po zapłodnieniu. Owocyt na ogół zostaje zapłodniony w ciągu 12 godzin po owulacji, a stosunek płciowy musiał nastąpić w okresie 24 godzin przed zapłodnieniem. Ciężarna kobieta na ogół udaje się do ginekologa po niewystąpieniu dwóch kolejnych krwawień miesiączkowych. W tym czasie nie pamięta już dokładnie stosunku i dlatego leż trudno jest określić termin zapłodnienia.
Ginekolog oblicza datę porodu przyjmując, że nastąpi on w 280 dni lub 40 tygodni licząc od pierwszego dnia ostatniej miesiączki. U kobiet mających regularny, 28-dniowy cykl miesiączkowy metoda ta jest dosyć dokładna, ale w przypadku nieregularnych cykli może prowadzić do sporego błędu. Trzeba także pamiętać, że czas pomiędzy owulacją i następującym po niej krwawieniem miesięcznym jest stały (14 dni ± l dzień), ale czas pomiędzy owulacją i poprzedzającą ją miesiączką jest wysoce zmienny. Dodatkową komplikację może stanowić wystąpienie u kobiety krótkiego krwawienia około 14 dni po zapłodnieniu, wynikające z zachodzącego podczas implantacji uszkodzenia naczyń przez trofoblast (patrz Rozdział 3). Dlatego też nie zawsze łatwo jest określić termin

Ryć. 6-6. Zdjęcie 7-rniesietznego płodu, ten płód prawdopodobnie można by było utrzymać przy życiu. Płód ma zaokrąglone kontury na skutek uformowania się tłuszczowej tkanki podskórnej. Widać spiralne skręcenie sznura pępowinowego.
porodu. Na ogół większość płodów rodzi się z odchyleniem 10-14 dni od obliczonego terminu. Jeśli poród nastąpi znacznie przed terminem, to noworodek nazywany jest wcześniakiem. Jeśli poród jest opóźniony, to mówi się, że ciąża była przenoszona.
Niekiedy trzeba określić wiek zarodka lub płodu. Zestawiając informacje o początku ostatniej miesiączki z długością i wagą płodu oraz uwzględniając inne cechy morfologiczne, charakterystyczne dla danego miesiąca rozwoju, można tego dokonać z niewielkim błędem. Bardzo pomocne przy określaniu wieku jest badanie ultrasonograficzne. Pozwala ono na dokładne oznaczenie wymiaru ciemieniowo-siedzeniowego w okresie od 7 do 14 tygodnia ciąży. W okresie od 16 do 30 tygodnia zazwyczaj mierzy się szerokość mózgoczaszki na poziomie kości ciemieniowych (ang. biparietal diameter, BPD), obwód głowy i tułowia na wysokości brzucha i długość kości udowej.
Nieprawidłowy wzrost płodu
Płody wykazują dużą różnorodność długości i wagi. Niekiedy wyniki pomiarów nie zgadzają się z wiekiem płodu obliczanym w tygodniach lub miesiącach. Większość czynników wpływających na długość i wagę płodu jest zdeterminowana genetycznie, obecnie jednak wiadomo, że również czynniki środowiskowe wywierają na nie spory wpływ.
W przypadku noworodków, które wykazują wagę o 10 lub więcej percentyli* mniejszą od wagi właściwej dla danego okresu ciąży, mówi się o wewnątrzmacicznym opóźnieniu wzrostu. Czasami noworodki takie opisywano jako „zbyt małe w stosunku do okresu rozwoju ustalonego na podstawie datowania" (ang. smali for dates), „zbyt małe w stosunku do wieku ciążowego" (ang. smali for gestational age, SGA), niedożywione w okresie płodowym lub niedojrzałe (ang. dysmature). W przybliżeniu l na 10 niemowląt cierpi na wewnątrzmaciczne opóźnienie wzrostu i jest zagrożone zaburzeniami neurologicznymi, wadami wrodzonymi, zachłystywaniem się smółką, hipoglikemią, hipokalcemią i zespołem niedomogi oddechowej (ang. respiratory distress syndrome, RDS). Do czynników powodujących wewnątrzmaciczne opóźnienie wzrostu należą wady chromosomowe (10%), wewnątrzmaciczne zakażenia (różyczka, wirusem cytomegalicznym, toksoplazmozą i kiłą), zły stan zdrowia matki (nadciśnienie oraz schorzenia nerek i układu krążenia), stan odżywienia i pozycja społeczno-ekonomiczna matki oraz używanie tytoniu, alkoholu i narkotyków (3-5).
Zagrożenie występuje również w przypadku większych niż normalnie noworodków, które wykazują podwyższoną śmiertelność i zachorowalność oraz niejednokrotnie uszkodzenie barku wynikające z niestosunku porodowego (ang. shoulder dystocia). Są to przeważnie noworodki płci męskiej, pochodzące z przenoszonej ciąży lub mające matki chore na cukrzycę (6, 7). Uważa się, że w tym ostatnim przypadku wzrost jest stymulowany przez epizody hipoglikemii występujące u matki i wywołujące kompensacyjne wydzielanie insuliny u płodu.
Diagnostyka prenatalna
Lekarze opiekujący się ciężarną kobietą dysponują obecnie kilkoma sposobami oceny wzrostu i rozwoju płodu w macicy. Połączenie różnych technik pozwala wykryć deformacje ciała, wady chromosomowe i ocenić ogólny rozwój płodu. Spośród stosowanych metod najmniej traumatyzująca jest ultrasonografia, posługująca się ultradźwiękami dla uzyskania obrazu łożyska i pło-
* Percentyl jest to taka wielkość cechy, poniżej której znajduje się określony odsetek populacji (przyp. tłum.).

Ryć. 6-7. Ultrasonogram głowy (A) i kręgosłupa (B) normalnego płodu w 7 miesiącu ciąży. Zastosowanie tej techniki pozwala ocenić wiek płodu i wykryć niektóre zaburzenia rozwojowe, np. wady cewy nerwowej (patrz ryć. 9-14 i 20-30). (Dzięki uprzejmości Dr Nancy Chescheir z Kliniki Położnictwa i Ginekologii Uniwersytetu Północnej Karoliny).
du oraz określenia ich wielkości i pozycji. Badanie ultradźwiękowe pozwala także wykryć mnogą ciążę oraz zaburzenia rozwojowe w rodzaju wad cewy nerwowej (ryć. 6-7 A, B).
Inny sposób badania, zwany amniocentezą, polega na pobraniu płynu owodniowego (3). Do jamy owodniowej poprzez ścianę jamy brzusznej i macicy matki wprowadza się igłę i pobiera 20-30 ml płynu. Zabiegu tego zazwyczaj nie przeprowadza się przed 14 tygodniem ciąży, gdyż wcześniej nie ma wystarczającej ilości płynu owodniowego. W płynie oznacza się zawartość α-fetoproteiny (AFP). Jest to białko płodowe, występujące w wysokim stężeniu w płynie owodniowym w przypadku wad cewy nerwowej, takich jak kręgosłup rozszczepiony (spina bifida) i brak mózgowia (anencephalia) (9). (Białko to występuje także w surowicy matki, ale jego oznaczanie w surowicy daje mniej wiarygodne wyniki niż w płynie owodnionym [10]). Ponadto komórki płodowe obecne w płynie namnaża się w hodowli tkanek i wykrywa w nich wady chromosomowe. W ten sposób można zidentyfikować poważne zaburzenia chromosomowe w rodzaju trisomii lub monosomii.
W ostatnich latach zaczęto stosować technikę polegającą na pobieraniu małego fragmentu kosmówki z kosmkami (biopsja kosmków kosmówki). Tkanka ta zawiera liczne, szybko dzielące się komórki płodowe nadające się do natychmiastowego diagnozowania wad morfologicznych i biochemicznych (11). Badanie kosmówki ma tę zaletę, że można ja pobrać we wczesnym okresie ciąży (8 tydzień) i natychmiast- przeprowadzić analizę bez czekania na namnożenie komórek w hodowli. Wczesne wykrycie wad rozwojowych jest istotne przy podejmowaniu decyzji o przerwaniu ciąży. Wadę tej techniki stanowi niemożność oznaczenia poziomu AFP.
Wymienionych powyżej badań nie wykonuje się rutynowo (chociaż coraz popularniejsza staje się ultrasonografia), natomiast są one przeprowadzane w przypadku ciąży o wysokim stopniu ryzyka. Wskazania do zastosowania testów obejmują: (a) zaawansowany wiek matki (35 lub więcej lat); (b) występowanie wad cewy nerwowej w rodzinie; (c) wcześniejsze urodzenie dziecka z wadami chromosomowymi, np. z zespołem Downa; (d) wady chromosomowe u jednego z rodziców i (e) przypadki gdy matka jest nosicielem recesywnych schorzeń związanych z chromosomem X.
STRESZCZENIE
Okres płodowy trwa od 9 tygodnia ciąży aż do porodu i charakteryzuje go szybki wzrost organizmu oraz dojrzewanie narządów. Przyrost długości jest szczególnie widoczny w 3, 4 i 5 miesiącu (w przybliżeniu 5 cm na miesiąc), natomiast przyrost wagi jest największy podczas ostatnich 2 miesięcy ciąży (około 700 g na miesiąc).
Najdobitniejszą zmianę stanowi względne spowolnienie wzrostu głowy. W 3 miesiącu ciąży zajmuje ona w przybliżeniu połowę długości ciemieniowo-siedzeniowej. W końcu 5 miesiąca długość głowy stanowi w przybliżeniu jedną trzecią, a w momencie urodzenia jedną czwartą długości całkowitej (ryć. 6-2).
W 5 miesiącu ciąży matka zaczyna wyraźnie odczuwać ruchy płodu, a płód jest pokryty cienkimi, krótkimi włosami.
Płód urodzony w 6 lub na początku 7 miesiąca ciąży może być trudny do utrzymania przy życiu, głównie ze względu na niewystarczający rozwój układu oddechowego i ośrodkowego układu nerwowego.
Ogólnie przyjmuje się, że okres trwania ciąży donoszonej wynosi 280 dni lub 40 tygodni od pierwszego dnia ostatniej miesiączki, albo bardziej precyzyjnie, 266 dni lub 38 tygodni od dnia zapłodnienia.
Istnieje kilka metod, takich jak ultrasonografia, amniocenteza i biopsja kosmków kosmówki, umożliwiających przeglądowe badania płodów w okresie prenatalnym. Metody te pozwalają ocenić stopień wzrostu łożyska i płodu oraz wykryć wrodzone zniekształcenia i wady chromosomowe. Badania te zazwyczaj przeprowadza się w przypadku ciąży o wysokim stopniu ryzyka.
Rozdział 7
BŁONY PŁODOWE I ŁOŻYSKO
Na początku 2 miesiąca ciąży trofoblast zawiera dużą liczbę kosmków drugo- i trzeciorzędowych nadających mu charakterystyczny wygląd (ryć. 4-9 i 7-1). Kosmki są zakotwiczone w mezodermie blaszki kosmówki, a na obwodzie łączą się
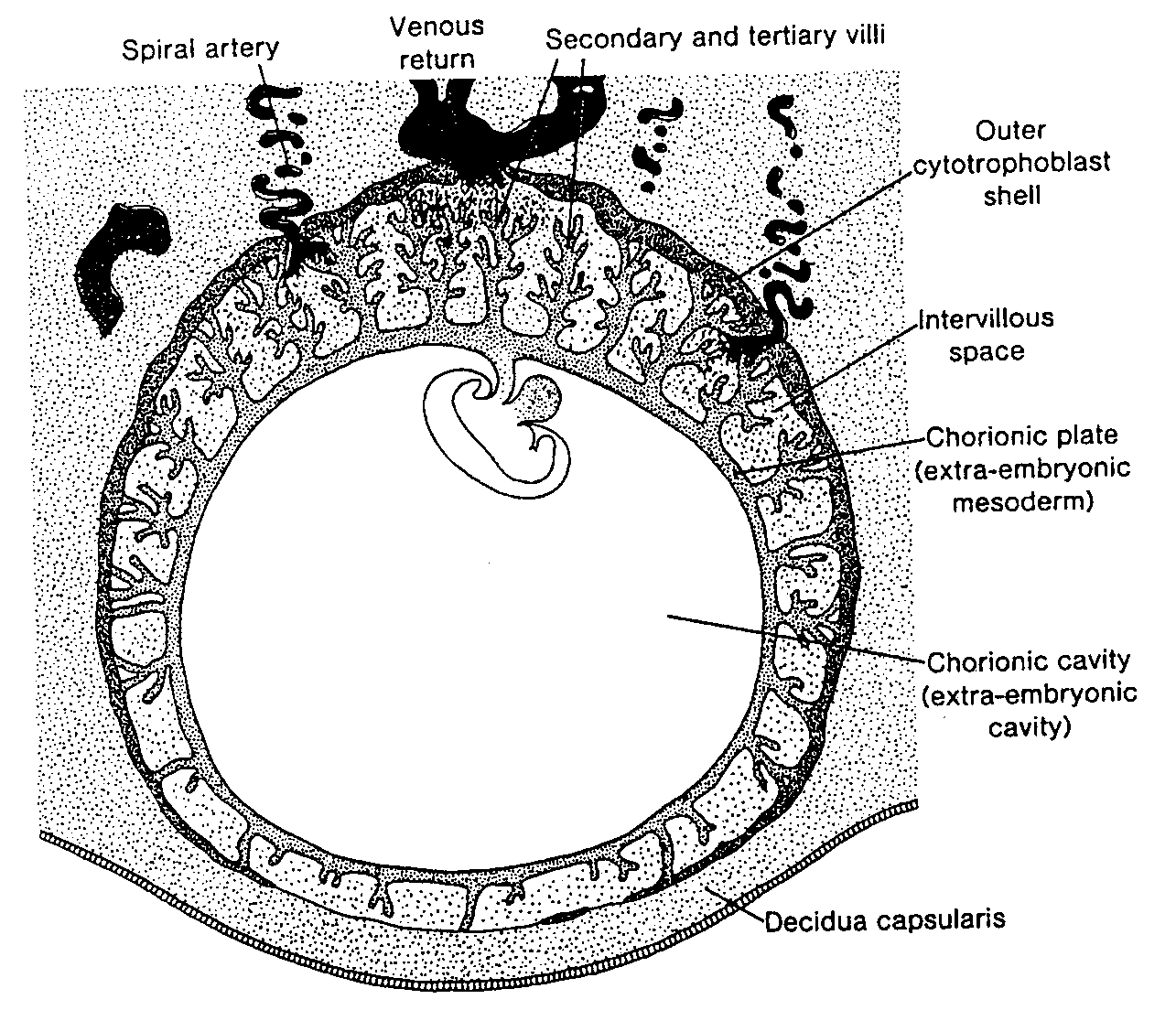
Ryć. 7-1. Schemat przedstawiający ludzki zarodek na początku 2 miesiąca rozwoju. Na biegunie zarodkowym kosmki są liczne i dobrze uformowane, na biegunie przeciwzarodkowym są nieliczne i słabo rozwinięte. (Zmodyfikowane wg von Ortmanna).
Spiral artery — tętnica spiralna; Venous return — miejsce odpływu krwi żylnej; Secondary and tertiary villi — kosmki drugo- i trzeciorzędowe; Outer cytotrophoblast shell — zewnętrzna pokrywa cytotrofoblastyczna; lntervillous space — przestrzeń międzykosmkowa; Chorionic plate (extraembryonic mesoderm) — blaszka kosmówki (mezoderma pozazarodkowa); Chorionic cavity (extraembryonic cavity — jama kosmówkowa (jama ciała pozazarodkowa); Decidua capsularis — doczesna torebkowa
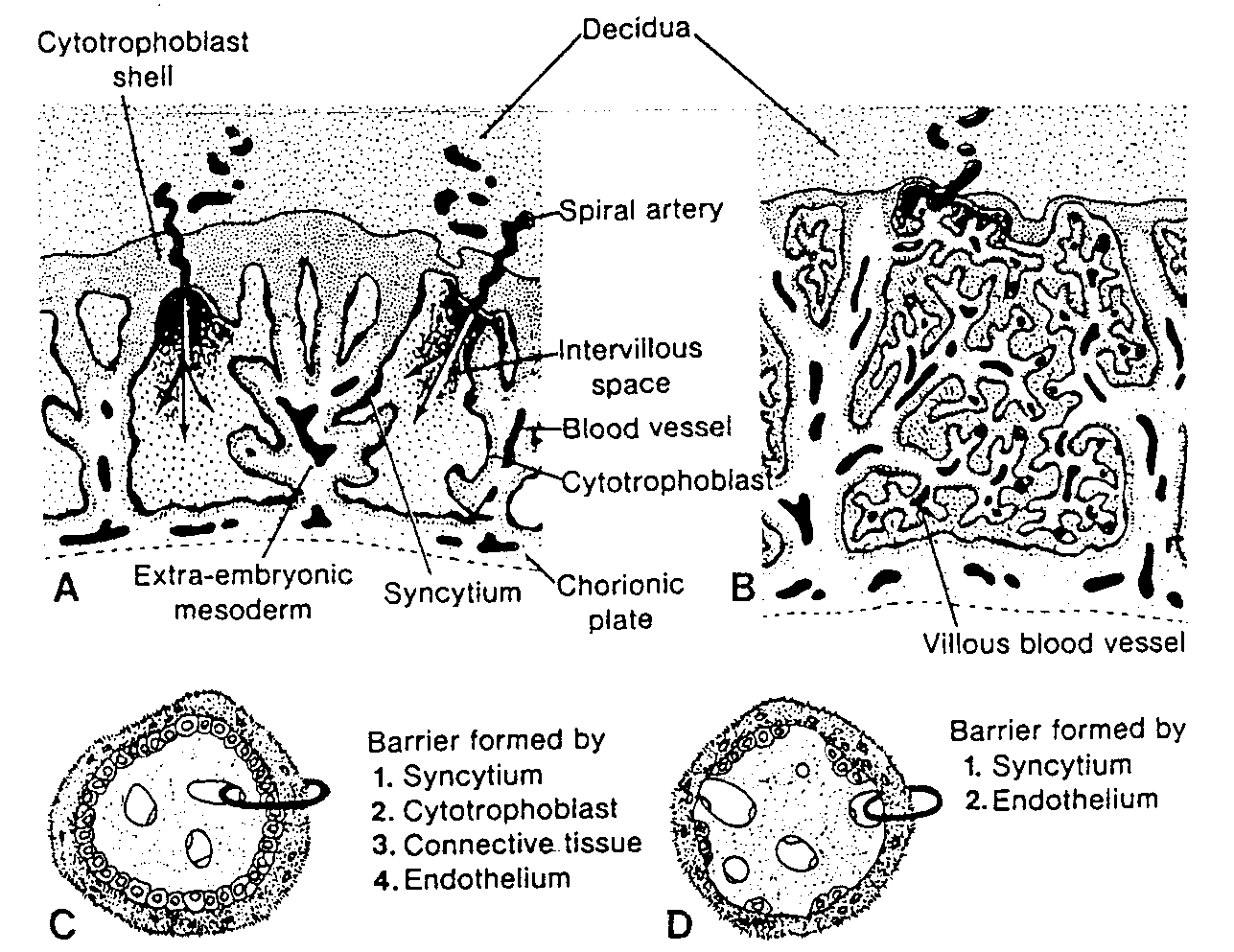
Ryć. 7-2. Struktura kosmków w różnych okresach rozwoju. A, W 4 tygodniu. Mezoderma pozazarodkowa wrasta do kosmków palowych w kierunku blaszki doczesnej. B, W 4 miesiącu. W licznych małych kosmkach ściana naczyń włosowatych bezpośrednio kontaktuje się z syncycjum. C i D, Kosmki z A i B oglądane pod większym powiększeniem.
Cytotrophoblastic shell — pokrywa cytotrofoblastyczna; Decidua — doczesna; Spiral artery — tętnica spiralna: Intervillous space — przestrzeń międzykosmkowa; Blood vessel — naczynie krwionośne; Cytotrophoblast
— cytotrofoblast; Chorionic piąte — blaszka kosmówki; Syncytium — syncycjum; Extraembryonic mesoderm
— mezoderma pozazarodkowa; Villous blood vessel — naczynie krwionośne kosmka; C, Barrier formed by
— bariera składająca się z: 1. Syncytium — syncycjum. 2. Cytotrophoblast — cytotrofoblastu. 3. Connective tissue — tkanki łącznej, 4. Endothelium — śródbłonka; D, Barrier formed by — bariera składająca się z: 1. Syncytium — syncycjum, 2. Endothelium — śródbłonka
z doczesną za pośrednictwem pokrywy cytotrofoblastycznej. Na powierzchni kosmków znajduje się syncycjum spoczywające na warstwie komórek cytotrofoblastycznych, pokrywających z kolei rdzeń utworzony przez unaczynioną mezodermę (ryć. 7-2 A, C). Rozwijający się w rdzeniu kosmków palowych układ naczyń włosowatych wkrótce łączy się z naczyniami włosowatymi w blaszce kosmówki i w szypule łączącej, ustanawiając w ten sposób pozazarodkowy układ naczyniowy (patrz ryć. 4-9).
W czasie następnych miesięcy rozwoju z istniejących już kosmków palowych wrastają do otaczających je lakun (przestrzeni międzykosmkowych) liczne małe odgałęzienia. Nowo powstające kosmki początkowo zawierają cytotrofoblast (ryć. 7-2 C), ale już na początku 4 miesiąca komórki cytotrofoblastyczne, jak również część komórek tkanki łącznej, zanikają. Jedynymi warstwami oddzielającymi wówczas krążenie matczyne od płodowego są syncycjum i śródbłonkowa ściana naczyń krwionośnych (ryć. 7-2 B). Warstwa syncycjum często staje się bardzo cienka, mogą także odrywać się od niej spore, zawierające kilkanaście jąder fragmenty i dostawać się do krwi w przestrzeniach międzykosmkowych. Fragmenty te, zwane guzkami syncycjalnymi (nodi syncytiales) przedostają się do krążenia matki i zazwyczaj wyrodnieją bez wywoływania jakichkolwiek objawów (1). Zanik komórek cytotrofoblastycznych następuje wcześniej w małych niż w dużych kosmkach i w tych ostatnich nie jest całkowity. Kosmki te jednak nie biorą udziału w wymianie substancji pomiędzy krążeniem płodu i matki.
Kosmówka kosmata i doczesna podstawna
W pierwszych tygodniach rozwoju kosmki pokrywają całą powierzchnię kosmówki (ryć. 7-1). W późniejszych okresach ciąży kosmki na biegunie zarodkowym rozrastają się i powstaje kosmówka kosmata (chorion frondosum). Natomiast kosmki na biegunie przeciwzarodkowym degenerują się i w 3 miesiącu ciąży ta część kosmówki jest ich już pozbawiona. Dlatego nazywa sieją kosmówka gładką (chorion laeve) (ryć. 7-3 i 7-4 A).
Różnica w budowie kosmówki na biegunie zarodkowym i przeciwzarodkowym znajduje odbicie w budowie doczesnej, będącej czynnościową warstwą błony śluzowej macicy, złuszczającą się w czasie porodu. Doczesna stykająca się z kosmówka kosmatą, zwana doczesną podstawna (decidua basalis), zawiera zbitą warstwę dużych komórek doczesnowych (cellulae deciduales) bogatych w lipidy i glikogen. Warstwa ta, stanowiąca blaszkę doczesnej, jest ściśle związana z kosmówka. Doczesna pokrywająca biegun przeciwzarodkowy nosi nazwę doczesnej torebkowej (decidua capsularis) (ryć. 7-4 A). W miarę powiększania się worka kosmówki doczesna torebkowa ulega rozciągnięciu i degeneruje się, a kosmówka gładka dochodzi do przeciwległej ściany macicy pokrytej doczesną ścienną (decidua parietalis). Obie doczesne łączą się wówczas ze sobą (ryć. 7-4 B, 7-5 i 7-6), a worek kosmówki całkowicie wypełnia światło macicy. Jedyną częścią kosmówki biorącej udział w procesie wymiany pomiędzy krążeniem matki i płodu jest zatem kosmówka kosmata, tworząca wraz z doczesną podstawna łożysko (placenta). Z kolei połączenie się owodni i kosmówki i utworzenie błony owodniowo-kosmówkowej doprowadza do zaniku jamy kosmówkowej (ryć. 7-4 A, B). Właśnie ta błona pęka w czasie porodu.
Budowa łożyska
Na początku 4 miesiąca ciąży łożysko składa się z dwóch części: (a) części płodowej (pars fetalis) utworzonej przez kosmówkę kosmatą i (b) części matczynej (pars materna) utworzonej przez doczesną podstawna (ryć. 7-4 B). Po stronie płodowej łożysko jest ograniczone blaszką kosmówki (lamina chór ii) (ryć. 7-7), a po stronie matczynej przez doczesną podstawna. Najściślej wbudowana w łożysko jest blaszka doczesnej wchodząca w skład doczesnej podstawnej. W strefie wewnętrznej (zona intima), zwanej także strefą łączącą, komórki trofoblastu i komórki doczesnej mieszają się ze sobą. W strefie tej występują olbrzymie komórki syncycjotrofoblastu i doczesnej oraz pomiędzy komórkami, duża ilość bezpostaciowego materiału.

Ryć. 7-3. Zdjęcie 6-tygodniowego zarodka. Owodnia i jama kosmówkowa zostały odcięte, aby uwidocznić zarodek. Łatwo zauważyć różnicę pomiędzy kosmatym trofoblastem na biegunie płodowym i niewielkimi kosmkami na biegunie przeciwpłodowym. Widać również szypułę łączącą i zawieszony na długiej szypule pęcherzyk żółtkowy.
Bushy chorion — kosmówka kosmata; Umbilical cord — sznur pępowinowy; Yolk sac stalk — szypula pęcherzyka żółtkowego; Yolk sac — pęcherzyk żółtkowy; Amnion — owodnia; Chorion laeve — kosmówka gładka
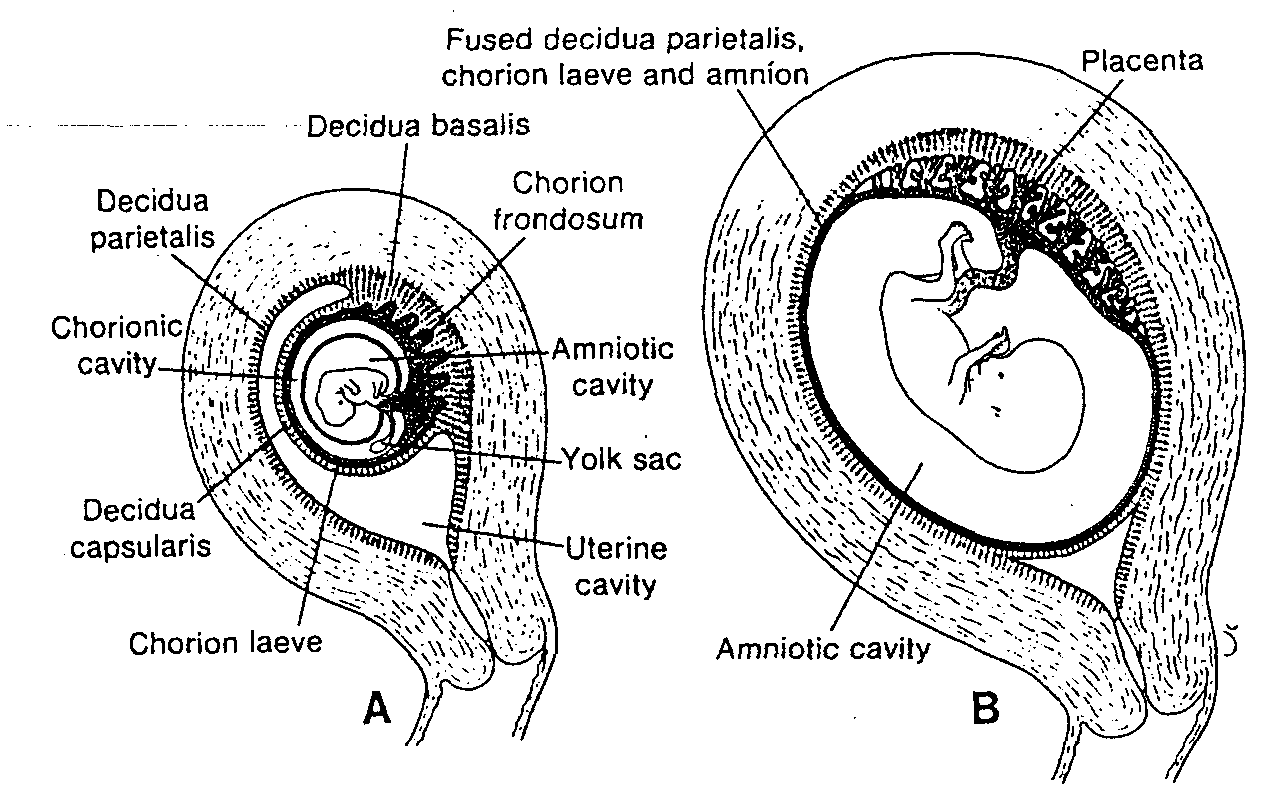
Ryć. 7-4. Schematy pokazujące relację pomiędzy błonami płodowymi i ścianą macicy. A, Koniec 2 miesiąca ciąży. Widać pęcherzyk żółtkowy w jamie kosmówkowej pomiędzy owodnia i kosmówka. Na biegunie przeciwzarodkowym nastąpił zanik kosmków i uformowała się kosmówka gładka. B, Koniec 3 miesiąca ciąży. Owodnia i kosmówka złączyły się z sobą, a światło jamy macicy znikło na skutek połączenia się kosmówki gładkiej i doczesnej ściennej.
Decidua parietalis — doczesna ścienna; Chorionic cavity — jama owodniowa; Decidua capsularis — doczesna torebkowa; Chorion laeve — kosmówka gładka; Uterine cavity — jama macicy; Yolk sac — pęcherzyk żółtkowy; Amniotic cavity — jama owodniowa; Chorion frondosum — kosmówka kosmata; Decidua basalis — doczesna podstawna; Fused decidua parietalis, chorion laeve and amnion — doczesna ścienna połączona z kosmówka gładką i owodnia; Placenta — łożysko
Większość komórek cytotrofoblastycznych już się zdegenerowała. Pomiędzy blaszką kosmówki i blaszką doczesnej znajdują się przestrzenie międzykosmkowe wypełnione krwią matki. Pochodzą one z lakun syncycjotrofoblastu i są wysłane syncycjum pochodzenia płodowego. Odgałęzienia kosmków kontaktują się z krwią matki w przestrzeniach międzykosmkowych (ryć. 7-1 i 7-7).
Podczas 4 i 5 miesiąca ciąży doczesna podstawna wytwarza pewną liczbę przegród (septa), zwanych również przegrodami łożyskowymi, wnikających do przestrzeni międzykosmkowych, ale nie dochodzących do blaszki kosmówki (ryć. 7-7). Przegrody te mają część rdzenną pochodzenia matczynego, ale na ich powierzchni występuje warstwa komórek syncycjalnych (2, 3). Przegrody rozdzielają łożysko na wiele płatów zwanych liścieniami (cytotyledones) (ryć. 7-8). Połączenie pomiędzy przestrzeniami międzykosmkowymi różnych liścieni zostaje zachowane, gdyż przegrody łożyskowe nie dochodzą do blaszki kosmówki.
W wyniku stałego wzrostu płodu i powiększania się macicy powiększa się również łożysko. Przyrost pola powierzchni łożyska następuje jednocześnie z powiększaniem się macicy i pod koniec ciąży pokrywa ono w przybliżeniu 15 - 30% jej wewnętrznej powierzchni. Pogrubienie łożyska jest następstwem rozgałęziania się kosmków, a nie ich wrastania w głąb tkanek matki, które w tym okresie już nie zachodzi.

Ryć. 7-5. Zdjęcie 19-tygodniowego płodu w naturalnej pozycji w macicy. Widać sznur pępowinowy i łożysko. Światło macicy wypełnia płód i błony płodowe. W ścianie macicy utworzył się duży guz — włókniakomięśniak.
Uterine wali and membranes — ściana macicy i błony płodowe; Myofibroma — wlókniakomięśniak; Umbilical cord — sznur pępowinowy; Placenta — łożysko
Łożysko w okresie okołoporodowym
Dojrzale łożysko ma kształt krążka, średnicy od 15 do 20 cm, grubości około 3 cm i waży od 500 do 600 g. W czasie porodu łożysko odrywa się od ściany macicy i w około 30 minut po wydaleniu płodu również zostaje wydalone z jamy macicy. Na powierzchni matczynej łożyska wyraźnie widać od 15 do 20 lekkich uwypukleń
Ryć. 7-6. Zdjęcie 23-tygodniowego płodu w jamie macicy. Część ściany macicy oraz owodnia zostały usunięte, aby uwidocznić płód. Widać naczynia łożyska zbiegające się w kierunku pępowiny. Pępowina jest ściśle owinięta wokół brzusznej części tułowia płodu, co być może spowodowało jego nieprawidłową pozycję
w macicy (ułożenie pośladkowe).
Umbilical cord — sznur pępowinowy: Cervix of uterus — szyjka macicy; Chorionic vessel — naczynie kosmówkowe
— liścieni, pokrytych cienką warstwą doczesnej podstawnej (ryć. 7-8 B). Bruzdy pomiędzy liścieniami są utworzone przez przegrody łożyskowe. Większa część doczesnej pozostaje przez pewien czas w macicy i zostaje wydalona w czasie następnej miesiączki.
Powierzchnię płodową łożyska całkowicie pokrywa blaszka kosmówki. Widać w niej pewną liczbę dużych tętnic i żył stanowiących naczynia kosmówkowe i biegnących w kierunku sznura pępowinowego (ryć. 7-8 A). Kosmówka jest z kolei pokryta owodnią. Przyczep pępowiny jest zazwyczaj umiejscowiony mimośrod-kowo, ale niekiedy może także występować w pobliżu brzegu łożyska. Rzadko leży poza jego obrębem, na błonie kosmówkowej, tworząc tzw. przyczep welonowaty (infixio velamentosa).
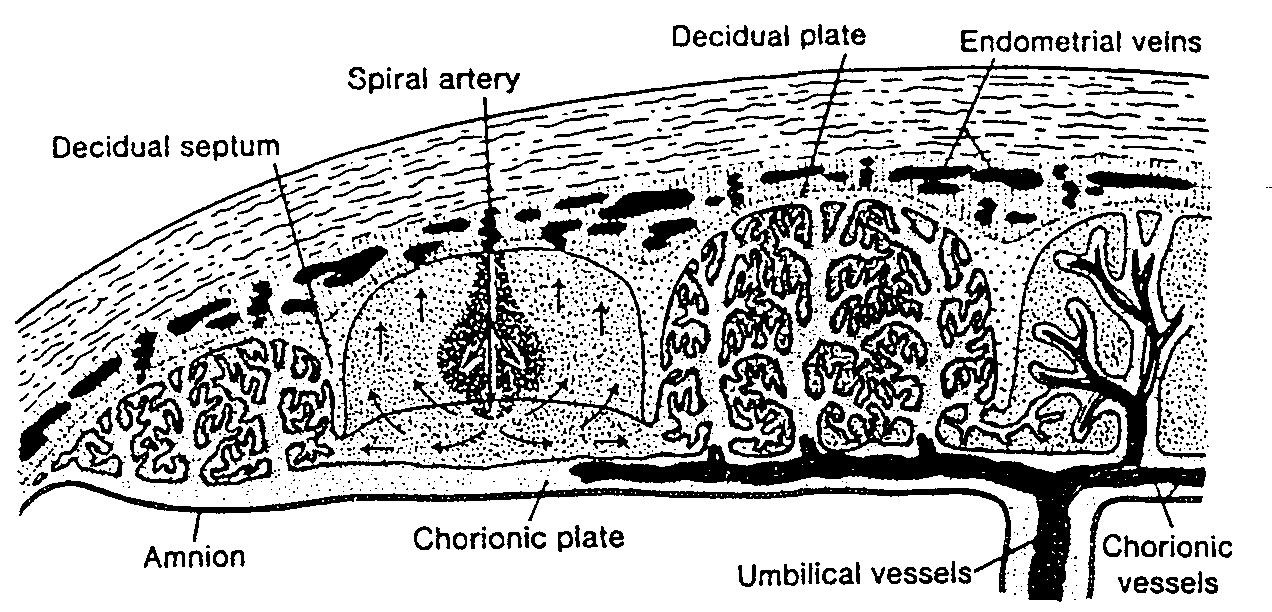
Ryć. 7-7. Syntetyczny rysunek łożyska z drugiej polowy ciąży. Liścienie są częściowo oddzielone od siebie przegrodami łożyska. Większość krwi z przestrzeni międzykosmkowych powraca do krążenia matki żyłami położonymi w błonie śluzowej macicy w obrębie tego samego liścienia. Tylko niewielka jej część przepływa do sąsiednich liścieni. Przestrzenie międzykosmkowe są wysłane syncycjotrofoblastem. (Zmodyfikowano wg E.M Ramseya: The placenta and fetal membranes. W: Obstetrics, J.P. Greenhill (wyd.), Philadelphia, W.B. Saunders, 1965 oraz W.J. Hamilton i J.D. Boyd: Trophoblast in human utero-placental arteries. Nature 212:906, 1966).
Decidual septum — przegroda łożyskowa; Amnion — owodnia; Chorionic plate — blaszka kosmówki; Umbilical vessels — naczynia pępkowe; Chorionic vessels — naczynia kosmówkowe; Endometrial veins — żyły w błonie śluzowej macicy; Decidual plate — blaszka doczesnej; Spiral artery — tętnica spiralna
Krążenie w łożysku
Krew do liścieni dopływa przez 80-100 tętnic spiralnych przenikających przez blaszkę doczesnej i wchodzących do przestrzeni międzykosmkowych w mniej więcej regularnych odstępach (ryć. 7-7) (3, 4). Tętnica spiralna ma wąskie światło, co powoduje, że utlenowana krew wpływa do przestrzeni międzykosmkowych pod zwiększonym ciśnieniem. Wskutek tego przedostaje się do nich głęboko i obmywa liczne małe odgałęzienia drzewiastych kosmków (3). W miarę spadku ciśnienia krew zawraca znad blaszki kosmówki w kierunku doczesnej i uchodzi do żył błony śluzowej macicy (ryć. 7-7).
Przestrzenie międzykosmkowe dojrzałego łożyska zawierają łącznie około 150 ml krwi, wymienianej 3-4 razy na minutę (5-7). Krew opływa kosmki kosmówki, których łączna powierzchnia wynosi od 4 do 14 m2. Trzeba jednak pamiętać, że wymiana substancji w łożysku nie zachodzi we wszystkich kosmkach, lecz jedynie w tych, w których naczynia płodowe bezpośrednio stykają się z syncycjotrofoblastem pokrywającym kosmki. W tych kosmkach syncycjum często ma rąbek szczoteczkowy utworzony przez liczne mikrokosmki, co znacznie zwiększa szybkość wymiany pomiędzy krążeniem płodowym i matczynym (ryć. 7-2 D) (2). Błona rozdzielająca krążenie płodowe i krążenie matczyne stanowi barierę łożyskową, początkowo składa się z czterech warstw: (a) śródbłonka wyścielającego płodowe naczynia krwionośne, (b) tkanki łącznej w rdzeniu kosmków, (c) warstwy cytotrofoblastu i (d) syncycjotrofoblastu (ryć. 7-2 C). Począwszy od 4 miesiąca ciąży bariera łożyskowa staje się znacznie cieńsza, gdyż śródbłonek zaczyna przylegać
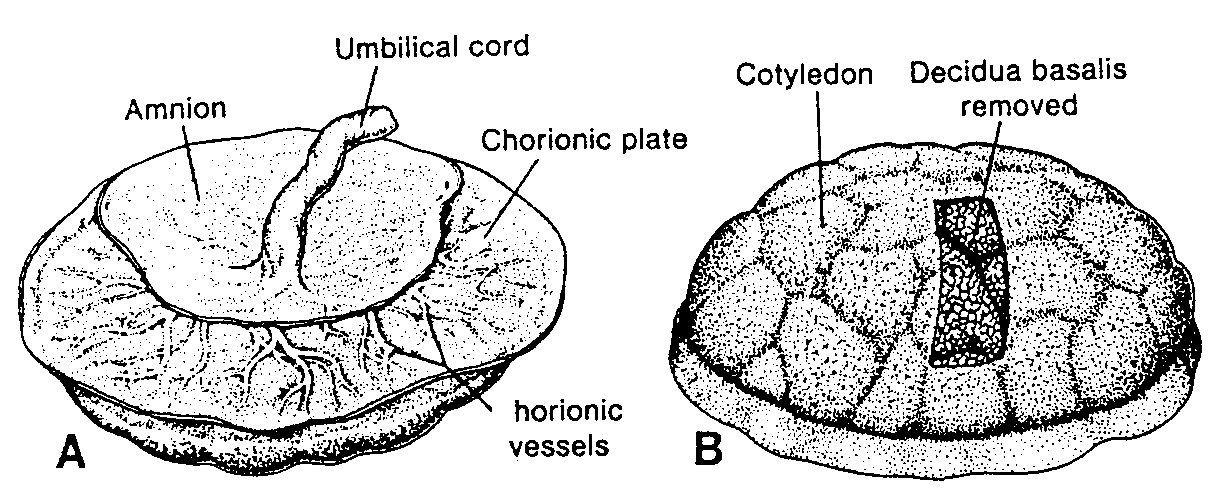
Ryć. 7-8. Rysunek przedstawiający dojrzale łożysko. A, Powierzchnia płodowa. Widać, że blaszka kosmówki i sznur pępowinowy są pokryte owodnia. B, Powierzchnia matczyna. Widoczne liścienie. W jednym miejscu usunięto doczesną. Część matczyną łożyska po porodzie należy zawsze starannie obejrzeć. Często jeden lub więcej liścieni ma białawy wygląd. Jest to spowodowane nadmiernym wytwarzaniem wlóknika, co uniemożliwia dopływ krwi i powoduje obumarcie kosmków (zawał) w grupie przestrzeni międzykosmkowych. Amnion — łożysko; Chorionic vessels — naczynia kosmówki; Chorionic plate — blaszka kosmówki; Umbilical cord — sznur pępowinowy; Cotyledon — liścień; Decidua basalis removed — usunięta doczesna podstawna
do syncycjum, co znacznie zwiększa szybkość wymiany (ryć. 7-2 D). Ponieważ krew matki w przestrzeniach międzykosmkowych jest oddzielona od krwi płodu przez tkanki kosmówki, ludzkie łożysko jest łożyskiem typu krwiokosmówkowego.
Czynność łożyska
Główne czynności łożyska to: (a) wymiana produktów metabolicznych i gazów pomiędzy krwią matki a płodu i (b) wytwarzanie hormonów.
WYMIANA GAZÓW
Wymiana tlenu, dwutlenku węgla i tlenku węgla zachodzi na drodze biernej dyfuzji. W okresie okołoporodowym płód pobiera z krążenia matki 20 do 30 ml tlenu na minutę i dlatego nawet krótka przerwa w dopływie tlenu może być dla niego zabójcza (8, 9).
WYMIANA SUBSTANCJI ODŻYWCZYCH l ELEKTROLITÓW*
Pobieranie z krwi matki substancji odżywczych, takich jak aminokwasy, wolne kwasy tłuszczowe, węglowodany i witaminy, oraz elektrolitów zachodzi bardzo szybko i nasila się w miarę postępu ciąży (9).
* Autor z niejasnych przyczyn nie wspomina w tym miejscu, że przez łożysko usuwane są także produkty przemiany materii płodu (przyp. tłum.).
PRZEKAZYWANIE PRZECIWCIAŁ MATCZYNYCH
Przeciwciała wytwarzane przez matkę są wychwytywane na drodze endocytozy przez syncycjotrofoblast i następnie transportowane do naczyń włosowatych płodu (10, 11). W ten sposób płód otrzymuje z krążenia matki przeciwciała klasy IgG (7S) chroniące przed niektórymi chorobami zakaźnymi i nabywa biernej odporności przeciwko błonicy, ospie, odrze i innym infekcjom, ale nie przeciwko ospie wietrznej i kokluszowi.
Ogromne znaczenie ma niezgodność grupowa Rh, antygenu erytrocytów. Jeśli płód ma erytrocyty Rh + , a matka Rh —, to krwinki płodu przedostające się do krwiobiegu matki mogą u niej wywołać powstanie przeciwciał. Przeciwciała te przechodzą do krążenia płodu i niszczą jego erytrocyty. Immunizacja matki jest zapewne wywołana przez niewielkie krwawienia z powierzchni kosmków (12). Zniszczenie czerwonych krwinek płodu, określane jako choroba hemolityczna noworodków (erythroblastosis fetalis), może spowodować wewnątrzmaciczne obumarcie płodu. Informacji o nasileniu choroby dostarcza badanie płynu owodniowego. Obumarciu z powodu hemolizy można zapobiec przez wewnątrzmaciczne przetoczenie krwi lub wymienną transfuzję krwi po urodzeniu.
WYTWARZANIE HORMONÓW
Pod koniec 4 miesiąca łożysko wytwarza wystarczającą ilość progesteronu, aby utrzymać ciążę w przypadku usunięcia ciałka żółtego lub jego niedoczynności (13). Prawdopodobnie wszystkie hormony łożyska są syntetyzowane przez syncycjotrofoblast. Poza progesteronem łożysko wytwarza również hormony estrogenne (głównie estradiol) w ilości wzrastającej niemal do końca ciąży, kiedy to ich synteza osiąga najwyższy poziom.
Syncycjotrofoblast wytwarza również gonadotropinę (ludzką gonadotropinę kosmówkową; ang. human chorionic gonadotropin — HCG) mającą podobne działanie do lutropiny wytwarzanej w przednim płacie przysadki. Gonadotropina kosmówkową przechodzi do moczu matki i można ją tam wykryć już we wczesnym okresie rozwoju zarodka. Obecność gonadotropiny w moczu uważa się za objaw ciąży. Innym białkowym hormonem wytwarzanym przez łożysko jest somatomammotropina (dawniej laktogen łożyskowy) wykazująca podobieństwo do hormonu wzrostu. Zapewnia ona płodowi pierwszeństwo przy pobieraniu glukozy z krwi matki i wywołuje u matki niewielkie objawy cukrzycy.
Większość hormonów wytwarzanych przez matkę nie przechodzi przez łożysko. Przechodzenie innych, np. tyroksyny, odbywa się bardzo powoli (9). Poważne niebezpieczeństwo stanowią niektóre syntetyczne progestageny, które szybko przechodzą przez łożysko i mogą wywołać • maskulinizację płodów płci żeńskiej (14). Jeszcze niebezpieczniejsze okazało się stosowanie syntetycznego estrogenu, dietylostilbestrolu, łatwo przechodzącego przez łożysko i wywołującego raka pochwy lub zaburzenia rozwojowe jąder u osób, które były narażone na jego działanie w okresie życia wewnątrzmacicznego (15) (patrz Rozdział 8).
PRZENIKANIE CZYNNIKÓW INFEKCYJNYCH
Pomimo często spotykanej opinii, że istnienie bariery łożyskowej zapewnia ochronę przed działaniem uszkadzających czynników, liczne wirusy, takie jak wirus różyczki, Coxsackie, ospy, ospy wietrznej, odry oraz poliowirusy łatwo przechodzą przez łożysko (16, 17). Niektóre wirusy po przedostaniu się do płodu wywołują infekcję, mogącą spowodować zwyrodnienie komórek i wrodzone zniekształcenia (szczegóły w Rozdziale 8).
PRZENIKANIE LEKÓW
Niestety większość leków i ich metabolitów łatwo przechodzi przez łożysko i może poważnie uszkodzić zarodek (18-20) (szczegóły w Rozdziale 8). Ponadto w okresie płodowym może rozwinąć się uzależnienie od narkotyków, jeśli matka zażywa np. heroinę lub kokainę.
Owodnia i sznur pępowiny
Linia styku pomiędzy ektodermą owodniową i zarodkową (złączenie owodniowo-ektodermalne) ma owalny kształt i jest nazywane pierścieniem pępkowym pierwotnym (anulus umbilicalis primitivus). W 5 tygodniu rozwoju przez pierścień przechodzą następujące struktury (ryć. 7-9 A, C); (a) szypuła łącząca, zawierająca omocznię oraz dwie tętnice pępkowe i żyłę pępkową; (b) szypuła- pęcherzyka żółtkowego z towarzyszącymi jej naczyniami żółtkowymi; (c) kanał łączący jamę ciała wewnątrzzarodkową z jamą ciała pozazarodkową (ryć. 7-9 C). Pęcherzyk żółtkowy znajduje się w jamie kosmówkowej, to znaczy w przestrzeni pomiędzy owodnią i blaszką kosmówki (ryć. 7-9 B).
W czasie dalszego rozwoju jama owodniową szybko powiększa się kosztem jamy kosmówkowej. Owodnia zaczyna otaczać szypułę łączącą i szypułę pęcherzyka żółtkowego zbliżając je do siebie i formując sznur pępowinowy pierwotny (ryć. 7-9 B). W części dalszej pępowina zawiera szypułę pęcherzyka żółtkowego i naczynia żółtkowe, a w części bliższej również kilka nie cofniętych jeszcze pętli jelitowych i resztki omoczni (ryć. 7-9 D). Pęcherzyk żółtkowy znajduje się w jamie kosmówkowej i łączy się z pępowiną za pośrednictwem szypuły. W końcu 3 miesiąca owodnią wzrasta do tego stopnia, że styka się z kosmówką, wypełniając w ten sposób jamę kosmówkową, która wskutek tego przestaje istnieć (ryć. 7-4 B). Pęcherzyk żółtkowy w tym okresie przeważnie ulega obkurczeniu i stopniowo zarasta.
Jama brzuszna jest przez pewien czas zbyt mała, aby pomieścić szybko rozwijające się pętle jelitowe i dlatego część z nich zostaje wypchnięta do jamy ciała pozazarodkowej w obrębie sznura pępowinowego (jamy ciała śródpępkowej). Pętle te tworzą fizjologiczną przepuklinę pępkową (patrz Rozdział 14). Mniej więcej w końcu 3 miesiąca ciąży pętle jelitowe cofają się do jamy brzusznej płodu, wskutek czego jama w pępowinie zmniejsza się i zarasta. Po zarośnięciu przewodu omoczniowego i przewodu żółtkowego oraz towarzyszących im naczyń w sznurze pępowinowym pozostają jedynie naczynia pępkowe otoczone tkanką łączną

Ryć 7-9. A, Schematyczny rysunek 5-tygodniowego zarodka pokazujący struktury przechodzące przez pierwotny pierścień pępkowy. B, Schematyczny rysunek pierwotnego sznura pępowinowego 10-tygodniowego zarodka. C, Poprzeczny przekrój przez struktury występujące na poziomie pierścienia pępkowego. D, Poprzeczny przekrój przez pierwotny sznur pępowinowy z wpuklającymi się pętlami jelitowymi.
Amnion — owodnia; Amniotic cavrty — jama owodniowa; Chorionic cavity — jama kosmówkowa; Primitive umbilical ring — pierwotny pierścień pępkowy; Connecting stalk — szypuła łącząca; Yolk sac and vitelline vessels — pęcherzyk żółtkowy i naczynia żółtkowe; Chorionic plate — blaszka kosmówki; Allantois — omocznia; Abdominal wali of embryo — ściana jamy brzusznej zarodka; Chorion — kosmówka; Yolk sac and stalk — pęcherzyk żółtkowy wraz z szypułą; Intestinal loop — pętla jelitowa; Extraembryonic coelom — jama ciała pozazarodkowa; Umbilical vessels — naczynia pępkowe; Vitelline duet — przewód żółtkowy
galaretowatą (Whartona). Tkanka ta zawiera dużo proteoglikanów i stanowi warstwę ochronną dla naczyń krwionośnych. Tętnice pępkowe są tętnicami typu mięśniowego, ale zawierają także liczne włókna sprężyste, co przyczynia się do szybkiego zwężenia i obkurczenia się naczyń pępkowych po zawiązaniu i odcięciu pępowiny.
ZMIANY W ŁOŻYSKU POD KONIEC CIĄŻY
Pod koniec ciąży w łożysku dochodzi do licznych zmian, które mogą wskazywać na zmniejszenie wymiany pomiędzy krążeniem matki i płodu. Zmiany te obejmują: (a) zwiększenie ilości włóknistej tkanki łącznej w rdzeniu kosmków; (b) pogrubienie błony podstawnej płodowych naczyń włosowatych; (c) zarastanie małych naczyń włosowatych w kosmkach; (d) odkładanie się włóknika na powierzchni kosmków w strefie wewnętrznej i w blaszce kosmówki. Nadmierne wytwarzanie włóknika często powoduje zawały kosmków w obrębie przestrzeni międzykosmkowych lub nawet całego liścienia. Taki liścień przybiera wówczas białawy wygląd.
W okresie okołoporodowym sznur pępowinowy ma średnicę około 2 cm i długość od 50 do 60cm. Spiralizacja pępowiny powoduje występowanie na niej węzłów rzekomych. Bardzo długa pępowina może zapętlić się wokół szyi płodu, natomiast zbyt krótka może spowodować wystąpienie trudności w czasie porodu, wyrywając łożysko ze ściany macicy (21).
PŁYN OWODNIOWY
Jama owodniowa jest wypełniona przejrzystym, wodnistym płynem, częściowo wytwarzanym przez komórki owodniowe, ale głównie pochodzącym z krwi matki (8, 22). Ilość płynu wzrasta od około 30 ml w 10 tygodniu ciąży do 350 ml w 20 tygodniu i 800- 1000 ml w 37 tygodniu. We wczesnym okresie ciąży zarodek jest zawieszony na pępowinie w płynie owodniowym spełniającym funkcję amortyzacyjno-ochronną. Płyn (d) absorbuje wstrząsy, (b) zapobiega przyleganiu zarodka do ściany jamy owodni i (c) umożliwia ruchy płodu. Woda w płynie owodniowym ulega wymianie co 3 godziny, co świadczy o skali wymiany pomiędzy jamą owodni i krążeniem matki (22). Prawdopodobnie od początku 5 miesiąca ciąży płód połyka płyn owodniowy wypijając, jak się ocenia, około 400 ml płynu dziennie, co stanowi około połowy całkowitej ilości płynu. W normalnych warunkach płyn owodniowy jest absorbowany w jelitach płodu i przechodzi do jego krążenia, a następnie do krwi matki w łożysku. Pod koniec ciąży do płynu owodniowego wydalany jest mocz płodowy, składający się niemal wyłącznie z wody, gdyż produkty przemiany materii płodu są używane przez łożysko. W czasie porodu owodnia łącznie z kosmówka tworzy hydrostatyczny klin rozszerzający kanał szyjki macicy.
Nadmiar płynu owodniowego (1500-2000 ml) określa się nazwą wielowodzie (hydramnion s. polyhydramnion), a niedobór (mniej niż 400 ml) terminem skąpowodzie (oligohydramnion). Oba te stany łączą się ze zwiększoną częstotliwością wad wrodzonych i uszkodzeń płodu. Główne przyczyny wielowodzia są nie znane (idiopatyczne) (35%), ale mogą być nimi także cukrzyca matki (25%) i wady wrodzone, w tym wady ośrodkowego układu nerwowego (np. brak mózgowia) i układu pokarmowego (zarośnięcia, np. przełyku), uniemożliwiające płodowi normalne połykanie płynu. Skąpowodzie występuje rzadko i może być spowodowane brakiem zawiązków nerek (23).
Błony płodowe u bliźniąt
Układ błon płodowych u bliźniąt znacznie się różni w zależności od rodzaju ciąży bliźniaczej, a w przypadku bliźniąt monozygotycznych (jednojajowych) od czasu, w którym nastąpiło ich rozdzielenie.
BLIŹNIĘTA DIZYGOTYCZNE
Najczęściej zdarzają się bliźnięta dizygotyczne (dwujajowe). Powstają one po owulacji dwóch owocytów, z których każdy zostaje zapłodniony przez inny plemnik. Ponieważ obie zygoty mają odmienny skład genów, powstałe bliźnięta nie wykazują większego podobieństwa niż rodzeństwo różniące się wiekiem. Bliźnięta dizygotyczne mogą różnić się płcią. Obie zygoty indywidualnie implantują się w jamie macicy i każda wytwarza własne łożysko, własną owodnię i własny worek kosmówki (ryć. 7-10 A). Niekiedy jednak oba łożyska leżą tak blisko, że zlewają się ze sobą. Również ściany worków kosmówki mogą się zbliżyć i połączyć (ryć. 7-10 B). Niekiedy każde z bliźniąt dizygotycznych ma krwinki czerwone należące do dwóch grup krwi (mozaikowatość erytrocytów), co wskazuje na tak dokładne złączenie się łożysk, że mogło dojść do wymiany erytrocytów.
BLIŹNIĘTA MONOZYCOTYCZNE
Drugi typ ciąży bliźniaczej rozwija się z pojedynczej zapłodnionej komórki jajowej i prowadzi do powstania bliźniąt monozygotycznych. Powstają one w wyniku Rozdzielenia się zygoty, które może nastąpić w różnych stadiach rozwojowych. Najwcześniejsze rozdzielenie się zachodzi, jak się przypuszcza, w stadium dwóch komórek i wówczas rozwijają się dwie odrębne zygoty. Obie blastocysty implantują się oddzielnie i każdy zarodek ma swoje własne łożysko i worek kosmówki (ryć. 7-11 A). Chociaż układ błon takich bliźniąt przypomina układ występujący u bliźniąt dizygotycznych, to na podstawie identycznych grup krwi, odcisków palców, płci i wyglądu zewnętrznego, np. koloru oczu i włosów, można poznać, że stanowią one parę monozygotyczną.
W większości przypadków powstanie dwóch zarodków następuje w stadium wczesnej blastocysty. Z węzła zarodkowego powstają wówczas dwie grupy komórek pozostające w tej samej jamie blastocysty (ryć. 7-11 B). Oba zarodki mają wspólne łożysko i wspólną jamę kosmówkową, ale odrębne jamy owodniowe (ryć. 7-11 B). W rzadkich przypadkach utworzenie dwóch zarodków następuje w stadium dwublaszkowej tarczy zarodkowej tuż przed pojawieniem się smugi pierwotnej (ryć. 7-11 C). Wówczas powstaną bliźnięta z pojedynczym łożyskiem i wspólną jamą owodniową i kosmówkową. Mimo że takie bliźnięta mają wspólne łożysko, ilość krwi dopływającej do każdego z zarodków jest podobna. Niekiedy powstanie dużych zespoleń pomiędzy naczyniami doprowadza do zaburzeń w krążeniu i powstania jednego dużego i jednego małego bliźniaka (24).
Częstość występowania ciąż bliźniaczych jest różna w różnych krajach. W Stanach Zjednoczonych bliźnięta stanowią 1,08% w populacji ludzi białych i l ,36% w populacji ludzi czarnych. Około 70% bliźniąt jest dizygotami, a 30% monozygotami (25).
Dość często występują również trojaczki (l na około 7600 porodów), natomiast czworaczki, pięcioraczki, itd. zdarzają się rzadko. W ostatnich latach ciąże mnogie,
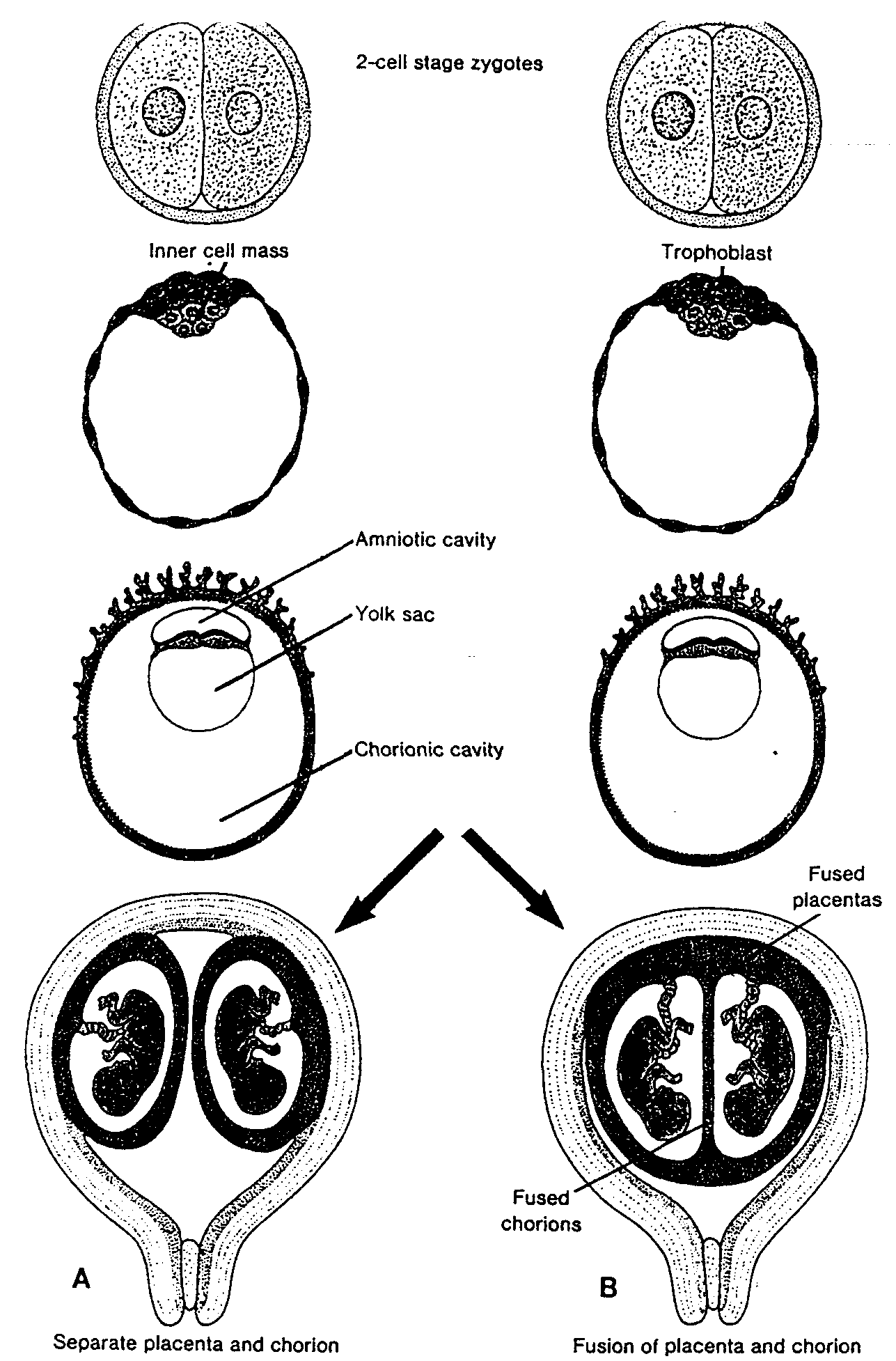
Ryć. 7-10. Schematyczne rysunki pokazujące rozwój bliźniąt dizygotycznych. Mimo że każdy zarodek na ogół ma własne łożysko, kosmówkę i owodnię (A), łożyska mogą niekiedy być złączone (B). W tym ostatnim przypadku oba zarodki zazwyczaj otrzymują podobną ilość krwi, ale niekiedy do jednego z nich dopływa jej więcej wskutek powstania dużych zespoleń naczyniowych.
2-cell stage zygotes — zygoty w stadium 2 komórek; Inner cell mass — węzeł zarodkowy; Amniotic cavity — jama owodniową; Yolk sac — pęcherzyk żółtkowy; Chorionic cavity — jama kosmówkowa; Separate placenta and chorion — oddzielne łożysko i kosmówka; Trophoblast — trofoblast; Fused placentas — złączone łożyska; Fused chorions — złączone kosmówki; Fusion of placenta and chorion — złączenie łożyska z kosmówka
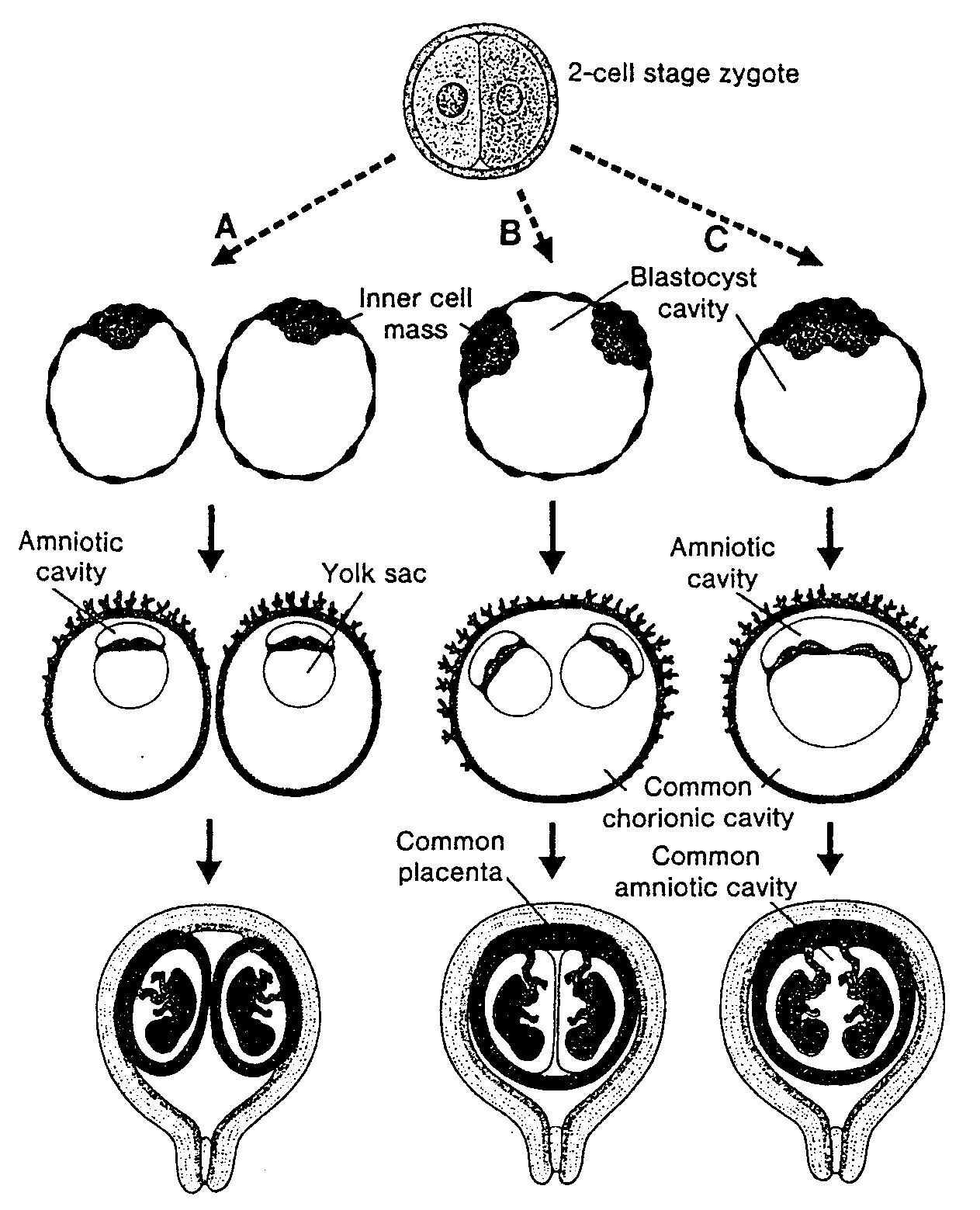
Ryć. 7-11. Schematyczne diagramy pokazujące różne stosunki pomiędzy błonami płodowymi bliźniąt monozygotycznych. A, Rozdzielenie zygoty nastąpiło w stadium 2-komórkowym i każdy z zarodków ma własne łożysko, jamę owodniową i jamę kosmówkową. B, Rozdzielenie węzła zarodkowego na dwie całkowicie odrębne grupy komórek. Oba zarodki mają wspólne łożysko i wspólny worek kosmówki, ale oddzielne jamy owodniowe. C, Rozdzielenie węzła zarodkowego w późnym stadium rozwoju. Zarodki mają wspólne łożysko, wspólną jamę owodniową i wspólny worek kosmówki. 2-cell stage zygote — zygota w stadium 2-komórkowym; Inner celi mass — węzeł zarodkowy; Blastocyst cavity — jama blastocysty; Amniotic cavity — jama owodniową; Yolk sac — pęcherzyk żółtkowy; Common placenta — wspólne łożysko; Common chorionic cavity — wspólna jama kosmówkową; Common ammotic cavity — wspólna jama owodniową
Ryć. 7-12. Schematyczne rysunki bliźniąt zrośniętych w odcinku piersiowym (thoraropagus); odcinku grzebietowym (pygopagus) lub w obrębie czaszki (craniophagus). Bliźnięta zrośnięte można rozdzielić, pod warunkiem że nie mają wspólnych narządów niezbędnych do życia.
np. z sześcioraczkami, zdarzają się częściej ze względu na podawanie matkom hormonów gonadotropowych w przypadku niewystępowania owulacji (26).
BLIŹNIĘTA ZROŚNIĘTE
Rozdzielanie się zygoty w czasie późniejszych stadiów rozwoju może doprowadzić do nieprawidłowego lub niekompletnego podziału w okolicy osiowej tarczy zarodkowej. W efekcie prowadzi to do powstania bliźniąt zrośniętych. W zależności od charakteru i stopnia zrośnięcia klasyfikuje się je jako bliźnięta zrośnięte w odcinku piersiowym (thoracopagus, gr. pagus — szczepiony), odcinku grzbietowym (pygopagus) lub w obrębie czaszki (craniopagus) (ryć. 7-12). Niekiedy bliźnięta monozygotyczne są ze sobą połączone tylko mostkiem skórnym lub mostkiem wątrobowym (bliźnięta syjamskie). Niejednokrotnie zrośnięte bliźnięta udawało się rozdzielić chirurgicznie.
STRESZCZENIE
Łożysko składa się z dwóch składników: (a) części płodowej pochodzącej z kosmówki kosmatej i (b) części matczynej pochodzącej z doczesnej podstawnej. Przestrzeń pomiędzy blaszką kosmówki i blaszką doczesnej wypełniają przestrzenie międzykosmkowe (jeziorka międzykosmkowe) zawierające krew matki. Do tych przestrzeni wrastają kosmki rozgałęzione — villi ramosi (tkanka płodowa) i są obmywane przez krew. Krążenie płodowe jest oddzielone od krążenia matki przez (a) syncycjotrofoblast, stanowiący część kosmówki i (b) śródbłonek naczyń włosowatych kosmków. Dlatego też łożysko ludzkie jest łożyskiem krwiokosmówkowym.
Przestrzenie międzykosmkowe w całkowicie dojrzałym łożysku zawierają około 150 ml krwi matki, wymienianej od trzech do czterech razy na minutę. Powierzchnia kosmków może wynosić od 4 do 14 m2. Wszystko to ułatwia wymianę pomiędzy matką i płodem.
Główne czynności łożyska to: (a) wymiana gazów; (b) wymiana składników odżywczych, produktów przemiany materii i elektrolitów; (c) transport przeciwciał wytwarzanych przez matkę i zapewniających płodowi odporność bierną; (d) wytwarzanie hormonów — progesteronu, estradiolu i estrogenu (oraz gonadotropiny kosmówkowej i somatomammotropiny) i (e) unieczynnianie (detoksykacja) niektórych leków.
Owodnia stanowi duży worek z płynem owodniowym, w którym na sznurze pępowinowym zawieszony jest płód. Płyn owodniowy (a) absorbuje wstrząsy; (b) umożliwia ruchy płodu; (c) zapobiega przyleganiu płodu do otaczających tkanek. Płód połyka płyn owodniowy, wchłaniany następnie w przewodzie pokarmowym i usuwany przez łożysko. Płód wydala do płynu owodniowego mocz, w skład którego wchodzi prawie wyłącznie woda. Zwiększona ilość płynu owodniowego (wielowodzie — hydramnion) występuje w przypadku braku mózgowia lub zarośnięcia przełyku, natomiast zmniejszona ilość (skąpowodzie — oligoamnion) przy braku zawiązków nerek.
Sznur pępowinowy dojrzałego płodu jest otoczony przez owodnię i zawiera: (a) dwie tętnice pępkowe, (b) jedną żyłę pępkową i (c) tkankę łączną galaretowatą (Whartona), służącą jako warstwa ochronna dla naczyń pępkowych.
Bliźnięta w zależności od swojego pochodzenia i okresu powstania mogą mieć odmienny układ błon płodowych. Siedemdziesiąt procent bliźniąt jest dizygotami i ma dwie owodnię, dwie kosmówki i dwa łożyska, które jednak niekiedy mogą być złączone. Bliźnięta monozygotyczne zazwyczaj mają dwie owodnię, jedną kosmówkę i jedno łożysko. W przypadku bliźniąt zrośniętych, gdy płody nie są całkowicie rozdzielone, istnieje jedna owodnia, jedna kosmówka i jedno łożysko.
Rozdział 7
WADY WRODZONE
Częstość występowania
Wady wrodzone określa się jako „widoczne przy urodzeniu uszkodzenia w zakresie budowy" (1). Teratologia (gr. teratos — potwór) zajmuje się badaniami wad wrodzonych oraz ich przyczyn, uwzględniając zmiany w zakresie budowy i czynności. Czynniki, które powodują te wady, określa się mianem teratogenów. Wskaźniki występowania wad wrodzonych mają różne wartości. Według danych oficjalnych i metryk urodzeń procent dzieci rodzących się z wadami waha się od 0,75% do 1,98% (2-6). Te wartości wydają się jednak zaniżone, gdy porównuje się je z danymi uzyskanymi ze szpitali lub z metrykami z klinik położniczych, które notują odsetek dzieci ze zniekształceniami w zakresie od 1,43% do 3,30% (7-9). Chociaż te ostatnie wartości są prawdopodobnie wiarygodniejsze, to jednak różnią się dość znacznie w zależności od źródła. Może to być spowodowane istnieniem różnic zarówno w częstotliwości przypadków w różnych krajach, jak i w rodzaju uwzględnianych zniekształceń. Częstotliwość występowania oraz rodzaje zniekształceń zmieniają się także w zależności od rasy (9).
Według ocen światowych, opartych na analizie wad wrodzonych z 20 milionów urodzeń, stwierdzono, że opierając się na świadectwach urodzeń procent dzieci z wadami wrodzonymi wynosi 0,83%; na podstawie danych uzyskanych ze szpitali rośnie do l ,26%; według bardziej szczegółowych badań pediatrycznych procent ten osiąga wartość 4,50 (l 0). W tej ostatniej grupie występowanie wad wrodzonych było najwyższe w USA (8,76%), najniższe zaś w Niemczech (2,20%). Jeżeli analizę tę wykonuje się na podstawie badania niemowląt 6-12-miesięcznych, to procent dzieci z wadami rozwojowymi podwaja się, a nawet notowano wskaźnik 7,5% (l 1).
Reasumując, należy-stwierdzić, że jest wysoce prawdopodobne, że od 2 do 3% niemowląt żywo urodzonych wykazuje jedną lub kilka wad wrodzonych i że pod koniec pierwszego roku życia wartość ta podwaja się wskutek rozpoznawania wad niezauważalnych przy urodzeniu.
Czynniki środowiskowe
Do początku lat czterdziestych przyjmowano, że wady wrodzone wywoływane są głównie przez czynniki dziedziczne. Wraz z odkryciem Gregga (12), że różyczka matek będących we wczesnych okresach ciąży powoduje anomalie płodów, nagle stało się oczywiste, że wady wrodzone u ludzi mogą być spowodowane czynnikami środowiskowymi. Pionierskie prace Warkany i Kaltera (l, 13), którzy wykazali, że pewien szczególny brak w diecie ciężarnych szczurów okazał się czynnikiem teratogennym, zapoczątkowały lawinę badań, doprowadzających do odkrycia ogromnej liczby czynników środowiskowych, teratogennych dla rozwijających się zarodków ssaków. (Najważniejsze prace z tej dziedziny: Warkany i Kalter [l, 13]; Wilson [14]; Fraser [15, 16]; Wilson i Fraser [17]).
Mimo szybkiego rozwoju teratologii, wiedza nasza o wadach wrodzonych ludzi powiększyła się w nieznacznym stopniu. Obecnie przyjmuje się, że około 10% wszystkich znanych wad u ludzi wywołują czynniki środowiskowe i drugie 10% — genetyczne i chromosomalne; pozostałe 80% wad jest przypuszczalnie spowodowanych skomplikowanymi wspóldziałaniami wielu czynników genetycznych i środowiskowych.
CZYNNIKI ZAKAŹNE
Różyczka
Gregg (12) pierwszy zasugerował, że różyczka, pojawiająca się u kobiet znajdujących się we wczesnej ciąży, prowadzi do powstania wad wrodzonych u potomstwa. Obecnie wiemy z całą pewnością, że wirus różyczki powoduje: anomalie oczu (zaćmę i mikroftalmię), ucha wewnętrznego (wrodzona głuchota spowodowana uszkodzeniem narządu Cortiego), serca (przetrwały przewód tętniczy — ductus arteriosus), oraz ubytki w przegrodach międzykomorowych i przedsionkowych i niekiedy zębów (uszkodzenie warstwy szkliwa) (18- 20). Wirus ten może być także odpowiedzialny za pewne postacie uszkodzenia mózgu i opóźnienie rozwoju umysłowego (21,22). Ostatnio stwierdzono, że wirus różyczki powoduje wewnątrzmaciczne opóźnienie wzrostu, uszkodzenia mięśnia sercowego i wady układu naczyniowego (23, 24).
Rodzaj wad uzależniony jest od stadium rozwoju płodu, w jakim nastąpiło zakażenie. Na przykład, zaćma spowodowana jest infekcją podczas 6 tygodnia ciąży, a głuchota — infekcją w 9 tygodniu. Uszkodzenia serca są następstwem infekcji w 5-10 tygodniu, a deformacje zębów — infekcją występującą pomiędzy 6 a 9 tygodniem (25-28). Zaburzenia ośrodkowego układu nerwowego są następstwem zakażenia w drugim trymestrze ciąży (29).
Niezmiernie trudno jest dokładnie określić częstotliwość wad wrodzonych u potomstwa matek zakażonych wirusem różyczki, albowiem choroba ta może mieć przebieg łagodny i nie zostać wykryta lub jej przebieg może mieć nietypowy obraz kliniczny, przez co również może ona zostać nie rozpoznana. Ponadto, jak już wspomniano, pewne wady wrodzone rozpoznawane są później, gdy dziecko osiąga wiek 2-4 lat. Z drugiej zaś strony wysypki spowodowane wirusami innymi, niż różyczka mogą być błędnie jej przypisywane.
W badaniach prospektywnych ryzyko wystąpienia wad wrodzonych określa się na 47% przy infekcji pojawiającej się w pierwszych 4 tygodniach ciąży; na 22% w następstwie infekcji w 5-8 tygodniu ciąży; na 7% w przypadku zakażenia w 9- 12 tygodniu i na 6%, jeżeli zakażenie nastąpiło w 13-16 tygodniu ciąży (30). Następstwem infekcji w pierwszych 8 tygodniach ciąży mogą być także porody przedwczesne i obumarcie płodu (31).
Jeżeli uwzględnić takie uszkodzenia, jak opóźnienie rozwoju umysłowego czy zaburzenia rozwoju zębów, które są rozpoznawalne dopiero w późniejszym okresie życia, to prawdopodobnie podane wartości procentowe byłyby wyższe (65% przypadków wrodzonej głuchoty, będącej następstwem różyczki u matki w okresie ciąży, nie można rozpoznać aż do 4 roku życia) (32).
W ostatniej dekadzie dokonano istotnego postępu w dwóch dziedzinach: upowszechniono testy pozwalające na wykrycie wirusa różyczki w materiale od pacjentek oraz określenie poziomu przeciwciał antywirusowych w surowicy krwi. Ważnym zastosowaniem tego testu jest możliwość ustalenia, czy pacjentka jest uczulona, tzn. czy posiada przeciwciała skierowane przeciwko wirusowi różyczki, a więc czy nie musi obawiać się wystąpienia różyczki w czasie ewentualnej ciąży. Badania epidemiologiczne 600 kobiet wykazały, że 85% spośród nich było uczulonych na wirusa różyczki. Drugim ważnym krokiem było wykazanie, że wirus ten przechodzi do zarodka przez łożysko oraz że infekcja dziecka może przetrwać wiele miesięcy czy nawet lat od urodzenia. Takie dzieci, zwykle nie wykazujące objawów infekcji, mogą przenosić wirusa różyczki na personel szpitalny — pielęgniarki, lekarzy i innych (33, 34). Opracowano bezpieczną i skuteczną szczepionkę przeciwko różyczce, którą podano ponad 35 milionom kobiet w USA.
Wirus cytomegalii
Tylko wobec trzech chorób wirusowego pochodzenia, wywołanych wirusem różyczki, cytomegalii i opryszczki, stwierdzono niezbicie związek przyczynowy między występowaniem wad wrodzonych i przewlekłych zakażeń płodu, mogących przetrwać do okresu pourodzeniowego, a przebyciem tych chorób przez matkę w czasie ciąży. Wrodzona cytomegalia, charakteryzująca się występowaniem w komórkach ciałek wtrętowych, jest najprawdopodobniej wywołana zakażeniem in utero ludzkim wirusem cytomegalii przez matki o bezobjawowym przebiegu choroby (35, 36). Głównymi objawami infekcji wirusem cytomegalii są: mikrocefalia, zwapnienia w mózgu, ślepota, zapalenie siatkówki, powiększenie wątroby i śledziony. Niektóre niemowlęta wykazują ciężką żółtaczkę mózgową i liczne osutki wybroczynowe w skórze. Początkowo chorobę rozpoznawano jedynie badaniem pośmiertnym, przez wykrywanie powiększonych komórek o dużych jądrach, zawierających duże ciałka wtrętowe. Ciałka wtrętowe spotyka się najczęściej w komórkach kanalików nerkowych oraz w komórkach znajdujących się w moczu. Choroba często prowadzi do śmierci zarodka lub płodu, a w przypadku przeżycia rozwój umysłowy dziecka może być opóźniony z powodu zapalenia opon mózgowych i mózgu (37). Ponieważ choroba ta jest zwykle u kobiet ciężarnych nie rozpoznawana, nie wiadomo, jaki wpływ na jej przebieg ma wiek płodu w okresie zakażenia. Prawdopodobnie zakażenie płodu we wczesnych fazach jego rozwoju powoduje tak duże uszkodzenia, że przeżycie staje się niemożliwe. Przypadki, które zwracają naszą uwagę, dotyczyły najprawdopodobniej płodów zakażonych w późnych okresach ciąży.
Wirus opryszczki
W literaturze są doniesienia wskazujące, że niekiedy dochodzi do śródmacicznego zakażenia płodu wirusem opryszczki (Herpes simplex) (38, 39). Zwykle do zakażenia wirusowego dochodzi na krótko przed urodzeniem, a wady rozwojowe przypisywane temu wirusowi to: mikrocefalia (malogłowie), mikroftalmia (niedorozwój gałki ocznej), dysplazja siatkówki, powiększenie wątroby i śledziony oraz upośledzenie rozwoju umysłowego. Najczęściej jednak dziecko zostaje zakażone wirusem, jako chorobą weneryczną, od matki podczas porodu i objawy choroby pojawiają się podczas pierwszych 3 tygodni życia noworodka. Objawy te są manifestacją reakcji immunologicznych.
Inne infekcje wirusowe i hipertermia
Opisano wady rozwojowe wywołane przez zakażenie matek wirusami odry, świnki, zapalenia wątroby, poliomyelitis (choroba Heinego-Medina), ospy wietrznej, ECHO, Coxsackie i grypy (40). Badania prospektywne wskazują jednak, że częstość występowania wad wrodzonych w następstwie ekspozycji na te czynniki jest niska, a nawet negowany jest związek przyczynowy między powstawaniem wad wrodzonych a tymi czynnikami (41, 42).
Należy też uwzględnić inny czynnik, związany z zakażeniami wirusowymi — hipertermię. Większość wirusów wywołuje wzrost temperatury ciała — hipertermię. Istnieje doniesienie, że 7 spośród 63 (11%) noworodków bezczaszkowych urodziły matki, u których hipertermia wystąpiła w tym czasie, kiedy u zarodków fałdy nerwowe płytki nerwowej schodzą się tworząc cewę nerwową. Ciekawe, że w dwóch przypadkach epizod hipertermii był związany nie z infekcją, lecz z przegrzaniem w saunie (43).
Toksoplazmoza
Infekcja matek pierwotniakami Toxoplasmosa gondii powoduje powstanie wad wrodzonych płodów. Dzieci z uszkodzeniami mogą wykazywać ogniska zwapnień w mózgu, wodogłowie lub opóźnienie rozwoju umysłowego. Opisano także uszkodzenia gałki ocznej w postaci zapalenia naczyniówki i siatkówki lub mikroftalmię (44, 45). Dokładnego wskaźnika wad wrodzonych wywołanych toksoplazmozą nie można określić, ponieważ — podobnie jak w przypadku wirusa cytomegalii — u ciężarnych kobiet choroba jest zwykle nie rozpoznawana.
Kiła
Kiłę uważano dawniej za główną przyczynę powstawania wad wrodzonych. Obecnie już tak się nie sądzi, aczkolwiek nie ulega wątpliwości, że kiła może powodować wrodząną głuchotę i opóźnienie rozwoju umysłowego potomstwa zakażonych matek. Ponadto kiła powoduje w wielu narządach, np. w płucach i w wątrobie, rozległe zmiany o typie zwłóknienia (46).
PROMIENIOWANIE
Teratogenny wpływ promieniowania rentgenowskiego znany jest od wielu lat i ustalono, że mikrocefalia, uszkodzenia czaszki, rozszczep kręgosłupa, rozszczep podniebienia, uszkodzenia kończyn oraz ślepota mogą mieć swoją przyczynę w napromieniowaniu ciężarnych kobiet wysokimi dawkami promieniowania rentgenowskiego lub radu (47).
Wprawdzie nie znana jest maksymalna dawka bezpieczna dla ludzi, to jednak płody myszy mogą zostać uszkodzone już nawet dawką 5 radów (48). Trzeba wiedzieć, że charakter uszkodzeń zależy od dawki promieniowania oraz od stadium rozwoju płodu, w którym został on napromieniowany (49, 50).
Badania Japonek, będących w ciąży podczas eksplozji bomby atomowej nad Hiroszimą i Nagasaki wykazały, że u tych, które przeżyły, w 28% nastąpiło poronienie, 25% urodziło dzieci, które zmarły w ciągu pierwszego roku, a u 25% dzieci, które przeżyły, występowały uszkodzenia ośrodkowego układu nerwowego, jak np. mikrocefalia lub opóźnienie rozwoju umysłowego (51-53).
Oprócz wpływu bezpośredniego napromieniowania na płód, należy uwzględnić wpływ pośredni, na komórki rozrodcze. U myszy stosunkowo niskie dawki promieniowania mogą spowodować mutacje, których konsekwencją jest występowanie wad wrodzonych w następnym pokoleniu (54).
Czynniki chemiczne
Rola związków chemicznych oraz lekarstw w wywoływaniu wad wrodzonych jest u ludzi trudna do oceny z dwóch powodów: (d) — większość informacji uzyskuje się na podstawie badań retrospektywnych, (b) — kobiety ciężarne zażywają w okresie ciąży bardzo dużo różnych środków. Według badań Narodowego Instytutu Zdrowia USA (NIH) kobiety ciężarne stosują około 900 różnych środków i leków, przeciętnie jedna kobieta przyjmuje w okresie ciąży cztery leki. Tylko 20% kobiet nie stosuje podczas ciąży żadnych leków (55, 56). Mimo szerokiego stosowania środków chemicznych stosunkowo mało leków przyjmowanych podczas ciąży ma własności teratogenne. Najlepszym przykładem leku, który okazał się teratogenem jest Thalidomid — środek nasenny i zapobiegający nudnościom. W roku 1962 zaobserwowano w Niemczech nagły wzrost występowania bardzo rzadkiej wady wrodzonej — amelii i meromelii (całkowitego lub częściowego braku kończyn) (patrz Rozdział 9, ryć. 9-11). Po dokładnym przebadaniu przebiegu ciąży matek dzieci dotkniętych tymi wadami stwierdzono, że wiele z nich stosowało we wczesnych fazach ciąży Thalidomid. Związek przyczynowy pomiędzy preparatem Thalidomid a meromelią został wykazany tylko dzięki temu, że lek ten wywołał tak nietypowe i szokujące zniekształcenia. Gdyby uszkodzenia wywoływane tym lekiem były bardziej pospolite, np. rozszczep wargi (tzw. warga zajęcza) czy wrodzone wady serca, związek ich występowania ze stosowanym lekiem mógłby łatwo zostać przeoczony.
Uszkodzenia wywołane preparatem Thalidomid charakteryzuje brak lub ogromne zniekształcenie kości długich, zarośnięcie jelit, wady serca (57-59). Po stwierdzeniu, że stosowanie leku było bezpośrednio związane z meromelią, natychmiast go wycofano z użycia i wskaźnik meromelii gwałtownie się obniżył. Innym niebezpiecznym lekiem jest Aminopteryna. Należy ona do grupy antymetabolitów, będąc antagonistą kwasu foliowego. Ponieważ lek ten, stosowany w dawkach niewiele wyższych niż poziom teratogenny, zatrzymuje ciążę, znalazł on zastosowanie w terapeutycznym przerywaniu wczesnej ciąży u kobiet dotkniętych gruźlicą (60, 61). Z czterech przypadków, nie zakończonych poronieniem, jedno dziecko urodziło się z wadami wrodzonymi. Uszkodzenia dotyczyły wrodzonego braku mózgu, wystąpienia przepukliny oponowej, wodogłowia, rozszczepu wargi i podniebienia. Ponieważ jednak lek ten był stosowany dość powszechnie przez kobiety ciężarne i nie wywoływał zmian teratogennych, jego teratogenne działanie nie zostało przekonywająco udowodnione.
Inne leki są potencjalnie teratogenne, w tym przeciwdrgawkowe difenylohydantoina (Phenytoin) i trimetadion, stosowany przez kobiety chore na padaczkę (62). Według retrospektywnych badań obejmujących 427 ciąż u 186 chorych na padaczkę (epilepsję) częstość urodzenia dzieci z takimi uszkodzeniami, jak wady serca, rozszczep twarzy, mikrocefalia, była dwukrotnie wyższa niż spodziewana. Szczególnie difenylohydantoina wywołuje szeroki zakres wad, w tym uszkodzenia mózgoczaszki, niedorozwój palców i paznokci, zahamowanie wzrostu oraz niedorozwój umysłowy. Uszkodzenia te składają się na wydzielony zespół dysmorfogenny, zwany „zespołem płodowym hydantoiny" (ang. fetal hydantoin syndrome) (63, 64).
Trimetadion (Trimethadione), stosowany w leczeniu padaczki typu petit mai, prawdopodobnie jest także teratogenem. Zniekształcenia płodu, przypisywane temu lekowi to deformacja uszu, rozszczep podniebienia, zmiany w obrębie serca, anomalie układu moczowo-płciowego i szkieletowego. Zespół tych zmian określa się mianem „zespołu trimetadionu" (ang. „trimethadione syndrome"). Podobnie jak przy difenylohydantoinie, w skład tego zespołu wchodzi także opóźnienie rozwoju fizycznego i umysłowego (65-67).
Leki psychotropowe oraz uspokajające także podejrzewane są o wywoływanie wad wrodzonych. Na listę teratogenów zostały włączone psychotropowa fenotiazyna oraz lit. Wprawdzie dane o teratogennym działaniu fenotiazyny są sprzeczne, to jednak nie ma wątpliwości co do litu (56). Panuje powszechne przekonanie, że stosowanie tych leków w okresie ciąży stanowi czynnik wysokiego ryzyka pojawienia się wad wrodzonych.
Podobne obserwacje dotyczą leków uspokajających: meprobamatu, tlenku chlorodiazepiny (chlordiazepoxide) i diazepiny (Valium). Oceniono, że poważne anomalie wystąpiły u 12% dzieci urodzonych przez matki zażywające meprobamat i u 11% dzieci urodzonych przez matki stosujące chlorodiazepinę. Procent dzieci z wadami urodzonych przez matki, które nie stosowały tych leków, wynosił jedynie 2,6% (68). Podobnie badania retrospektywne wykazały czterokrotny wzrost liczby przypadków rozszczepu wargi, połączonych niekiedy z rozszczepem podniebienia, wśród potomstwa matek stosujących w okresie ciąży diazepam w stosunku do dzieci matek nie używających tego środka.
Oprócz wymienionych tu czynników należy brać pod uwagę możliwość szkodliwego działania na zarodek lub płód wielu innych leków (55, 59, 69). Najważniejszymi z nich są: propylotiouracyl i jodek potasu (powodujące powstanie wola i niedorozwój umysłowy), streptomycyna, wywołująca głuchotę, sulfonamidy, powodujące powstawanie żółtaczki typu mózgowego, antydepresyjny lek imipramina, wywołujący uszkodzenia kończyn, tetracykliny, powodujące anomalie w obrębie układu szkieletowego i uzębienia, amfetaminy (rozszczep warg i podniebienia i anomalie w budowie serca), środek obniżający krzepliwość krwi — warfarin (powoduje chondrodysplazję i mikrocefalię) oraz chinina, powodująca głuchotę. Coraz więcej danych przemawia za tym, że Aspiryna (salicylat), lek najpowszechniej stosowany w okresie ciąży, przyjmowana w dużych dawkach wywiera szkodliwe działanie na rozwój potomstwa (70).
Stale rosnącym problemem naszych czasów jest stosowanie środków narkotycznych, jak LSD (dietyloamid kwasu lyserginowego), PCP (fenylocy-klidyna), marihuana, alkohol i kokaina. Odnotowano przypadki uszkodzeń kończyn oraz wady ośrodkowego układu nerwowego u potomstwa matek stosujących LSD (71, 72). Analiza wyników zawartych w ponad 100 publikacjach nie wykazała jednak, aby stosowanie LSD w dawkach umiarkowanych było czynnikiem teratogennym (73). Podobnie nie ma jednoznacznych dowodów teratogennego wpływu zażywania marihuany, PCP i palenia tytoniu. Nie ma jednak wątpliwości, że nałogowe palenie papierosów w okresie ciąży powoduje obniżenie wagi noworodków. Także ostatnie analizy przypadków wad wrodzonych dzieci matek zażywających w okresie ciąży PCP wskazują na wyraźny związek między jego stosowaniem a wadami wrodzonymi (74).
Dobrze udokumentowany jest wpływ spożywania alkoholu na występowanie wad wrodzonych. Uszkodzenia wywołane alkoholem obejmują anomalie mózgoczaszki (niedorozwój szczęki, zwężenie szpary powiekowej), deformacje kończyn (zmiany ruchomości stawów) i układu naczyniowo-sercowego (zaburzenia w budowie przegrody międzykomorowej). Uszkodzenia te, wraz z opóźnieniem rozwoju fizycznego i umysłowego, składają się na zespół „poalkoholowej choroby płodu" lub płodowy zespół poalkoholowy (ang. fetal alcohol syndrome) (75) (ryć. 8-1). Nawet umiarkowane używanie alkoholu w okresie ciąży jest szkodliwe dla rozwoju zarodka (76).
Ostatnio wykazano pojawienie się charakterystycznych uszkodzeń płodu w następstwie stosowania analogu witaminy A — izotretinoiny (kwas 13-cis-retinowy). Zmiany te określa się mianem embriopatii izotretinoinowej lub embriopatii witaminy A (77). Lek, przepisywany przy leczeniu wyprysków torbielowatych oraz innych przewlekłych dermatoz, okazał się silnym środkiem teratogennym. Wywołane tym lekiem uszkodzenia płodu obejmują niedorozwój uszu, spłaszczenie nosa, niedorozwój szczęki, rozszczep podniebienia, wodogłowie, uszkodzenie serca i pnia naczyniowego.
HORMONY
Czynniki androgenne
Syntetyczne progestageny są często stosowane w okresie ciąży w celu zapobieżenia poronieniom. Progestageny etisteron i noretisteron mają wyraźne

Ryć. 8-1. Zdjęcie dziecka z „płodowym zespołom poalkoholowym". A, Ciężki przypadek. B, Dziecko dotknięte w niewielkim stopniu. Należy zwrócić uwagę na wąskie szpary powiekowe i niedorozwiniętą szczękę u obojga dzieci. Zwykle uszkodzenie poalkoholowe obejmuje także inne anomalie w obrębie trzewioczaszki. Powszechnymi objawami płodowego zespołu poalkoholowego są wady sercowo-naczyniowe oraz zniekształcenia w obrębie kończyn. (Dzięki uprzejmości Dr. Davida Smitha z Department of Pediatrics Uniwersytetu w Waszyngtonie).
działanie androgenne i mogą wywoływać maskulinizację narządów płciowych u płodów płci żeńskiej (78). Anomalie dotyczą przerostu łechtaczki i zaburzeń związanych z fuzją guzków wargowo-mosznowych. Podobne zmiany uzyskano doświadczalnie, podając progestageny ciężarnym szczurzycom (79).
Dietylostilbestrol
Dietylostilbestrol, syntetyczny estrogen, był w latach 1940-1950 powszechnie stosowanym lekiem zapobiegającym poronieniom. Tego typu postępowanie zarzucono jednak w roku 1971 po stwierdzeniu u młodych kobiet w wieku 16-22 lat, poddanych in utero działaniu dietylostilbestrolu, znacznego wzrostu zapadalności na raka pochwy i raka szyjki macicy (80-82). W znacznym procencie przypadków u kobiet tych pojawiły się dysfunkcje rozrodcze spowodowane, przynajmniej częściowo, przez wady wrodzone macicy, jajowodów i sklepienia pochwy (83-85). Płody pici męskiej, narażone in utero na działanie dietylostilbestrolu, także wykazały wzrost wskaźnika wad wrodzonych, głównie w zakresie jąder i spęrmatogenezy. W przeciwieństwie do kobiet u mężczyzn nie stwierdzono jednak zwiększonego ryzyka rozwoju nowotworów narządów rozrodczych (86).
Kortyzon
Wyniki badań doświadczalnych wielokrotnie wykazywały, że kortyzon, podawany w pewnych okresach ciąży, powoduje w wysokim procencie przypadków rozszczep podniebienia u potomstwa myszy i królic (87, 88). U ludzi jednak nie udało się wykazać powiązania pomiędzy podawaniem kortyzonu ciężarnym kobietom a występowaniem rozszczepu podniebienia.
Cukrzyca matek
Zaburzenia metabolizmu węglowodanów u kobiet ciężarnych chorych na cukrzycę wywołują w znacznym procencie porody martwych dzieci, zgony noworodków, nienormalnie duże płody i różnego rodzaju wady wrodzone u dzieci. Ryzyko występowania wad wrodzonych u dzieci urodzonych przez matki chore na cukrzycę jest 3-4-krotnie wyższe niż u dzieci matek bez cukrzycy. U kobiet z długotrwałą cukrzycą wady wrodzone występują aż u 80% potomstwa (89-92). Wady spowodowane istnieniem cukrzycy u matki są rozmaite, dotyczą serca, układu szkieletowego oraz ośrodkowego układu nerwowego (91, 92). Uszkodzenia układu szkieletowego polegają na całkowitym lub częściowym niedorozwoju kręgów krzyżowych, połączonym z niedorozwojem kończyn dolnych (tzw. zespół zaniku ogonowego, ang. caudal regression syndrome) (93-96). Czynniki odpowiedzialne za te deformacje nie zostały jeszcze scharakteryzowane, ale pewne dane wskazują, że znaczny udział w powstawaniu tych wad odgrywa poziom glukozy i insuliny (97- 100). Pod tym względem stwierdzono znamienną korelację pomiędzy stopniem zaawansowania i czasem trwania cukrzycy a wskaźnikiem występowania wad wrodzonych. Ponadto u kobiet, które miały zaburzenia gospodarki węglowodanowej i urodziły dziecko z wadą rozwojową, po leczeniu insuliną lub preparatami tarczycy, czy oboma lekami naraz, następne ciąże wykazują mniej poronień, urodzeń martwych dzieci lub noworodków z wadami wrodzonymi. Nie da się jednak udowodnić, że kobiety te nie urodziłyby dzieci normalnych bez takiego leczenia.
NIEDOBORY POŻYWIENIA
Choć wiele niedoborów w pożywieniu, szczególnie brak witamin, okazało się na podstawie badań eksperymentalnych czynnikami teratogennymi, to jednak nie dysponujemy bezpośrednimi dowodami na ich tereatogenny efekt u ludzi. Z wyjątkiem endemicznego kretynizmu, związanego z brakiem jodu w ustroju matki, u ludzi nie stwierdzono analogii z wynikami doświadczeń na zwierzętach. (Wyczerpujący przegląd piśmiennictwa na temat wpływu niedoborów w pożywieniu na powstawanie wad wrodzonych u zwierząt doświadczalnych zawierają prace Kaltera i Warkany [13] oraz Hurleya [101]).
HIPOKSJA
Hipoksja (niedotlenienie) powoduje występowanie wad wrodzonych u bardzo wielu zwierząt doświadczalnych (102). Nie zostało to jednak udowodnione u ludzi.
Chociaż dzieci urodzone stosunkowo wysoko ponad poziomem morza ważą na ogół mniej i są drobniejsze niż dzieci urodzone blisko morza lub na jego poziomie, to jednak nie obserwuje się wśród nich zwiększonego wskaźnika wad wrodzonych (103). Ponadto chociaż kobiety ze schorzeniami sercowo-naczyniowymi, prowadzącymi do sinicy, często rodzą dzieci drobne, to jednak nie mają one wad wrodzonych.
CZYNNIKI CHEMICZNE ZWIĄZANE ZE ŚRODOWISKIEM NATURALNYM
Przed kilku laty stwierdzono, że w Japonii wiele matek, których główną dietę stanowiły ryby, rodziło dzieci z objawami neurologicznymi, przypominającymi pląsawicę mózgową. Okazało się, że ryby zawierały niezwykle wysoki poziom organicznych związków rtęci, uwalnianych przez przemysł ciężki do Zatoki Minamata i innych wód przybrzeżnych (104, 105). Wiele spośród tych matek nie wykazywało żadnych objawów zatrucia rtęcią, co sugerowało, że płody były bardziej niż matki wrażliwe na działanie rtęci. Podobne obserwacje poczyniono w USA, gdzie kobiety ciężarne spożywały mięso ze świń karmionych kukurydzą zaprawianą środkami przeciwgrzybiczymi, zawierającymi rtęć (106). Także w Iraku kilka tysięcy dzieci urodziło się z wadami prawdopodobnie w następstwie spożywania przez matki ziarna zaprawianego preparatami przeciwgrzybiczymi, zawierającymi rtęć (107).
Wśród pestycydów najczęściej wiązany z teratogennością jest preparat defoliacyjny 2,4,5-T (orange factor). Zarzuty o jego toksyczności dla zarodków pochodziły z Wietnamu, szwedzkiej Laponii oraz z Arizony (USA). Przeprowadzone na skutek tych podejrzeń wyczerpujące badania wpływu pestycydu 2,4,5-T na reprodukcję u ssaków nie wykazały, aby preparat ten był teratogenny dla ludzi (108). Żadna z obecnie opublikowanych prac nie sugeruje, że dostępny na rynku pestycyd 2,4,5-T był niebezpieczny dla reprodukcji u ludzi.
Czynniki chromosomalne i genetyczne
Prawidłowa komórka somatyczna człowieka zawiera 46 chromosomów. Odchylenia od tej liczby, wykrywane u niektórych pacjentów, są określane jako anomalie numeryczne lub liczbowe (ang. numerical abnormalities) (109). Niektóre z tych anomalii dotyczą autosomów — zwykle chodzi o chromosom dodatkowy; inne dotyczą chromosomów płciowych, najczęściej chromosomu X.
Jeżeli w komórce występuje chromosom dodatkowy, a więc zamiast pary występują trzy chromosomy, to osobnika takiego nazywamy trisomicznym dla danego chromosomu, a sytuację taką określa się mianem trisomii. Znamy cztery takie sytuacje: (a) trisomia 21, (b) trisomia 17-18, (c) trisomia 13-15 i (d) trisomia X. Sytuacje, kiedy brakuje jednego chromosomu, określa się mianem monosomii. To zaburzenie należy jednak do rzadkości (110).
Ryć. 8-2. A i B, fotografie przedstawiają dzieci z zespołem Downa. Zespól ten charakteryzują następujące cechy: płaska, szeroka twarz, skośnie biegnące bruzdy palczaste, zmarszczka nakątna (epicanthus), pomarszczona warga dolna, szerokie dłonie z poprzecznie przebiegającą bruzdą (tzw. małpia bruzdą) (C). Dzieci z zespołem Downa wykazują często opóźnienia w rozwoju umysłowym i wrodzone wady serca.
ZABURZENIA W OBRĘBIE CHROMOSOMÓW AUTOSOMALNYCH
Trisomia 21
Ten stan spowodowany nierozejściem się (nondysjunction) chromosomów podczas mejozy (patrz Rozdział 1) stwierdza się w komórkach somatycznych chorych z zespołem Downa (mongolizmem) (111,112).
Częstość pojawienia się zespołu Downa wzrasta z wiekiem matki i w większości przypadków (75%) jest wynikiem zaburzeń mejozy w owogenezie, a nie w spermatogenezie. U matek młodych, w wieku poniżej 25 lat, jeden przypadek zespołu Downa przypada średnio na około 2000 urodzeń, natomiast u matek starszych, w wieku powyżej 40 lat, wskaźnik ten wynosi w przybliżeniu l na 100 urodzeń (113-115). Dzieci z zespołem Downa wykazują charakterystyczne zmiany na twarzy (twarz mongoidalna), na dłoniach mają dużą, poprzeczną bruzdę, zwaną małpią bruzdą, wykazują często opóźnienie rozwoju fizycznego i umysłowego i cierpią z powodu wrodzonych wad serca (ryć. 8-2). Niekiedy zespół Downa jest spowodowany translokacją chromosomu 21, a nie jego trisomią (116-119).
Trisomia 17-18
U pacjentów z takim zaburzeniem chromosomowym stwierdza się następujące wady: opóźnienie rozwoju umysłowego, wole wrodzone, niskie osadzenie uszu, wygięcia palców i rąk (ryć. 8-3) (120,121). Ponadto u pacjentów tych często spotyka się mikrognację (niezwykle mała żuchwa lub szczęka), anomalie w budowie nerek, syndaktylię (zrośnięcie się palców) i inne deformacje układu szkieletowego. Częstość występowania trisomii 17 — 18 wynosi około 0,3 na 1000 urodzeń Dzieci z tą trisomią umierają na ogół w wieku 2 miesięcy.

Ryć 8-3. Zdjęcie przedstawiające dziecko z trisomią chromosomu 18. Należy zwrócić uwagę na wystające ciemię, niedorozwój żuchwy, nisko osadzone uszy oraz jeden lub kilka zgiętych palców. (Dzięki uprzejmości Dr Miller z Department of Neurology Uniwersytetu w Wirginii).
Trisomia 13-15
Głównymi zaburzeniami w tym zespole są: opóźnienie rozwoju umysłowego, głuchota, wrodzona wada serca, rozszczep wargi i podniebienia, zmiany w obrębie gałki ocznej, takie jak mikroftalmia, anoftalmia (brak oczu) i szczelina tęczówki lub powieki — coloboma (122) (ryć. 8-4). Zespół ten występuje z częstością około 0,2 przypadków na 1000 noworodków. Większość niemowląt z tym zespołem umiera w wieku 3 miesięcy.
ZABURZENIA CHROMOSOMOWE W PRZYPADKACH PORONIEŃ
W celu sprawdzenia, czy istnieje związek pomiędzy występowaniem zaburzeń chromosomowych a poronieniami dokonano wnikliwej analizy poronień samoistnych (123). Wskaźnik występowania zaburzeń chromosomowych w przypadkach poronień wahał się w szerokich granicach, od 10% do 46%. Bez względu jednak na to, która wartość jest wiarygodniejsza, procent anomalii chromosomowych w przypadkach poronień jest z pewnością 50 razy wyższy niż u płodów donoszonych. Zaburzenia chromosomowe dotyczyły zarówno chromosomów autosomal-

Ryc. 8-4. A, Zdjęcie dziecka z trisomią 13-15. Należy zwrócić uwagę na rozszczep wargi i podniebienia, spłaszczone czoło i małe gałki oczne (mikroftalmia). B, Zespołowi temu towarzyszy często polidaktylia (palce dodatkowe). (Dzięki uprzejmości Dr j. Miller z Department of Neurology Uniwersytetu w Wirginii).
nych, jak i chromosomów płciowych. Najczęściej spotykaną monosomią w przypadkach poronień samoistnych wydaje się monosomia chromosomu X.
ZABURZENIA W OBRĘBIE CHROMOSOMÓW PŁCIOWYCH
Analiza chromosomowa wykazała, że niektóre przypadki bezpłodności związane są z występowaniem nienormalnego zestawu chromosomów płciowych. Podobnie jak w przypadkach zaburzeń chromosomów autosomalnych, również zaburzenia w zakresie chromosomów płciowych prawdopodobnie są spowodowane nierozdzieleniem się (ang. nondisjunction) chromosomów (patrz Rozdział 1).
Zespół Klinefeltera
Objawy kliniczne tego zespołu, spotykanego tylko o osobników płci męskiej, to: niepłodność, niedorozwój jąder, zmiany szkliste w obrębie kanalików nasiennych krętych oraz dość często ginekomastia (powiększenie gruczołów mlekowych) (124). Komórki somatyczne zawierają 47 chromosomów, w tym zestaw chromosomów płciowych typu XXY, a ciałka chromatyny płciowej (tzw. ciałka Barr — przyp. tłum.) stwierdza się w około 80% przypadków (125). W normalnej populacji zespół ten występuje z częstością l na 500 urodzeń osób pici męskiej (126- 128). Wśród osób upośledzonych umysłowo wskaźnik ten jest znacznie wyższy i wynosi l na 100 (129). Na podstawie analizy statystycznej ocenia się, że najczęstszą przyczyną tego zespołu jest nierozdzielenie się homologów XX. Niekiedy jednak u pacjentów z zespołem Klinefeltera występuje 48 chromosomów, to jest 44 autosomy i 4 chromosomy płciowe (XXXV) (130) (ryć. 1-4), lub kilka innych nieprawidłowych zestawów chromosomów, zwanych mozaikowatością (131).
Zespół Turnera
Ten zespół, występujący u kobiet o niewątpliwych cechach fenotypowych żeńskich, charakteryzuje się niedorozwojem jajników (dysgenezja gonad). Inne, często występujące odchylenia od normy to kark błoniasty (ang. webbed neck), obrzęki kończyn dolnych spowodowane zastojem limfy, zniekształcenia w obrębie układu szkieletowego i opóźnienie w rozwoju umysłowym (ryć. 8-5). Pomimo kobiecego wyglądu tych pacjentek prawie wszystkie ich komórki zawierają tylko 45 chromosomów, przy czym zestaw chromosomów płciowych stanowi X0 (132. 133). Na podstawie analizy genetycznej stwierdzono, że najczęstszą przyczyna tego zespołu jest brak rozdzielenia się chromosomów w czasie mejozy w gametach męskich. Podobnie jak u pacjentów z zespołem Klinefeltera, także u pacjentów z zepolem Turnera może występować mozaikowatość. W normalnej populacji na 3000 kobiet spotyka się dwa przypadki o genotypie X0. Wskaźnik ten jest taki sam dla kobiet umysłowo chorych.
Zespół potrójnego chromosomu X (trisomia X)
Pacjentki z zespołem potrójnego chromosomu X są infantylne, wykazują różnego stopnia zahamowanie rozwoju umysłowego i skąpo miesiączkują (134). W komórkach występują dwa ciałka chromatyny płciowej, stąd też niekiedy kobietę
Ryć. 8-5. Zdjęcie pacjenta z zespołem Turnera. Główną cechą charakteryzującą ten zespól jest wyraźny fałd na skórze karku (kark błoniasty), niska sylwetka, szeroka klatka piersiowa i niewystępowanie dojrzałości płciowej. (Dzięki uprzejmości Dr Miller z Department of Neurology Uniwersytetu w Wirginii).
taką określa się mianem „nadkobiety". Zespół potrójnego chromosomu X spowodowany jest zapłodnieniem owocytu XX przez plemnik, zawierający chromosom X. Niektóre pacjentki z tym zespołem są płodne, a ich potomstwo, co stanowi zaskoczenie, jest normalne. Teoretycznie, pacjentki z potrójnym chromosomem X powinny produkować jednakową liczbę owocytów zawierających jeden lub dwa chromosomy X. Zapłodnienie nieprawidłowego owocytu XX powinno prowadzić do wytworzenia zygoty typu XXX lub XXY.
ZABURZENIA STRUKTURY CHROMOSOMÓW
Oprócz zaburzeń liczby chromosomów autosomowych i płciowych odrębną kategorię zaburzeń stanowią zmiany w budowie chromosomów wywołane ich rozerwaniami i złamaniami. Te złamania wywołane są takimi czynnikami, jak wirusy, napromieniowanie lub stosowane leki. Skutek złamania chromosomu zależy od tego, co stanie się z oderwanym chromosomem.
W niektórych przypadkach złamany fragment chromosomu zostaje zgubiony i dzieci z częściowymi ubytkami chromosomowymi (delecją) wykazują uszkodzenia. Dobrze jest opisany „zespół miauczenia kota" (cri du chat syndrome), wywołany częściowym ubytkiem jednego z chromosomów pary 4-5. W zespole tym płacz dziecka przypomina miauczenie kota, mogą występować mikrocefalia i opóźnienie rozwoju umysłowego oraz wrodzone wady serca. Opisano również wiele innych, stosunkowo rzadkich zespołów, spowodowanych częściową utratą innych chromosomów (135).
USZKODZENIA GENÓW
Od dawna wiadomo, że wiele wad wrodzonych u ludzi jest dziedzicznych i niektóre z nich dziedziczą się według praw Mendla. W wielu przypadkach wady te związane są bezpośrednio ze zmianą pojedynczego genu — stąd nazwa mutacja pojedynczego genu lub jednogenowa. Szacuje się, że u ludzi uszkodzenia tego typu odpowiadają za około 10% wszystkich wad wrodzonych (136-138).
Oprócz wywoływania wad wrodzonych, znajdowanych przy urodzeniu jako wyraźne zniekształcenia strukturalne, zaburzenia w obrębie poszczególnych genów mogą prowadzić do powstania całego szeregu wrodzonych wad metabolicznych. Spośród nich najlepiej poznanymi są takie wady metaboliczne, jak fenyloketonuria (139), homocystynuria (zaburzenia metabolizmu aminokwasów zawierających siarkę, wywołane brakiem aktywności enzymu syntetazy cysternowej — przyp. tłum.) i galaktozemia. Wadom tym często towarzyszy opóźnienie rozwoju umysłowego lub też są one jego przyczyną. Szczegółowe omówienie błędów metabolicznych, wywołanych zaburzeniami genetycznymi, wykracza jednak poza ramy tego podręcznika.
Działanie teratogenów
Z danych dotyczących działania czynników teratogennych u ssaków wynika kilka głównych zasad (140). Chociaż przedwcześnie byłoby nazywać je „prawami", należy uwzględniać je przy rozważaniu prawdopodobieństwa wystąpienia wad pod wpływem danego czynnika teratogennego.
l Wrażliwość na czynnik teratogenny zależy od stadium rozwoju zarodka. Rozwój ssaków rozpoczyna się od szybkiego namnażania komórek bardzo mało zróżnicowanych. Okres ten, trwający od zapłodnienia do wytworzenia listków zarodkowych, określa się jako stadium poprzedzające różnicowanie lub stadium przed powstaniem listków zarodkowych (ang. predifferentiation stage lub pregerm layer stage).
Następny etap nazwany jest stadium zarodkowym (ang. embryonic stage), w którym zaczynają się ujawniać różnice morfologiczne, wywołane zmianami na poziomie chemicznym.
Stadium końcowe lub płodowe, charakteryzuje się wytwarzaniem układów narządowych (ryć. 8-6).
Panuje powszechne przekonanie, że działanie teratogenu, przypadające na okres przed powstaniem listków zarodkowych, powoduje uszkodzenie większości lub wszystkich komórek zarodka, prowadząc do jego obumarcia, albo uszkodzenia tylko części komórek. W tym ostatnim przypadku mechanizmy regulacyjne zarodka mogą ten ubytek naprawić, przez co nie musi dojść do powstania wady. Niektóre czynniki teratogenne, jak hiperwitaminoza A czy napromieniowanie, są wybitnie teratogenne w późniejszych stadiach rozwojowych, nie wpływając na rozwój zarodka we wczesnych fazach rozwoju (141 -143). Obecnie znamy tylko kilka przykładów, gdy czynnik teratogenny działając w pierwszej fazie rozwoju
Ryć. 8-6. Wrażliwość układów narządowych na działanie czynników teratogennych (słupki pełne oznaczają okres szczególnej wrażliwości). PRE-ORGANOCENESIS — przed organogenezą; EMBRYONIC PERIOD (weeks) — okres zarodkowy (tygodnie); FETAL PERIOD (weeks) — okres płodowy (tygodnie); FERTILIZATION TO BILAMINAR DISC FORMATION — od zapłodnienia do wytworzenia dwublaszkowej tarczy zarodkowej; CENTRAL NERVOUS SYSTEM — ośrodkowy układ nerwowy; HEART — serce; EAR — ucho; EYES — oczy; U. LIMB — kończyna górna; L. LIMB — kończyna dolna; LIP — warga; TEETH — zęby; PALATE — podniebienie; EXTERNAL GENITALIA — zewnętrzne narządy płciowe; DEATH — śmierć; MAJOR MALFORMATIONS — poważne zniekształcenia; FUNCTIONAL DEFECTS AND MINOR MALFORMATIONS — uszkodzenia czynnościowe oraz nieznaczne zniekształcenia
doprowadzał do powstania wad wrodzonych (144). Równie dobrze jednak można przyjąć, że teratogeny pozostają w tkankach matczynych i aktywują się wraz ze wzrostem wrażliwości zarodka w dalszych etapach jego rozwoju.
Podczas stadium rozwoju zarodkowego, tzn. w okresie intensywnego różnicowania się komórek, większość czynników teratogennych staje się bardzo niebezpieczna i doprowadza do powstania wad wrodzonych. Rodzaj wywołanych uszkodzeń zależy jednak od tego, który narząd w okresie działania teratogenu jest na jego działanie najbardziej wrażliwy. Każdy narząd we wczesnych etapach różnicowania ma swój ściśle określony przedział wrażliwości (ryć. 8-6). Przekonano się o tym dzięki badaniom, przeprowadzonym na szczurach, będących na diecie pozbawionej kwasu foliowego (kwasu pteroiloglutaminowego, witaminy M) (145, 146). Niedobór tego kwasu w 7-9 dniu ciąży doprowadzał do powstania uszkodzeń w zakresie ośrodkowego układu nerwowego oraz serca; w 9-11 dniu do powstania wad w układzie moczowym, szkieletowym i naczyniowym; w dniu 11-14 — tylko do uszkodzeń w obrębie układu szkieletowego. Podobna zależność występuje u ludzi w odniesieniu do wirusa różyczki. W zależności od dnia trwania ciąży wirus ten uszkadza różne narządy, każdy w jego okresie krytycznym (20).
W okresie trzecim, czyli płodowym, w którym następuje powstawanie narządów (organogeneza), gwałtownie spada wrażliwość na działanie czynników teratogennych. Nieduża liczba narządów, jak móżdżek, kora mózgu oraz niektóre elementy układu moczowo-płciowego kontynuują jednak w tym okresie różnicowanie, wobec czego pozostają wrażliwe na działanie czynników teratogennych aż do końca ciąży. I rzeczywiście, traktowanie myszy znajdujących się w późnych etapach ciąży lóżnymi czynnikami chemicznymi prowadziło do powstania poważnych uszkodzeń kory mózgu (147,148). Nie ma powodu sądzić, że u ludzi czynniki środowiskowe nie mogą także być szkodliwe dla rozwijającego się mózgu w drugiej połowie ciąży, a także i w okresie pourodzeniowym, a tym samym wywoływać zahamowanie rozwoju umysłowego i inne zaburzenia mózgowe.
2 Wpływ czynników teratogennych zależy od genotypu. Wiele danych doświadczalnych wskazuje na to, że czynniki teratogenne zwiększają wartości wskaźników wad występujących spontanicznie, tzn. bez udziału czynnika teratogennego, a więc że u podstaw tego zwiększenia leży niestabilność genetyczna. Na przykład podanie odpowiedniej dawki kortyzonu ciężarnym myszom szczepu A i C57, u których wskaźniki spontanicznie występującego rozszczepu podniebienia wynoszą odpowiednio 10% oraz poniżej l %, powoduje pojawienie się tej wady u 100% potomstwa szczepu A i u 19% potomstwa szczepu C57. Pokrycie samcami C57 samic szczepu A powoduje wystąpienie rozszczepu u 43% potomstwa. Natomiast jeżeli samice szczepu C57 zostaną skrzyżowane z samcami szczepu A, to wskaźnik potomstwa, wykazującego rozszczep podniebienia spada do 4%. Świadczy to o tym, że zarówno geny matczyne, jak i geny zarodka mają wpływ na wrażliwość na czynnik teratogenny (149- 151).
3 Czynniki teratogenne działają swoiście na danym etapie metabolizmu. Mogą one wpływać na szereg funkcji komórek lub na ich produkty. Mogą hamować syntezę kwasów nukleinowych lub białek, zmieniać istotę międzykomórkowa lub uszkadzać cytoarchitektonikę komórek zarodka. Wpływ tych czynników nie ogranicza się do pojedynczego procesu komórkowego, dlatego też w wiek przypadkach mechanizmy leżące u podstaw działania tych czynników są trudne do określenia.
STRESZCZENIE
Na różnicujący się i rosnący zarodek wpływa wiele czynników. W wyniku ich działania niekoniecznie musi dochodzić do powstawania widocznych wad wrodzonych. W pewnych przypadkach czynniki teratogenne mogą być tak toksyczne lub uszkadzać ważne dla życia zarodka czy płodu narządy, że doprowadza to do jego obumarcia. W innych przypadkach wpływ czynników teratogennych może być tak łagodny, że zarodek lub płód może przeżyć, a tylko niektóre jego narządy mogą ulec uszkodzeniu. Może to doprowadzić do częściowego lub całkowitego zahamowania wzrostu lub uszkodzeń czynnościowych, takich jak np. opóźnienie rozwoju umysłowego.
Znamy wiele czynników, które są odpowiedzialne za wady wrodzone u około 2-3% żywo urodzonych niemowląt. Do czynników tych zalicza się wirusy, takie jak: wirus różyczki i cytomegalii; napromieniowanie; leki, takie jak: thalidomid, aminopteryna, przeciwdrgawkowe, psychotropowe, antydepresyjne, środki odurzające w rodzaju PCP (fencyklidyna), papierosy i alkohol; hormony, np. dietylostilbestrol; cukrzyca matek oraz zaburzenia chromosomowe, jak trisomia chromosomu 21 (zespól Downa). W przypadku napromieniowania lub działania czynników chemicznych powstanie uszkodzeń zależy od tego, w jakim okresie rozwoju płodu i etapie różnicowania narządu czynniki te działały. Chociaż powstawanie wad wrodzonych przypisywane jest wielu określonym czynnikom, to jednak naprawdę mało wiemy na temat czynników wywołujących uszkodzenia oraz sposobów zapobiegania tym wadom lud odwracania efektu uszkodzenia. Stąd też medycznym podejściem do tego problemu jest albo naprawa uszkodzeń po urodzeniu, albo wczesne wykrywanie uszkodzeń — dzięki amniocentezie, oznaczaniu alfa-fetoproteiny lub badaniom ultrasonograficznym — i eliminowanie tych zarodków, które wykazu ją. poważne uszkodzenia.
Tabela 8-1.
Związek teratogenów z wadami wrodzonymi u ludzi
Czynnik teratogenny |
Charakter wad wrodzonych |
Czynniki zakaźne |
|
Różyczka |
Zaćma, jaskra, wady serca, głuchota |
Wirus cytomegalii |
Mikrocefalia, ślepota, opóźnienie rozwoju umysłowego |
Wirus opryszczki |
Mikroftalmia, mikrocefalia, dysplazja siatkówki |
Toksoplazmoza |
Wodogłowie, ogniska zwapnień w mózgu, mikroftalmia |
Kila |
Opóźnienie rozwoju umysłowego, głuchota |
Czynniki fizyczne |
|
Promieniowanie rtg |
Mikrocefalia, rozszczep kręgosłupa, rozszczep podniebienia, uszkodzenia kończyn |
Hipertermia |
Wrodzony brak mózgu |
Czynniki chemiczne |
|
Thalidomid |
Uszkodzenia kończyn, wady serca |
Aminopteryna |
Wrodzony brak mózgu, wodogłowie, rozszczep warg i podniebienia |
Trimetadion |
Rozszczep podniebienia, wady serca, zaburzenia układu moczowo-plciowego i szkieletowego |
Difenyiohydantoina (Fenytoina) |
Tzw. płodowy zespól hydantoiny: uszkodzenia twarzy, opóźnienie rozwoju umysłowego |
Lit |
Wady serca |
Amfetamina |
Rozszczep warg i podniebienia, uszkodzenia serca |
LSD |
Uszkodzenie kończyn i ośrodkowego układu nerwowego |
Warfaryna |
Chondrodysplazja, mikrocefalia |
Alkohol |
Tzw. płodowy zespół poalkoholowy: krótkie szpary powiekowe, niedorozwój szczęki, wady serca |
Isotretinoina (Witamina A) |
Embriopatia z niedoboru witaminy A: małe uszy o nieprawidłowym kształcie, niedorozwój żuchwy, rozszczep podniebienia, wady serca |
Organiczne związki rtęci |
Różnorodne objawy neurologiczne, przypominające porażenie mózgowe |
Hormony |
|
Czynniki androgenne (etisteron, noretisteron) |
Maskulinizacja narządów rozrodczych żeńskich: zrośnięcię się warg sromowych, przerost łechtaczki |
Dietylostilbestiol (DES) |
Anomalie anatomiczne macicy, jajowodów i sklepienia pochwy; nowotwory pochwy; zniekształcenia jąder |
Cukrzyca matek |
Różne rodzaje zniekształceń, najczęściej w obrębie serca i cewy nerwowej. |
Embriologia Saddlera
- 64 -
www.stomka.prv.pl
Wyszukiwarka
Podobne podstrony:
PO wyk07 v1
embriologia rozrodczy meski
s10 v1
s7 4 v1
s9 3a v1
Prezentacja v1
2 BO 2 1 PP Przykłady Segregator [v1]
Notice V1
BoeBot v1 0 id 91312 Nieznany (2)
19 Podwykonawcy i dostawcy v1 1id 18332
gmm v1 streszczenie
Omron Przewodnościowy regulator poziomu cieczy 61F D21T V1
embriologia test 2007 2008 plus odpowiedzi, Medycyna CMUJ, Embriologia
sem.2-Organogeneza, histologia i embriologia(1)
Embriologia materiały od mgr Gendek
więcej podobnych podstron