Zasady zaliczania ćwiczeń z chemii
Do ćwiczeń z chemii przystąpić mogą wyłącznie osoby, które zaliczyły część teoretyczną z tego przedmiotu.
Pracownia obejmuje zajęcia wprowadzające oraz pięć zajęć praktycznych.
Na pracowni chemicznej obowiązuje fartuch ochronny.
student zobowiązany jest do aktywnego uczestnictwa we wszystkich zajęciach praktycznych.
W przypadku nieobecność musi on przedłożyć prowadzącemu zajęcia, aktualne zwolnienie lekarskie a zaległe ćwiczenia odrobić w ustalonym terminie.
W przypadku jednej nieusprawiedliwionej nieobecności nastąpi skreślenie z listy studentów odrabiających ćwiczenia z chemii.
Maksymalna ilość punktów, którą można uzyskać za sprawozdanie wynosi 6 punktów a za wejściówkę wynosi 4 punkty.
Sumaryczna ilość punktów wymagana do zaliczenia nie może być niższa niż 25 punktów.
Jako forma zaliczenia przewidziane jest kolokwium końcowe, które odbędzie się po zakończeniu ćwiczeń.
Na ocenę końcową z ćwiczeń składać się będzie ocena z części praktycznej (sprawozdania) i teoretycznej (tzw. wejściówki) oraz wyniki z kolokwium końcowego.
Kolokwium poprawkowe odbędzie się w pierwszym terminie egzaminu z chemii.
Zabrania się korzystania z telefonów komórkowych w pracowni chemicznej.
Zakres obowiązującego materiału z chemii dla Studentów I roku Geologii UW
Ćwiczenie 1
omówienie regulaminu pracownie chemicznej, zasady BHP
zadania rachunkowe
zasady pisania sprawozdań
doświadczenia wstępne
Ćwiczenia 2
stała i stopień dysocjacji (prawo rozcieńczeń Ostwalda)
szybkość reakcji chemicznych
wykładniki stężeń jonów wodorowych (pH)
roztwory buforowe, pojemność buforowa
reakcje utleniania i redukcji
właściwości helowców
Ćwiczenia 3
stała i stopień dysocjacji (prawo rozcieńczeń Ostwalda)
wykładniki stężeń jonów wodorowych (pH)
hydroliza soli
związki koordynacyjne - budowa, właściwości
iloczyn rozpuszczalności, rozpuszczalność
właściwości wodoru
Ćwiczenie 4 - litowce, berylowce, borowce, węglowce (otrzymywanie sodu, glinu, ołowiu). Ogólne właściwości pierwiastków.
promień atomu, promień jonu
elektroujemność
energia jonizacji
występowanie w przyrodzie
związki z tlenem i wodorem
polimorfizm, izomorfizm
Ćwiczenie 5 - azotowce, tlenowce, fluorowce (otrzymywanie amoniaku, tlenu, siarki, chloru). Ogólne właściwości pierwiastków:
promień atomu, promień jonu
elektroujemność
energia jonizacji (?)
występowanie w przyrodzie (?)
związki z tlenem i wodorem (?)
polimorfizm, izomorfizm (?)
Zadania treningowe dla Studentów I roku Geologii
Sporządzona 0,2 molowy roztwór słabego elektrolitu o wzorze AB i stopniu dysocjacji 0,15%. Oblicz stężenie powstałych w roztworze jonów A+.
Na zobojętnienie 1 cm3 roztworu kwasu azotowego (V) zużywa się 20 mg NaOH. Oblicz stężenie molowe tego kwasu.
Do 250 g 18& roztworu NaCl dodano 110 g wody. Oblicz stężenie procentowe otrzymanego roztworu.
Z 300 g 20% roztworu odparowano 100 g rozpuszczalnika. Oblicz stężenie procentowe końcowego roztworu.
Do 100 cm3 0,1 molowego roztworu wodorotlenku sodu dodano 900 cm3 wody. Czy pH wzrosło czy zmalało i o ile?
Wodny roztwór HF zawiera 0,4 mola F‾ i 1,2 mola niezdysocjowanego HF. Oblicz stopień dysocjacji.
Jakie jest pH NaOH o stężeniu 0,001 mol/dm3?
Oblicz pH kwasu siarkowego Cm = 0,16 mol/l.
pH roztworu kwasu mrówkowo o stężeniu 0,25 mol/l wynosi 2,18. Oblicz stopień dysocjacji tego kwasu.
Do 500 ml 0,2 molowego roztworu HCl dodano 250 ml 10% NOH (d = 1,109 g/cm3). Oblicz pH roztworu po zmieszaniu.
10 ml 10% HCl o gęstości d = 1,0474 kg/l rozcieńczono wodą do objętości 750 ml. Oblicz pH roztworu.
Zmieszano 150 cm3 0,02 mol/dm3 CaCl2 i 50 cm3 0,01 mol/dm3 Na2CO3. Czy wytrąci się osad CaCO3? (KSO = 4,8*10-9)
Oblicz procentową zawartość żelaza w:
magnetycie (Fe3O4)
hematycie (Fe2O3)
syderycie (FeCO3)
Zbilansuj niedokończone równania reakcji w postaci cząsteczkowej. Napisz reakcje połówkowe w postaci jonowej. W razie potrzeby wprowadź jony H+, OH‾ a także H2O lub inne.
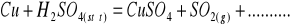
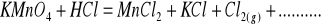
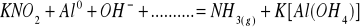
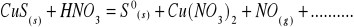

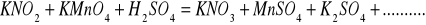
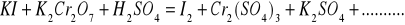
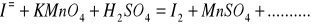
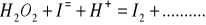
Napisz wzory następujących związków:
metafosforan (III) talu (I)
węglik glinu
ortoarsenina (V) wapnia
nadtlenek baru
chromian (VI) baru
heksahydroksoantymonian (V) sodu
hydroksodiaminamiedzian (I)
heksafluoroglinian (III) sodu
heksacyjanożelazian (II) żelaza (II) i potasu
tatraazotanoboran (III) sodu
Która z rud jest najbogatsza w żelazo?
Podaj nazwy następujących związków:
Konsultacje z chemii:
dr Dorota Wolicka środa 1200 - 1400
dr Marek Gola czwartek 1000 - 1200
dr Luiza Galbarczyk-Gąsiorowska piątek 1200 - 1400
mgr Roksana Maćkowska wtorek 1200 - 1400
mgr Marcin Jackowski poniedziałek 1715 - 1800
Wyszukiwarka
Podobne podstrony:
Zasady zaliczania ćwiczeń z chemii, chemia
Zasady zaliczenia ćwiczeń z, Studia, grafika
ZASADY ZALICZANIA ĆWICZEŃ AUD. z ekologii 2012-13, Semestr II, Ekologia, Ćwiczenia audytoryjne
Satystyka 2014 Zasady zaliczania ćwiczeń, STUDIA PŁ, TECHNOLOGIA ŻYWNOŚCI I ŻYWIENIA CZŁOWIEKA, ROK
Zasady zaliczenia pracowni z Chemii Ogólnej dla kierunku lekarskiego, ZASADY ZALICZENIA PRACOWNI Z C
Ćw.1 Wybrane reakcje chemiczne przebiegające w roztworach wodnych ćwiczenie 1, Chemia ogólna i żywno
TEMATY ĆWICZEŃ BUDOWNICTWO chemia, Tematy ćwiczeń z chemii
Rozkład ćwiczeń z chemii organicznej dla studentów I roku biotechnologii, chemia, organiczna
Kolokwium zaliczeniowe 1, Technologia chemiczna, Chemia fizyczna, Ćwiczenia
Kolokwium zaliczeniowe, Technologia chemiczna, Chemia fizyczna, Ćwiczenia, Kolokwium nr 1
ćw.4 zadania pH, Chemia ogólna i żywności, instrukcje do ćwiczen z chemii ogólnej i żywności na I se
Zasady zaliczania przedmiotu do zawieszenia dla ratownictwa, Ratownictwo Medyczne Studia, Giełda, 1.
Regulamin ćwiczeń i zasady zaliczenia przedmiotu - histologia 2010 2011, Regulamin ćwiczeń i zasady
Synteza do ćwiczenia z chemii metaloorganicznej, Chemia
zasady zaliczenia OAM 2011 2012, Rok I, Chemia organiczna
ćw.3 -alkacymetria, Chemia ogólna i żywności, instrukcje do ćwiczen z chemii ogólnej i żywności na I
ćw.1 kompleksy, Chemia ogólna i żywności, instrukcje do ćwiczen z chemii ogólnej i żywności na I sem
więcej podobnych podstron