Nr 1 |
Temat: Analiza termiczna |
Data wykonania 2004-03-2 |
Rok II Metalurgia Grupa IV
|
1.Marcin Maruta
2.Maciej Marczewski |
Ocena |
Wprowadzenie:
Fazą- nazywamy część układu, jednorodną pod względem chemicznym i krystalograficznym, oddzieloną od reszty powierzchnią rozdziału, czyli granicą międzyfazową.
Składniki- składnikami układu nazywamy substancje proste(np. pierwiastki) lub złożone (np. związki)nie ulegające przemianom, z których składają się fazy układu.
Stopnie swobody- liczba zewnętrznych i wewnętrznych czynników, które można zmieniać nie powodując zmiany liczby faz w układzie.
Układ równowagi- jeśli fazy znajdują się w równowadze termodynamicznej mówimy o układzie równowagi.
Reguła faz Gibbsa- za jej pomocą możemy określić liczbę stopni swobody. Jest to zależność między liczbą składników, liczbą faz i liczbą czynników określających stan faz w układzie równowagi;
Reguła faz Gibbsa ma postać:
s = n + 2 - f
gdzie:
s - ilość stopni swobody
n - ilość składników niezależnych
f - ilość faz
Reguła dzwigni-w celu określenia zawartości składników w fazach stopu pozostających w równowadze przeprowadza się przez punkt wskazujący skład stopu i jego temperaturę linię poziomą (konodę) aż do przecięcia się z najbliższymi liniami wykresu równowagi. Punkty przecięcia zrzutowane na oś układu określają składy faz pozostających pozostających równowadze. Długości odcinków konody między składem stopu i odpowiednich faz pozostających w równowadze są odwrotnie proporcjonalne do ilości tych faz.
Przebieg Ćwiczenia:
Materiały
-próbki do badań
-piec(temp. 450˚C)
-tygiel
-szczypce wyciągania próbek
-stojak
-termopara
-miliwoltomierz
-komputer z oprogramowaniem
Przebieg ćwiczenia
Badanie przeprowadzono w specjalnie przygotowanym do tego celu laboratorium. Próbki po wyciągnięciu szczypcami z pieca przenosiliśmy na tyglu do stanowiska pomiarowego. Do próbki wkładamy termoparę, która pokazuje mam temperaturę bieżącą. Mierzymy temperaturę krzepnięcia próbki w funkcji czasu. Wyniki odczytujemy na komputerze za pomocą specjalnego oprogramowania.
Wyniki:
Stop nr.1
Pb 38,1% Sn 61,9%
Na wykresie nie zaobserwowano żadnego punktu przegięcia. Badany stop jest stopem eutektycznym.
Stop nr.2
Pb 70% Sn 30%
Na wykresie zaobserwowano punkt przegięcia. Wyznaczono go z następujących równań:
y = -0,8202x + 449,61 ![]()
oraz y = -0,2859x + 320,95
x = 240,80104 y = 252,10499
Temperatura punktu przegięcia wyniosła 252oC
Badany stop jest stopem podeutektycznym.
Stop nr.3
Pb 79% Sn 21%
Na wykresie zaobserwowano punkt przegięcia. Wyznaczono go z następujących równań:
y = -0,6468x + 340,09 ![]()
oraz y = -0,2988x + 303,64
x = 104,74137 y = 272,34329
Temperatura punktu przegięcia wyniosła 272oC
Badany stop jest stopem podeutektycznym.
Analiza wyników:
Stop nr.2
Ochładzając stop, który jest całkowicie w fazie ciekłej do temperatury 252oC cztli do temeratury zetknięcia się z linią likwidus. W tej temperaturze zaczyna się wydzielanie pierwszych kryształków czystej substancji ( Pb ). Ochładzając aż do temperatury 183oC - czyli temperatury przemiany eutektycznej tego stopu skłąd stopu zmieniał się następująco: Przybywało stałych składnika ( Pb ), a ubywało cieczy o składzie zmieniającej się wzdłuż linii likwidus. Osiągając temperaturę przemiany eutektycznej wydziela się mieszanina eutektyczna zawierająca drobne kryształy czystych substancji ( Pb; Sn ). W tej temperaturze zakrzepnie ostatecznie badany stop. Na krzywej chłodzenia obserwuje się przystanek, jest on tym dłuższy, im bliżej punktu eutektycznego leży skład badanego stopu, gdyż tym większa będzie wówczas ilość cieczy krzepnącej w temperaturze eutektycznej. Poniżej tej temperatury w stopie zmienia się tylko stosunek zawartości faz, który można obliczyć z reguły dźwigni.
Obliczenia składu w różnych temperaturach:
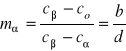
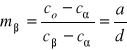
a b
d
a) W fazie ![]()
w temp. 200oC
co=30
c![]()
=18
c![]()
=54
a = 12
b = 24
d = 36
![]()
![]()
b) W fazie ![]()
w temp. 150oC
co=30
c![]()
=10
c![]()
=100
a = 20
b = 70
d = 90
![]()
![]()
c) W temp. Eutektycznej 183oC
co=30
c![]()
=19,2
c![]()
=97,5
a = 10,8
b = 67,5
d = 78,3
![]()
![]()
Stop nr.1
Ochładzając stop o składzie eutektycznym, który jest całkowicie w postaci ciekłej krzepnięcie rozpoczyna się w temperaturze eutektycznej 183oC i towarzyszyć będzie mu wydzielenie się faz stałych ![]()
i ![]()
. Proces krzepnięcia cieczy eutektycznej czyli: reakcja eutektyczna przedstawia się następującym wzorem: c ![]()
![]()
+ ![]()
Dopóki nie zakrzepnie ostatnia kropelka cieczy eutektycznej, trzy fazy są w równowadze termodynamicznej. Zgodnie z regułą faz układ faz jest inwariantny ( s = 0 ), a co za tym idzie eutektyk krzepnie
w stałej temperaturze eutektycznej.
Obliczenia składu w różnych temperaturach:
a) W temp. Eutektycznej 183oC
co=61,9
c![]()
=19,2
c![]()
=97,5
a = 42,7
b = 35,6
d = 78,3
![]()
![]()
b) W fazie ![]()
w temp. 150oC
co=61,9
c![]()
=10
c![]()
=100
a = 51,9
b = 38,1
d = 90
![]()
![]()
Wnioski:
Wykresy równowagi układów opracowuje się doświadczalnie badając kolejno poszczególne stopy o różnych składach chemicznych. Temperatury likwidusu i solidusu stopów stanowiących mieszaniny eutektyczne wyznacza się metodą analizy cieplnej sporządzając krzywe krzepnięcia oraz ( dla kontroli wyników ) topnienia stopu w układzie współrzędnych temperatura - czas. Załamanie górnego odcinka odpowiada temperaturze likwidusu, a poziomy odcinek krzywej - przystankowi temperatury, tj. temperaturze solidusu ( eutektycznej ). Temperatury solidusu stopów o budowie roztworów stałych wyznacza się innymi metodami jak elektryczną, radiograficzną lub metalograficzną, ponieważ analiza termiczna nie daje w tym przypadku dostatecznie dokładnych wyników. Krzywe rozpuszczalności granicznej i innych przemian w stanie stałym określa się różnymi metodami jak dilatometryczną, magnetyczną, elektryczną, radiograficzną lub metalograficzną. Po otrzymaniu całkowitych krzywych krzepnięcia i topnienia ( chłodzenia i nagrzewania ) wszystkich stopów, na ich podstawie sporządza się wykres równowagi układu.
Na krzywych termicznych chłodzenia często obserwuje się występujące w większym lub mniejszym stopniu ( zależnie od szybkości chłodzenia i kinetyki procesu krystalizacji ) zjawisko tzw. Przechłodzenia, w wyniku którego temperatura substancji może chwilowo spaść poniżej punktu krzepnięcia.
W momencie jednak wydzielenia się pierwszych kryształków fazy stałej, temperatura próbki wznosi się gwałtownie do poziomu, odpowiadającego punktowi krzepnięcia substancji. W naszym przypadku zaobserwowano w każdym z trzech przebiegów krzywej chłodzenia efekt przechłodzenia stopu.
Wyniki naszych pomiarów są dostatecznie dokładne. Wątpliwości budził sposób chłodzenia stopów. Nie był on umieszczony w urządzeniu chłodzącym, który by zapewnił nam stałą temperaturę chłodzenia, a co za tym idzie dokładniejszy pomiar. Wykonanie większej ilości prób z tymi samymi stopami oraz ich porównanie wpłynęło by pomyślnie na wyniki pomiarów.
Punkty przegięcia były mało widoczne a wyznaczenie ich wartości było bardzo przez to utrudnione. Następstwem tego były różnice w wartości temperatury przejścia, a potem składu stopu.
Wyszukiwarka
Podobne podstrony:
Metale nieżelazne-GEPARD, AGH, Podstawy Materialoznawstwa
03 - mikroskopowe badania odlewniczych stopw elaza, AGH, Podstawy Materialoznawstwa
Materiałoznawstwo ściąga Jola, AGH, Podstawy Materialoznawstwa
sprawozdanie materiały 2, AGH, Podstawy Materialoznawstwa
Metale nieżelazne.zawadzak, AGH, Podstawy Materialoznawstwa
05 - Mikroskopowe badania stopów metali nieżelaznych, AGH, Podstawy Materialoznawstwa
Metale nieżelazne, AGH, Podstawy Materialoznawstwa
Badania mikroskopowe stopów metali nieżelaznych (12), AGH, Podstawy Materialoznawstwa
analiza termiczna, AGH, Podstawy Materialoznawstwa
Metale nieżelazne-GEPARD, AGH, Podstawy Materialoznawstwa
Zad 25 10 11, AGH Imir materiały mix, Studia
Rekord?nych podstawowych materiału
termo 1, AGH Imir materiały mix, Studia
matmascigi, AGH Imir materiały mix, Studia
008 Podstawowe materiały stosowane do produkcji rękojeści
sprawko M4, AGH Imir materiały mix, Studia
pnom sprawko, AGH Imir materiały mix, Studia
Materiaoznawstwo - opracowany egzamin (termin o), AGH, 5 semestr, material
więcej podobnych podstron