TEMAT: PRZYGOTOWYWANIE I MIANOWANIE ROZTWORU KWASU SOLNEGO O STĘŻENIU 0.1 mol/dm3
1) Przygotowanie roztworu kwasu solnego o stęż. ok. 0.1 mol/dm3
Należy przygotować 500cm3 roztworu HCl o stężeniu około 0.1 mol/dm3 przez rozcieńczenie stężonego kwasu solnego o gęstości d=1,090 g/cm . Z tabeli odczytujemy stężenie procentowe tego kwasu , które wynosi Cp=18,43 % (m/m)
d=1,090 g/cm Cp=18,43 %
Obliczam ile gramów HCl zawiera się w 500cm3 roztworu:
MHCl=36,5
1000cm3 roztworu 1mol/dm3 zawiera - 36.5 g HCl =1 mol 500cm3 roztworu 0.l mol/dm3zawiera - x g HCl
xHCl= =1.825 g
Znając stężenie procentowe, obliczam ile gramów stężonego HCl zawiera 1,825 g czystego HCl:
w 100g roztworu kwasu HCl znajduje się 18,43 g HCl
w x g roztworu kwasu HCl znajduje się 1.825g HCl
x HCl = 9,90g
Korzystając z podanej gęstości stężonego kwasu solnego obliczam potrzebną objętość roztworu:
100cm3 roztworu kwasu waży 109 g
x cm3 roztworu kwasu waży 9,90 g
x = 9,08 cm3 ≈9,10 cm3
2) Mianowanie roztworu HCl
Do mianowania roztworu kwasu solnego używa się bezwodnego węglanu sodu .
Odważamy na wadze ok. 0.1g Na2CO3 ,następnie przenosimy naważkę do kolby stożkowej i rozpuszczamy w 20cm3 wody destylowanej, dodajemy 1- 2 krople oranżu metylowego i miareczkujemy (dwukrotnie)przygotowanym roztworem HCl do zmiany zabarwienia z barwy żółtej na pomarańczową.
Podczas miareczkowania zachodzi reakcja:
Na2CO3 + 2HCl → 2NaCl + CO2 + H2O
Z równania reakcji wynika, że 1 mol Na2CO3 reaguje z 2 molami , czyli 1 mol odpowiada ½ mola Na2CO3
Obliczenie stężenia molowego HCl:
˝ mola Na2CO3 - 1 mol HCl
53g Na2CO3 - 1 mol/dm3 * 1000
mNaCO - CHCl* VHCl
CHCl= mNa2CO3 * * 1 * 1000 / 53 * VHC
1 próba 2 próba
VHCl= 9, 10 cm3 VHCl= 9, 10 cm3
mNaCO = 0,1 mNaCO= 0,1
MNaCO=106 g/mol MNaCO=106 g/mol
CHCl= 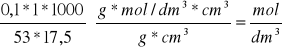
= 0,1078![]()
Szukane stężenie molowe kwasu solnego wynosi 0,1078 ![]()
.
1
2
Wyszukiwarka
Podobne podstrony:
Sprawozdanie 7 - Analiza ilościowa (miareczkowanie), Studia, Chemia
Potencjometryczne pomiary pH i miareczkowanie potencjometryc, Studia, Chemia fizyczna
ćw10 - Miareczkowanie konduktometryczne, studia, chemia fizyczna
Zestaw nr 6, Studia, chemia
Zestaw 7, Studia, chemia
tos2-2013d, Studia, chemia egzaminy
wapno, Budownictwo-studia, chemia
2 kationy, Studia, Chemia, chemia7
Reakcje jądrowe-podstawowe pojęcia, Studia, chemia jądrowa
chf wykład 6, Studia, Chemia, fizyczna, wykłady
ćw7 - Refrakcja i wyznaczanie momentu dipolowego, studia, chemia fizyczna
miareczkownie, NAUKA, chemia, lab
I Pracownia - zakres materiału, Studia - Chemia kosmetyczna UŁ, II rok, IV semestr, CHEMIA ORGANICZN
KOLOS kwasy tłuszcze 5, STUDIA, Chemia
nieorgany-pytania2, Studia - Chemia kosmetyczna UŁ, II rok, III semestr, CHEMIA NIEORGANICZNA labora
pytania z examinu, Studia, Chemia, ogólna, examin
Doc 12, Studia, Chemia, chemia7
tos2-2014a, Studia, chemia egzaminy
ligandy, Studia POLSL, STUDIA, Chemia nieorganiczna, teoria
więcej podobnych podstron