Zespół 1 |
Ćwiczenia z chemii fizycznej: „Przepływ prądu przez elektrolity. Wyznaczenie liczb przenoszenia metodą Hittorfa”
|
6 grudzień 1999 |
Piotr Czerwiński Tomasz Furtak |
||
Nr ćw: 9 |
ROK I , GRUPA I |
Uwagi: |
1. Cel ćwiczenia:
Zapoznanie się z przepływem prądu przez elektrolit oraz wyznaczenie liczb przenoszenia metodą Hittorfa.
2. Zagadnienia teoretyczne:
Katoda - nazywamy elektrodę na której zachodzi proces redukcji. W przypadku elektrolizy będzie to elektroda ujemna a ogniwa galwanicznego dodatnia.
Anoda - nazywamy elektrodę na której zachodzi proces utleniania. W przypadku elektrolizy będzie to elektroda dodatnia a ogniwa galwanicznego ujemna.
Przewodniki drugiego rodzaju - przewodzą one prąd dzięki ruchowi jonów , zwane również przewodnikami jonowymi lub elektrolitami (wodne roztwory soli , kwasów i zasad, stopione sole ).
Elektroliza - zespół zjawisk jaki zachodzi podczas przepływu prądu przez przewodnik jonowy.
Elektroda - jest to układ składający się z kontaktującego się ze sobą: przewodnika elektronowego i jonowego.
Stała Faradaja F = N * e
Pierwsze prawo Faradaja - masa substancji wydzielonej lub rozpuszczonej na elektrodzie w czasie elektrolizy jest proporcjonalna do ładunku elektrycznego , który przepływa przez elektrodę
m = k* Q
gdzie : k=R/F - równoważnik elektrochemiczny
Drugie prawo Faradaja - taki sam ładunek elektryczny , przepływając przez różne elektrody , powoduje wydzielenie się lub rozpuszczenie substancji w ilościach chemicznie sobie równoważnych , to znaczy masy tych substancji są proporcjonalne do ich równoważników chemicznych.
Liczba przenoszeń jonów - jest to stosunek ładunku elektrycznego przenoszonego przez dany rodzaj jonów do sumarycznego ładunku elektrycznego przepływającego przez obwód.
3. Wykonanie ćwiczenia
Czyste naczyńko Hittorfa napełniliśmy 0,45M roztworem HCL. Po zamontowaniu obwodu elektrycznego według schematu przez około 1 godzinę przepuszczaliśmy przez obwód prąd elektryczny.
Po zakończeniu elektrolizy wyjęliśmy katodę z kulometru , umyliśmy ją i zważyliśmy . Roztwór z części katodowej wypuściliśmy i zmierzyliśmy jego objętość . Następnie miareczkowaliśmy go 0,005M roztworem NaOH . Miareczkowaniu poddaliśmy również roztwór z części środkowej naczyńka Hittorfa.
1. Tabela wyników miareczkowania NaOH z 5cm3 elektrolitu
Objętość roztworu części katodowej = 38 cm3
Początkowa masa katody = 12,4620 g
Końcowa masa katody = 12,4996 g
BADANE ROZTWORY |
I MIARECZKOWANIE [cm3] |
II MIARECZKOWANIE [cm3] |
Roztwór z części katodowej |
44,4 |
44,3 |
Roztwór z części środkowej |
44,3 |
44,5 |
4 . Obliczenia :
Liczba przenoszenia:
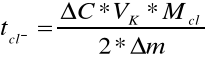
Δm =przyrost masy katody kulometru
Δm = 12,4996 - 12,4620 = 0,0376 g
Cśr.cz.kat = [(44,4 + 44,3)*0,5 ] cm3 = 44,35 cm3
Cśr.cz.środ = [(44,3 + 44,5)*0,5 ] cm3 = 44,4 cm3
Część katodowa :
0,04435 dm3 --- x moli NaOH
1 dm3 --- 0,05 moli/dm3 NaOH
x = 0,0022175 mola
NaOH + HCL ⇒ NaCL +H2 O
1 mol NaOH zobojętnia 1 mol HCL
nKHCL = nNaOH = 0,0022175 mola HCL
![]()
CKHCL - stężenie katodowej cz. naczyńka
Część środkowa:
nNaOH=0,0444 dm3 * 0.05 M =0,00222mola
![]()
nHCL = nNaOH = 0,00222 mola
ΔC = ΔCśr - ΔCkat = 0,444M - 0,4435M = 0,0005M
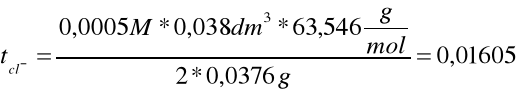
tH+ + tcl- = 1
tH+ = 1 - tcl- = 1 - 0,016 =0,984
BŁĄD BEWZGLĘDNY
δi = xi - x0
CNaOH =0,05M + 0,001M = 0,051M
Cz. katodowa :
nNaOH = 0,04435 dm3 * 0,051 M = 0,00226185 moli
nHCL= 0,00226185 moli
CHCL = 0,45237
Cz. środkowa :
nHCL= 0,0022644 moli
cHCL =0,45288 M
ΔcHCL = 0,00051M
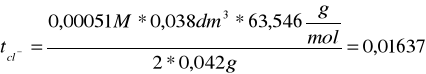
tH+ =1- tcl- = 0,98363
δwzględny = (tcl- - cNaOH = 0,051- tcl-)/ tcl- = 0,022
δwzględny = tcl- - cNaOH = 0,051- tcl- = 0,0002
Cz. katodowa :
nNaOH = 0,04435dm3 * (0,050 - 0,001)M = 0,0022mola
cHCL = 0,044261314
Cz. środkowa :
nHCL = 0,00221
cHCL = 0,0443112
ΔcHCL = 0,000499
tCl- = 0,01602
tH+ = 1-0,01602 =0,98398
δwzgl.=(tCl-,cNaOH=0,0499 - tCl-)/ tCl- = (0,01602 - 0,01605) / 0,01605 = - 0,00165
δbezwzględny = -0,00003
W ćwiczeniu mógł również wystąpić błąd miareczkowania i w odczycie objętości zużytego NaOH . Mógł wystąpić również błąd w pipetowaniu.
Wysoka wartość liczby przenoszenia jonów wodorowych jest spowodowany tym że są one bardzo ruchliwe . To z kolei wynika z faktu że jony te są bardzo małe.
(-)Cu| CuSO4 |Cu (+)
Anoda Cu → Cu2+ + 2e
Katoda Cu2+ + 2e → Cu
(-)Ag| AgNO3 |Ag (+)
Anoda Ag → Ag++e
Katoda Ag++e→ Ag
(-)Pt| NaOH |Pt (+)
Anoda 2Cl-+2e →Cl2
Katoda 2H3+O + 2e→ 2H2O + H2
(-)Pt| NaCl |Pt (+)
Anoda 2Cl- →Cl2 + 2e
Katoda Na+ + e→ Na
(-)Pt| H2SO4 |Pt (+)
Anoda 4OH- → O2 + 2H2O + 4e
Katoda 2H3O+ + 2e→ 2H2O + H2
(-)Ni| NaOH |Ni (+)
Anoda 4OH- → O2 + 2H2O + 4e
Katoda 2H3O+ + 2e→ 2H2O + H2
Wnioski :
W wyniku elektrolizy na katodzie osadziła się miedź (więc waga katody wzrosła) . W części katodowej roztworu wydzielił się H2 , a na części anodowej wydzielił się chlor . Ponieważ wyniki miareczkowań roztworu części środkowej i katodowej były zbliżone , więc świadczy to o dokładności wykonania ćwiczenia .Obliczone (błędy) to również wielkości zbliżone .Liczba przenoszenia jonów dla wodoru jest bardzo wysoka w porównaniu z liczbą przenoszenia jonów dla chloru.
4
![]()
![]()
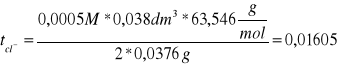
![]()
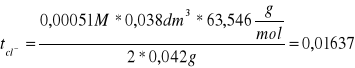
Wyszukiwarka
Podobne podstrony:
9-NASZE, AGH, agh, programinski, Laborki, Laborki, Lab, FIZYKA - Laboratorium, przepływ prądu przez
lab f&c tom, AGH, agh, programinski, Laborki, Laborki, Lab, FIZYKA - Laboratorium, przepływ prądu pr
Fizyka 14b, AGH, agh, programinski, Laborki, Laborki, Lab, FIZYKA - Laboratorium, fiz lab, franko
Polarymetr Laurenta, AGH, agh, programinski, Laborki, Laborki, Lab, FIZYKA - Laboratorium, Polarymet
cw 13 - Lepkosc, AGH, agh, programinski, Laborki, Laborki, Lab, FIZYKA - Laboratorium, Struna i Krzy
FIZYKA~6, AGH, agh, programinski, Laborki, Laborki, Lab, FIZYKA - Laboratorium, lab-fizyka, Moduł sz
Fizyka 9, AGH, agh, programinski, Laborki, Laborki, Lab, FIZYKA - Laboratorium, fiz lab, franko
cw41 - Busola Stycznych, AGH, agh, programinski, Laborki, Laborki, Lab, FIZYKA - Laboratorium, Strun
FIZYK~51, AGH, agh, programinski, Laborki, Laborki, Lab, FIZYKA - Laboratorium, SOCZEWKI
FIZ5=, AGH, agh, programinski, Laborki, Laborki, Lab, FIZYKA - Laboratorium, 052 zalamanie dla ciecz
Fizyka 12b, AGH, agh, programinski, Laborki, Laborki, Lab, FIZYKA - Laboratorium, fiz lab, franko
Fizyka 34c, AGH, agh, programinski, Laborki, Laborki, Lab, FIZYKA - Laboratorium, fiz lab, franko
43.teoria, AGH, agh, programinski, Laborki, Laborki, Lab, FIZYKA - Laboratorium, Trust i Mikele
Fizyka 34b, AGH, agh, programinski, Laborki, Laborki, Lab, FIZYKA - Laboratorium, fiz lab, franko
więcej podobnych podstron