NAZWISKO: CHILIŃSKI
IMIE: BARTŁOMIEJ
KIERUNEK: FIZ-INF
ROK STUDIÓW : II
GRUPA LABORATORYJNA: VI |
WYŻSZA SZKOŁA PEDAGOGICZNA W RZESZOWIE I PRACOWNIA FIZYCZNA |
||||
|
WYKONANO |
ODDANO
|
|||
|
DATA
|
PODPIS |
DATA
|
PODPIS |
|
Ćwiczenie Nr:
|
Temat: Wyznaczanie równoważnika elektrochemicznego miedzi i stałej Faradaya .
|
||||
Część teoretyczna
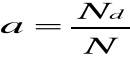
Wodne roztwory kwasów, zasad i soli ulegają dysocjacji elektrolitycznej polegającej na rozpadzie drobin na jony : dodatnie zwane katodami oraz ujemne zwane anionami . Dodatnimi jonami są metale i wodór, a ujemnymi reszta kwasowa lub grupa wodorotlenowa. Dysocjacja nie jest całkowita; stąd wprowadzamy pojęcie stopnia dysocjacji a będącego stosunkiem liczby drobin dysocjowanych Nd do ogólnej liczby drobin zawartych w roztworze N,
Stopień dysocjacji zależy od wielu czynników (temp. stężenia itp.) , z których najważniejszą rolę odgrywa względna przenikalność dielektryczna εr rozpuszczalnika. Części drobin substancji dysocjujących są jonami i związane są siłami columbowskimi:
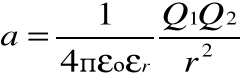
A więc proporcjonalnymi do odwrotności względnej stałej dielektrycznej εo rozpuszczalnika. Im większe εr , tym wyższy stopień dysocjacji. W roztworze następuje również rekombinacja drobin a stopień dysocjacji jest wynikiem równowagi dynamicznej między dysocjacją i rekombinacją.
Jony pochodzące z dysocjowanych drobin mogą przewodzić prąd elektryczny . Prąd taki różni się od prądu przewodzonego w metalach, ponieważ nie jest to przepływ elektronów lecz dużych jonów , czyli prąd konwekcyjny. Stąd też opór elektrolitu jest duży. Poza tym elektrolity zachowują się jak przewodniki tzn. Stosują się do prawa Ohma i ich opór zależy od temperatury w taki sam sposób jak dla metali. Czułość zjawisk zachodzących przy przepływie prądu elektrycznego przez elektrolity nazywamy elektrolizą. Ponieważ w elektrolitach występują prądy konwekcyjne, towarzyszy im transport masy. Jony oddają swój ładunek elektrodzie, ulegają zobojętnieniu i wydzielają się na elektrodzie lub reagują natychmiast z elektrodą bądź z roztworem. Ilość wydzielonej masy jest proporcjonalny do ładunku Q, który przepływa przez elektrolit:
Współczynnik proporcjonalności k nazywamy równoważnikiem elektrochemicznym. Równanie powyższe nazywamy I prawem Faradaya. Oznaczając masę pojedynczego jonu przez m΄, jego ładunek przez e', a ilość wydzielonych jonów przez N' otrzymamy:
Skąd:
![]()
I porównując powyższy wzór otrzymamy interpretację równoważnika
![]()
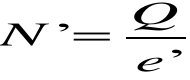
![]()
elektrochemicznego
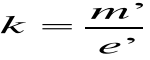
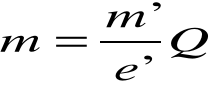
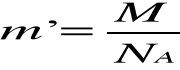
Ładunek jonu e'= We jest równy iloczynowi wartościowości i ładunku elementarnego, a masa m' jonu jest równa stosunkowi masy atomowej do liczby Avogadra NA , czyli :
Podstawiając te wartości otrzymamy:
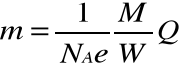
Gdzie wielkość :
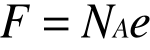
Nazywamy równoważnikiem chemicznym , a iloczyn :
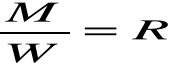
STAŁĄ FARADAYA.
Tak więc ostatni wzór przyjmuje postać:
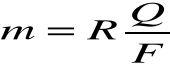
Wynika stąd że ładunek Q=F równy stałej Faradaya wydziela masę równą jednemu równoważnikowi chemicznemu m =R dowolnej substancji.
Obliczenia:
Obliczam masę m :
M= m2-m1
M=37334-36955=379 mg
![]()
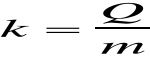
Obliczam równoważnik elektrochemiczny :
![]()
![]()
Obliczam stałą Faradaya:
1
3
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Wyszukiwarka
Podobne podstrony:
pierwsza strona sprawozdania, fff, dużo
FIZYKA 47, fff, dużo
76bmoje, fff, dużo
Indukcyjność cewki, fff, dużo
Lab fiz 01, fff, dużo
Pomiar predkosci dzieku w powietrzu, fff, dużo
FIZ43'' 222222222, fff, dużo
Wyznaczanie temperatury Curie dla ferrytow, fff, dużo
fotometr Bunsena 75, fff, dużo
Lab fiz 05, fff, dużo
Lab fiz 24, fff, dużo
Lab fiz 04, fff, dużo
przenikalność, fff, dużo
Stala siatka dyfrakcji2, fff, dużo
wahadlo maxela 4422, fff, dużo
Fiz24 teoria, fff, dużo
więcej podobnych podstron