Budowa atomów i cząsteczek
kl. II gr. 1
imię i nazwisko ..................................................................................................................
zad. 1, 2, 3 - dp; zad. 4, 5, 6, 7 - dst; zad. 8, 9, 10 - db; zad. 11, 12 - bdb
Wyjaśnij pojęcia: (3p)
nuklid
konfiguracja elektronowa
liczba atomowa
Atom zawiera: 36 protonów, 50 neutronów, 36 elektronów. (1 p)
Podaj symboliczny zapis tego atomu w postaci nuklidowej.
Podpowłoką nazywamy: (1 p)
tor po którym porusza się elektron
zespół elektronów o takiej samej wartości głównej liczby kwantowej
zespół elektronów o takiej samej wartości głównej i pobocznej liczby kwantowej
zespół elektronów o takiej samej wartości głównej, pobocznej
i magnetycznej liczby kwantowej
Podczas rozpadu α następuje emisja: (1p)
elektronów
pozytonów
jąder helu
kwantów promieniowania
Dokończ równania opisujące: (2 p)
rozpad α
![]()
rozpad β-
![]()
Podpowłoce 3s odpowiadają następujące wartości liczb kwantowych: (1p)
n = 1, l = 3
n = 2, l = 0
n = 3, l = 1
n = 3, l = 0
Podać następujące dane: a) symbol chemiczny, b) nazwę, (2p)
c) liczbę protonów, d) liczbę neutronów, dla nuklidu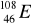
.
Kształt obszaru orbitalnego opisuje: (1p)
główna liczba kwantowa
poboczna liczba kwantowa
magnetyczna liczba kwantowa
magnetyczna spinowa liczba kwantowa
Podaj: (2p)
konfigurację elektronową pełną i skróconą
rozmieszczenie elektronów walencyjnych w zapisie kratkowym
atomu galu.
Podaj łączną liczbę elektronów walencyjnych, liczbę wolnych par (4p)
elektronowych atomu centralnego, liczbę hybryd oraz stan hybrydyzacji
atomu centralnego w podanych cząsteczkach: BeCl2, NH3.
BeCl2
Lewal =.............; Lwp(Be) = ...............; Lh = .............; stan hybrydyzacji(Be) ..............
NH3
Lewal =.............; Lwp(N) = ................; Lh = ..............; stan hybrydyzacji(N) ...............
Oblicz średnią masę atomową pierwiastka mającego izotopy (3p)
o liczbach masowych 79 (55%) i 81 (45%).
Jaki to pierwiastek?
Określ geometrię cząsteczek Cl2O i PCl3 na podstawie stanu hybrydyzacji (4p)
oraz liczby wolnych par elektronowych atomu centralnego.
Budowa atomów i cząsteczek
kl. II gr. 2
imię i nazwisko ..................................................................................................................
zad. 1, 2, 3 - dp; zad. 4, 5, 6, 7 - dst; zad. 8, 9, 10 - db; zad. 11, 12 - bdb
Wyjaśnij pojęcia: (3p)
izotopy
poziom orbitalny
liczba masowa
Atom zawiera: 32 protony, 44 neutrony, 32 elektrony. (1 p)
Podaj symboliczny zapis tego atomu w postaci nuklidowej.
Powłoką nazywamy: (1 p)
tor po którym porusza się elektron
zespół elektronów o takiej samej wartości głównej liczby kwantowej
zespół elektronów o takiej samej wartości głównej i pobocznej liczby kwantowej
zespół elektronów o takiej samej wartości głównej, pobocznej i magnetycznej liczby kwantowej
Podczas rozpadu β- następuje emisja: (1p)
jąder helu
kwantów promieniowania
pozytonów
elektronów
Dokończ równania opisujące: (2 p)
rozpad α
![]()
rozpad β-
![]()
Podpowłoce 2p odpowiadają następujące wartości liczb kwantowych: (1p)
n = 2, l = 1
n = 1, l = 1
n = 2, l = 0
n = 1, l = 0
Podać następujące dane: a) symbol chemiczny, b) nazwę, (2p)
c) liczbę protonów, d) liczbę neutronów, dla nuklidu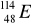
.
Wielkość obszaru orbitalnego opisuje: (1 p)
główna liczba kwantowa
poboczna liczba kwantowa
magnetyczna liczba kwantowa
magnetyczna spinowa liczba kwantowa
Podaj: (2p)
konfigurację elektronową pełną i skróconą
rozmieszczenie elektronów walencyjnych w zapisie kratkowym
atomu bromu.
Podaj łączną liczbę elektronów walencyjnych, liczbę wolnych par (4p)
elektronowych atomu centralnego, liczbę hybryd oraz stan hybrydyzacji
atomu centralnego w podanych cząsteczkach: BF3, H2O.
BF3
Lewal =.............; Lwp(B) = ...............; Lh = ..............; stan hybrydyzacji(B) ................
H2O
Lewal =.............; Lwp(O) = ...............; Lh = ..............; stan hybrydyzacji(O) ................
Oblicz średnią masę atomową pierwiastka mającego izotopy (3p)
o liczbach masowych 203 (31%) i 205 (69%).
Jaki to pierwiastek?
Określ geometrię cząsteczek BH3 i CS2 na podstawie stanu hybrydyzacji (4p)
oraz liczby wolnych par elektronowych atomu centralnego.
Wyszukiwarka
Podobne podstrony:
Zadania cz 2, chemia organiczna(1)
Zagadnienia egzaminacyjne ChFiz cz.1, Chemia Fizyczna WCh PŁ
chemia-cw -lab -cz -2, Chemia
mmgg, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II sprawka
Moje 50 , Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II spr
monia 11, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II spr
Chemia Laboratorium cz 1
Chemia wody pytania cz
Wyniki.I-KolokwiumB.2008, Nieorganiczna, chemia2, Arkusze powtórzeniowe, Pobieranie1, studia 1.2, za
¦CIˇGA - CHEMIA WYJ¦CIÓWKA cz[1].2, STĘŻENIE PROCENTOWE
KOND41vmac, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II s
rad, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II sprawka
chemia nieorganiczna wykłady cz II
chemia nieorganiczna wykłady cz 1
�CI�GA - CHEMIA WYJ�CI�WKA cz.4 (3) , MANGANOMETRIA-KMnO4-
więcej podobnych podstron