Data: 11-03-2008 |
Imiona i Nazwiska: Urszula Lorenc, Cezary Łaksa, Katarzyna Łącz, Robert Łoś, Magdalena Łukasik, Katarzyna Makowska, Przemysław Machura, Michał Macura, Olgierd Marcinkowski, Joanna Madej, Magdalena Madej, Magdalena Machota, Marchewka Marta, Małgorzata Mazur, |
GrupaVI |
|
Technologia Żywności |
|
Ocena: |
Temat ćwiczenia: Spektrofotometryczne oznaczenie stężenia białka. |
I.Wstęp teoretyczny:
Spektrofotometria jest to dział analizy instrumentalnej polegający na ilościowym pomiarze absorpcji, emisji lub odbicia światła. Wiązka promieniowania monochromatycznego przechodząca przez warstwę roztworu jest osłabiona w stosunku do padającego. Promieniowanie o natężeniu ulega częściowo odbiciu lub rozproszeniu, częściowo pochłonięciu, a tylko część przechodzi przez roztwór.
Absorpcja (pochłanianie) ma charakter selektywny, czyli każda substancja inaczej absorbuje światło i jest to cecha charakterystyczna dla każdej z nich. Istnieją substancje zdolne do pochłaniania światła o długości 180-800 nm. Tą zdolność zawdzięczają posiadaniu wewnątrz cząsteczki grupy atomów które powiązane są ze sobą wiązaniami wielokrotnymi tak jak na przykład w grupie karbonylowej, tiolowej, alkenowej, azowej, nitrowej, nitrozowej, fenylowej.
Innym przykładem mogą być związki aromatyczne, heterocykliczne z pierścieniami skondensowanymi, lub też jony metali przejściowych o niezapełnionych powłokach elektronowych. Wszystkie te związki nazywane są chromoforami.
Prawa rządzące spektrofotometrią:
1.Prawo Lamberta:
Prawo to głosi, że stopień absorpcji światła jest proporcjonalny do grubości warstwy i jej własności optycznych, np. w przypadku roztworów należy uwzględnić stężenie molowe czynnika powodującego pochłanianie.
2.Prawo Beera:
głosi, że wielkość absorbancji światła (ABS) przez roztwór jest wprost proporcjonalna do stężenia c substancji pochłaniającej światło.
3. Prawo addytywności absorpcji:
mówiące iż w układzie wieloskładnikowych, absorpcja jest równa sumie absorbancji poszczególnych składników przy określonej fali.
Oznaczenie dla pojedynczego składnika selektywnie absorbującego światło o określonej długości przeprowadza się przy długości fali odpowiadającej maksimum absorpcji. Pomiary polegają na porównaniu natężenia wiązki promieniowania przechodzącego przez badaną próbkę odniesienia np. rozpuszczalnik. Zależność pomiędzy wynikiem pomiaru a zawartością oznaczonego składnika ustala się przy pomocy próbek wzorcowych. Jest to tak zwana metoda krzywej kalibracyjnej. Sporządza się serię wzorców o składzie naśladującym próbkę badaną, o zakresie stężeń pokrywającym cały przedział analityczny. Na podstawie pomiarów sporządza się wykres zależności absorpcji do stężenia roztworu, co umożliwia określenie stężenia badanego roztworu.
II. Wykonanie Oznaczenia:
Posiadając roztwór białka wołowego albuminy o stężeniu 1mg/ml sporządzono serię próbek wzorcowych o stężeniach: 0,2 mg/ml ; 0,4mg/ml ; 0,6mg/ml ; 0,8mg/ml ; 1,0 mg/ml. Zmierzono ich absorbcję światła przy długości 280nm, zerując wcześniej spektrofotometr na próbce wody destylowanej. Na koniec zmierzono absorpcję badanej próbki.
III. Pomiary:
|
Stężenie (mg/ml) |
absorpcja |
0 |
0,00 |
0,0002 |
1 |
0,2 |
0,1147 |
2 |
0,4 |
0,2488 |
3 |
0,6 |
0,3814 |
4 |
0,8 |
0,5098 |
5 |
1,0 |
0,6443 |
x |
|
0,3076 |
x- badana próbka
Opracowanie wyników:
Wyniki pomiarów można przedstawić w postaci równania funkcji:
y=ax+c, gdzie:
y - wartość mierzona
x - stężenie analitu
a - współczynnik kierunkowy
b - przesunięcie prostej regresji
W procesie kalibracji współczynniki a i b równania y=ax+c można obliczyć na podstawie wzorów:
![]()
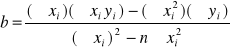
n |
xi |
yi |
xiyi |
xi2 |
yi2 |
1 |
|
|
|
|
|
2 |
|
|
|
|
|
3 |
|
|
|
|
|
4 |
|
|
|
|
|
5 |
|
|
|
|
|
6 |
|
|
|
|
|
suma: |
|
|
|
|
|
a=0,6483
b= - 0,0076
y = 0,6483x - 0,0076
Wyszukiwarka
Podobne podstrony:
7616
7616
7616
7616
7616
praca-magisterska-wa-c-7616, Dokumenty(2)
082 2id 7616
7616
więcej podobnych podstron