Zastosowanie kultur in vitro w leśnictwie
Metoda rozmnażania roślin in vitro, czyli w szkle, jest coraz częściej wykorzystywana do produkcji sadzonek. JZastosowanie kultur in vitro w leśnictwie
Metoda rozmnażania roślin in vitro, czyli w szkle, jest coraz częściej wykorzystywana do produkcji sadzonek. Jest ona szczególnie przydatna w szkółkarstwie leśnym.
Istnieją dwa podstawowe sposoby rozmnażania drzew: rozmnażanie generatywne (płciowe), dominujące wśród roślin drzewiastych przy samoodnawianiu oraz rozmnażanie wegetatywne, które polega na powstawaniu nowych osobników z organów wegetatywnych rośliny, takich jak łodygi, liście, korzenie. W latach osiemdziesiątych naukowcy wdrożyli opracowaną wcześniej metodę rozmnażania wegetatywnego roślin za pomocą kultur in vitro. Metoda ta na szerszą skalę zastosowana została w hodowli wielu roślin ozdobnych i warzywnych oraz drzew leśnych (Michalik 1996).
Podstawy rozmnażania in vitro
Rozmnażanie in vitro jest możliwe dzięki zjawisku totipotencji, czyli zdolności odtworzenia całej rośliny z pojedynczej komórki. Eksplantatami mogą być różne części roślin, organów lub tkanek, a nawet pojedyncze komórki. Pozwoliło to na wyodrębnienie różnorodnych technik mikrorozmnażania (Zenkteler 1995). 
Hodowle przeprowadza się w komorach klimatyzowanych, na sztucznych pożywkach, w sterylnych warunkach. Stosując okresowe przenoszenie tkanek na świeże pożywki można utrzymać hodowlę przez dowolny czas. Zastosowanie metod in vitro umożliwia uzyskanie z jednego fragmentu rośliny nieograniczonej liczby roślin o zbliżonym genotypie.
W leśnictwie kultury tkankowe znalazły szerokie zastosowanie praktyczne ponieważ umożliwiają:
1) szybkie wegetatywne mnożenie materiału roślinnego, w tym także roślin trudnych do rozmnożenia klasycznymi metodami wegetatywnymi np. przez zrzezy (Polonenko 1999),
2) uniezależnienie produkcji materiału roślinnego od warunków pogodowych, pory roku oraz uzyskiwanie roślin w dowolnym terminie,
3) produkcję roślin wolnych od patogenów,
4) rozmnażanie roślin o źle kiełkujących, trudno dostępnych lub przelegujących nasionach (Olszewska, Wesoły 1998),
5) uzyskanie klonów drzew o porządanych cechach np. zwiększonej odporności na warunki stresowe czy patogeny,
6) uzyskiwanie wegetatywnych mieszańców,
7) produkcję wtórnych metabolitów na skalę przemysłową m.in. dla przemysłu farmaceutycznego.
Sposoby hodowli
Obecnie do najczęściej stosowanych sposobów w hodowli kultur in vitro drzew należą kultury zarodków i kalusa.
Zarodki izoluje się z nasion o różnym stopniu rozwoju. Są one utworzone z tkanki merystematycznej (oprócz elementów protoksylemu i protofloemu w przypadku zarodków dojrzałych). Ważną rolę przy doborze pożywki i zastosowaniu kultury odgrywają fazy w rozwoju zarodka (stadium globularne, sercowate i torpedy). Kultury zarodków mogą służyć do badań nad przebiegiem wzrostu i rozwoju zarodków oraz wpływu na te procesy endogennych regulatorów wzrostu, działania światła, temperatury i innych czynników (np. mutagennych). W szczególności kultury zarodków wykorzystuje się do mikrorozmnażania prowadząc tzw. somatyczną embriogenezę (ryc. 1).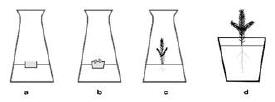
Kalus w kulturach kalusa może wytworzyć się niemal z każdej tkanki, jednak regułą jest, że lepiej udaje się to w przypadku tkanki młodej. Może on tworzyć pączki przybyszowe (ryc. 2), korzenie przybyszowe, elementy waskularne w swoim wnętrzu i zarodki somatyczne. Procesy te reguluje się składem pożywki, a zwłaszcza wzajemnym stosunkiem regulatorów wzrostu: auksyn i cytokinin.
Etapy ho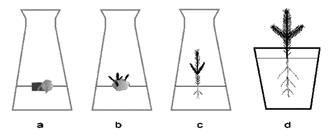
dowli kultur in vitro
Do etapów tych zalicza się:
1) znalezienie genotypu danego gatunku, który dobrze reaguje na wszystkie czynniki zastosowane przy wzroście i rozwoju prowadzonej kultury tkankowej (fot. 1),
2) wybór odpowiedniego materiału roślinnego (wiek rośliny matecznej, dobór organu do pobrania eksplantatu, pora roku),
3) opracowanie skutecznej metody dezynfekcji eksplantatów pierwotnych,
4) dobór pożywek odpowiednich dla danego gatunku, proweniencji oraz wszystkich etapów w wyznaczonym sposobie prowadzenia kultury,
5) opracowanie metodyki i stworzenia warunków prowadzenia kultury dla masowego mnożenia uzyskanego materiału roślinnego
6) adaptacja uzyskanych in vitro roślin do naturalnych warunków wzrostu i rozwoju.
Jest wiele przykładów rozmnażania roślin drzewiastych za pomocą kultur in vitro. Najwięcej badań w Europie nad tym zagadnieniem prowadzi się na Słowacji i w Austrii. Na Słowacji opracowuje się metody mikrorozmnożeń różnych gatunków jodły oraz sosny czarnej, u której uzyskano dojrzałe somatyczne zarodki. W Austrii uzyskano somatyczną embriogenezę jodły pospolitej. U świerka pospolitego w kulturach in vitro uzyskano pączki przybyszowe z zarodków, oraz somatyczną embriogenezę (Arnold i in. 1996).
Również w Polsce prowadzone są intensywne badania z tego zakresu w Instytucie Badawczym Leśnictwa w Warszawie, Instytucie Dendrologii PAN w Kórniku i katedrach oraz zakładach Akademii Rolniczych m.in. w Poznaniu (Katedra Biochemii) i w Krakowie (Zakład Fizjologii i Biochemii Drzew Leśnych). W Kórniku uzyskano kultury kalusa embriogennego u modrzewia europejskiego (Żytkowiak 1995). W IBL opracowano i wdrożono do praktyki metodę mikrorozmnażania modrzewia, topoli i jodły pospolitej (Szczygieł, Rakowski 1996, 1999, 2000). W Poznaniu prowadzono badania nad kulturami tkankowymi dębu, których celem było uzyskanie zarodków somatycznych dla masowej produkcji tzw. "nasion wegetatywnych" (Olszewska, Wesoły 1998).
Z powyższych przykładów wynika, że leśnicy powinni zwrócić większą uwagę na hodowlę in vitro drzew, jako sposobu rozmnażania wegetatywnego mającego dobre perspektywy na przyszłość.
Tekst, zdjęcie i rysunki - mgr inż. Katarzyna Nawrot-Chorabik
LITERATURA:
ARNOLD von S., CLAPHAM D., EGERTSDOTTER U., MO L.H. 1996. Plant Growth Regulation 20: 3-9.
MICHALIK B. 1996. Zastosowanie metod biotechnologicznych w hodowli roślin. Drukrol, Kraków.
OLSZEWSKA A., WESOŁY W. 1998. Nowe trendy w hodowli lasu - dąb w kulturach in vitro. Sylwan 142 11: 87-93.
POLONENKO D.R. 1999. Challenges and issues in scaling comercial production of conifers somatic embryogenesis. In vitro Cell Dev. Biol.-Plant 35: 299-302.
SZCZYGIEŁ K., RAKOWSKI K. 1996 Rozmnażanie modrzewia europejskiego (Larix decidua Mill.) w kulturach tkankowych metodą somatycznej embriogenezy (maszynopis w IBL Warszawa).
SZCZYGIEŁ K., RAKOWSKI K. 1999 Preliminary study on somatic embriogenesis of silver fir (Abies alba Mill.) - Polish provenances. Biologia 54 Suppl. 7:29.
SZCZYGIEŁ K., RAKOWSKI K. 2000 Wstępne wytyczne rozmnażania jodły pospolitej (Abies alba Mill.) w kulturach tkankowychmetodą somatycznej embriogenezy (maszynopis w IBL Warszawa).
ZENKTELER M. 1995. Kultury in vitro na przestrzeni ostatnich 50 lat. W: Mat. Konf. PAN, Kraków 1994.
ŻYTKOWIAK R. 1995. Indukcja somatycznej embriogenezy w kulturach kalusowych modrzewia europejskiego (Larix decidua Mill.) Arboretum Kórnickie 40: 117-123.
est ona szczególnie przydatna w szkółkarstwie leśnym.
Istnieją dwa podstawowe sposoby rozmnażania drzew: rozmnażanie generatywne (płciowe), dominujące wśród roślin drzewiastych przy samoodnawianiu oraz rozmnażanie wegetatywne, które polega na powstawaniu nowych osobników z organów wegetatywnych rośliny, takich jak łodygi, liście, korzenie. W latach osiemdziesiątych naukowcy wdrożyli opracowaną wcześniej metodę rozmnażania wegetatywnego roślin za pomocą kultur in vitro. Metoda ta na szerszą skalę zastosowana została w hodowli wielu roślin ozdobnych i warzywnych oraz drzew leśnych (Michalik 1996).
Podstawy rozmnażania in vitro
Rozmnażanie in vitro jest możliwe dzięki zjawisku totipotencji, czyli zdolności odtworzenia całej rośliny z pojedynczej komórki. Eksplantatami mogą być różne części roślin, organów lub tkanek, a nawet pojedyncze komórki. Pozwoliło to na wyodrębnienie różnorodnych technik mikrorozmnażania (Zenkteler 1995). 
Hodowle przeprowadza się w komorach klimatyzowanych, na sztucznych pożywkach, w sterylnych warunkach. Stosując okresowe przenoszenie tkanek na świeże pożywki można utrzymać hodowlę przez dowolny czas. Zastosowanie metod in vitro umożliwia uzyskanie z jednego fragmentu rośliny nieograniczonej liczby roślin o zbliżonym genotypie.
W leśnictwie kultury tkankowe znalazły szerokie zastosowanie praktyczne ponieważ umożliwiają:
1) szybkie wegetatywne mnożenie materiału roślinnego, w tym także roślin trudnych do rozmnożenia klasycznymi metodami wegetatywnymi np. przez zrzezy (Polonenko 1999),
2) uniezależnienie produkcji materiału roślinnego od warunków pogodowych, pory roku oraz uzyskiwanie roślin w dowolnym terminie,
3) produkcję roślin wolnych od patogenów,
4) rozmnażanie roślin o źle kiełkujących, trudno dostępnych lub przelegujących nasionach (Olszewska, Wesoły 1998),
5) uzyskanie klonów drzew o porządanych cechach np. zwiększonej odporności na warunki stresowe czy patogeny,
6) uzyskiwanie wegetatywnych mieszańców,
7) produkcję wtórnych metabolitów na skalę przemysłową m.in. dla przemysłu farmaceutycznego.
Sposoby hodowli
Obecnie do najczęściej stosowanych sposobów w hodowli kultur in vitro drzew należą kultury zarodków i kalusa.
Zarodki izoluje się z nasion o różnym stopniu rozwoju. Są one utworzone z tkanki merystematycznej (oprócz elementów protoksylemu i protofloemu w przypadku zarodków dojrzałych). Ważną rolę przy doborze pożywki i zastosowaniu kultury odgrywają fazy w rozwoju zarodka (stadium globularne, sercowate i torpedy). Kultury zarodków mogą służyć do badań nad przebiegiem wzrostu i rozwoju zarodków oraz wpływu na te procesy endogennych regulatorów wzrostu, działania światła, temperatury i innych czynników (np. mutagennych). W szczególności kultury zarodków wykorzystuje się do mikrorozmnażania prowadząc tzw. somatyczną embriogenezę (ryc. 1).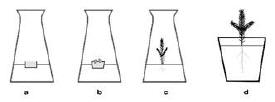
Kalus w kulturach kalusa może wytworzyć się niemal z każdej tkanki, jednak regułą jest, że lepiej udaje się to w przypadku tkanki młodej. Może on tworzyć pączki przybyszowe (ryc. 2), korzenie przybyszowe, elementy waskularne w swoim wnętrzu i zarodki somatyczne. Procesy te reguluje się składem pożywki, a zwłaszcza wzajemnym stosunkiem regulatorów wzrostu: auksyn i cytokinin.
Etapy ho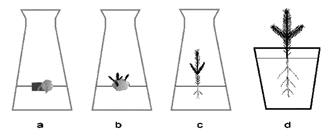
dowli kultur in vitro
Do etapów tych zalicza się:
1) znalezienie genotypu danego gatunku, który dobrze reaguje na wszystkie czynniki zastosowane przy wzroście i rozwoju prowadzonej kultury tkankowej (fot. 1),
2) wybór odpowiedniego materiału roślinnego (wiek rośliny matecznej, dobór organu do pobrania eksplantatu, pora roku),
3) opracowanie skutecznej metody dezynfekcji eksplantatów pierwotnych,
4) dobór pożywek odpowiednich dla danego gatunku, proweniencji oraz wszystkich etapów w wyznaczonym sposobie prowadzenia kultury,
5) opracowanie metodyki i stworzenia warunków prowadzenia kultury dla masowego mnożenia uzyskanego materiału roślinnego
6) adaptacja uzyskanych in vitro roślin do naturalnych warunków wzrostu i rozwoju.
Jest wiele przykładów rozmnażania roślin drzewiastych za pomocą kultur in vitro. Najwięcej badań w Europie nad tym zagadnieniem prowadzi się na Słowacji i w Austrii. Na Słowacji opracowuje się metody mikrorozmnożeń różnych gatunków jodły oraz sosny czarnej, u której uzyskano dojrzałe somatyczne zarodki. W Austrii uzyskano somatyczną embriogenezę jodły pospolitej. U świerka pospolitego w kulturach in vitro uzyskano pączki przybyszowe z zarodków, oraz somatyczną embriogenezę (Arnold i in. 1996).
Również w Polsce prowadzone są intensywne badania z tego zakresu w Instytucie Badawczym Leśnictwa w Warszawie, Instytucie Dendrologii PAN w Kórniku i katedrach oraz zakładach Akademii Rolniczych m.in. w Poznaniu (Katedra Biochemii) i w Krakowie (Zakład Fizjologii i Biochemii Drzew Leśnych). W Kórniku uzyskano kultury kalusa embriogennego u modrzewia europejskiego (Żytkowiak 1995). W IBL opracowano i wdrożono do praktyki metodę mikrorozmnażania modrzewia, topoli i jodły pospolitej (Szczygieł, Rakowski 1996, 1999, 2000). W Poznaniu prowadzono badania nad kulturami tkankowymi dębu, których celem było uzyskanie zarodków somatycznych dla masowej produkcji tzw. "nasion wegetatywnych" (Olszewska, Wesoły 1998).
Z powyższych przykładów wynika, że leśnicy powinni zwrócić większą uwagę na hodowlę in vitro drzew, jako sposobu rozmnażania wegetatywnego mającego dobre perspektywy na przyszłość.
Tekst, zdjęcie i rysunki - mgr inż. Katarzyna Nawrot-Chorabik
Wyszukiwarka
Podobne podstrony:
SPRAWOZDANIE Z NASIENNICTWA, LEŚNICTWO SGGW, MATERIAŁY LEŚNICTWO SGGW, II rok, 4 semestr, Nasiennict
terenówki, LEŚNICTWO SGGW, MATERIAŁY LEŚNICTWO SGGW, II rok, 4 semestr, Maszynoznawstwo, Ćwiczenia
egzamin ść 1-8, LEŚNICTWO SGGW, MATERIAŁY LEŚNICTWO SGGW, II rok, 3 semestr, Entomologia, Entomologi
Spr z ćw ter z maszyn, LEŚNICTWO SGGW, MATERIAŁY LEŚNICTWO SGGW, II rok, 4 semestr, Maszynoznawstwo,
teścik na 5, LEŚNICTWO SGGW, MATERIAŁY LEŚNICTWO SGGW, II rok, 4 semestr, FOTOGR~1
material do pominiecia, II ROK, SEMESTR II, psychologia różnic indywidualnych, opracowania
zastosowanie roślinnych kultur in vitro w biotechnologii, architektura krajobrazu
Kultury in vitro materiał
Kultury in vitro zastosowanie
Kultury in vitro roslin rozmnazanie klonalne
Zagadnienia z nasiennictwa i szkółkarstwa leśnego do kolokwium 2 2015, Leśnictwo UWM Olsztyn, Semest
opracowanie-nasiennictwo, Leśnictwo UWM Olsztyn, Semestr V, NASIENNICTWO I SZKÓŁKARSTWO LEŚNE, MATER
Nasiennictwo wyklady, Leśnictwo UWM Olsztyn, Semestr V, NASIENNICTWO I SZKÓŁKARSTWO LEŚNE, MATERIAŁY
Komórki macierzyste, Histologia i cytologia, mikroskopia, Kultury in vitro
więcej podobnych podstron