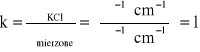
gdzie: k - stała naczyńka; σKCl tablicowa wartość przewodnictwa właściwego roztworu KCl o znanym stężeniu [1/(*cm)]; mierzone - wartość przewodnictwa roztworu KCl mierzona konduktometrem [1/(*cm)].
Robert Maniura
Sprawozdanie z ćwiczenia nr B-15: Krytyczne stężenie powstawania miceli.
1. Wstęp teoretyczny:
Micela zbudowana jest z jądra utworzonego z cząsteczek fazy rozproszonej oraz podwójnej warstwy elektrycznej. W skład podwójnej warstwy elektrycznej wchodzi:
warstwa adsorpcyjna- trwale związana z jądrem, utworzona z jonów fazy rozpraszającej;
warstwa dyfuzyjna.
Małocząsteczkowe związki powierzchniowo - czynne w roztworach rozcieńczonych występują w postaci pojedynczych cząsteczek. Jeżeli stężenie tych substancji wzrasta wówczas przy określonym stężeniu cząsteczki asocjują ze sobą i powstają cząstki koloidalne - micele.
Stężenie, przy którym na skutek tworzenia się agregatów, ulegają zmianie właściwości fizyczne nazywa się krytycznym stężeniem powstawania miceli CMC.
Do wyznaczenia CMC wykorzystuje się fizyczne właściwości związków powierzchniowo - czynnych, stanowiące funkcję stężenia zmieniającą się po pojawieniu się miceli w sposób mniej lub bardziej skokowy.
Zmierzone właściwości przedstawia się graficznie jako funkcję stężenia i znajduje się przez ekstrapolację przecięcia krzywych przebiegających poniżej i powyżej CMC.
Stosowaną w ćwiczeniu metodą do wyznaczenia CMC jest metoda konduktometryczna polegająca na pomiarze przewodnictwa.
Związki powierzchniowo - czynne dysocjują w roztworze wodnym i zachowują się jak mocne elektrolity. Gdy pojedyncze cząsteczki łączą się w zespoły, część przeciwjonów zostaje bezpośrednio związana z naładowaną micelą w warstwie adsorpcyjnej co powoduje zmniejszenie przewodnictwa elektrycznego.
Powyżej wartości CMC przewodnictwo równoważnikowe maleje ze wzrostem stężenia stromo, natomiast po przekroczeniu CMC maleje łagodnie.
Opracowanie wyników:
Pomiaru przewodnictwa roztworów laurynianu sodu dokonane zostało za pomocą konduktometru. Na początku zmierzone zostało przewodnictwo wzorcowych roztworów KCl w celu wyznaczenia stałej naczyńka konduktometrycznego k:
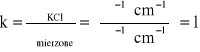
gdzie: k - stała naczyńka; σKCl tablicowa wartość przewodnictwa właściwego roztworu KCl o znanym stężeniu [1/(*cm)]; mierzone - wartość przewodnictwa roztworu KCl mierzona konduktometrem [1/(*cm)].
L.p. |
Stężenie roztworu wzorcowego KCl [mol/dm3] |
Przewodnictwo właściwe roztworów KCl (zmierzone) w 21 oC [1/(Ω*cm)] lub [S/cm] |
Przewodnictwo właściwe KCl (tablicowe) [1/(Ω*cm)] lub [S/cm] |
Wartość stałej naczyńka k |
1 |
0,1 |
0,0192 |
0,01213 |
0,6318 |
2 |
0,01 |
0,0021 |
0,001329 |
0,6328 |
Wartość średnia stałej naczyńka k= 0,6323 [cm-1]
Przewodnictwo właściwe roztworów laurynianu sodu wynosi:
![]()
gdzie k - stała naczyńka; - przewodnictwo właściwe [1/(*cm)]; - wartość przewodnictwa roztworu laurynianu mierzona konduktometrem [1/(*cm)].
L.p.
|
Roztwór laurynianu sodu |
Przewodnictwo mierzone [1/(*cm)] lub [S/cm] |
Przewodnictwo właściwe roztworu laurynianu [1/(*cm)] lub [S/cm] |
1 |
wyjściowy |
9,30*10-4 |
5,88*10-4 |
2 |
A |
6,30*10-4 |
3,98*10-4 |
3 |
B |
5,10*10-4 |
3,22*10-4 |
4 |
C |
4,20*10-4 |
2,66*10-4 |
5 |
D |
3,55*10-4 |
2,24*10-4 |
6 |
E |
2,70*10-4 |
1,71*10-4 |
7 |
F |
1,12*10-4 |
7,08*10-5 |
8 |
G |
9,20*10-4 |
5,82*10-5 |
9 |
H |
5,30*10-4 |
3,35*10-5 |
10 |
I |
3,20*10-4 |
2,02*10-5 |
Przewodnictwa równoważnikowe roztworów laurynianu sodu wynosi:
![]()
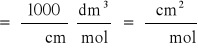
gdzie: - przewodnictwo równoważnikowe [-1*cm2*mol-1]; - przewodnictwo właściwe [-1*cm-1]; cr - stężenie roztworu [mol/ dm3].
L.p. |
Roztwór laurynianu sodu |
Stężenie [mol/dm3] |
Pierwiastek ze stężenia |
Przewodnictwo właściwe roztworu laurynianu sodu [Ω-1*cm-1] |
Przewodnictwo równoważnikowe roztworu laurynianu sodu [Ω-1*cm2*mol-1] lub [S*cm2*mol-1] |
1 |
Wyjściowy |
1,20*10-2 |
1,10*10-1 |
5,88*10-4 |
49,00 |
2 |
A |
9,60*10-3 |
9,80*10-2 |
3,98*10-4 |
41,50 |
3 |
B |
4,80*10-3 |
6,93*10-2 |
3,22*10-4 |
67,18 |
4 |
C |
2,40*10-3 |
4,90*10-2 |
2,66*10-4 |
110,65 |
5 |
D |
1,20*10-3 |
3,46*10-2 |
2,24*10-4 |
187,06 |
6 |
E |
6,00*10-4 |
2,45*10-2 |
1,71*10-4 |
284,54 |
7 |
F |
3,00*10-4 |
1,73*10-2 |
7,08*10-5 |
236,06 |
8 |
G |
1,50*10-4 |
1,22*10-2 |
5,82*10-5 |
387,82 |
9 |
H |
7,50*10-5 |
8,66*10-3 |
3,35*10-5 |
446,84 |
10 |
I |
3,75*10-5 |
6,12*10-3 |
2,02*10-5 |
539,57 |
Krytyczne stężenie powstawania miceli:
obliczone na podstawie równań prostych z wykresu zależności przewodnictwa właściwego od stężenia dla roztworu laurynianu sodu:
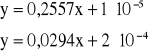
po dokonaniu odpowiednich przeliczeń takiego układu równań otrzymuję:
![]()
obliczone na podstawie równań prostych z wykresu zależności przewodnictwa równoważnikowego od pierwiastka ze stężenia dla roztworu laurynianu sodu:
![]()
po dokonaniu odpowiednich przeliczeń takiego układu równań otrzymuję:
![]()
4. Wnioski:
Do wyznaczenia krytycznego stężenia powstawania miceli CMC wykorzystuje się pewne właściwości fizyczne związków powierzchniowo - czynnych, które stanowią funkcję stężenia i zmieniają się w sposób mniej lub bardziej skokowy. Laurynian sodu CH3(CH2)10COONa należy do takich związków. W roztworze wodnym dysocjuje i zachowuje się jak silny elektrolit. Podczas zwiększania stężenia roztworu przy określonym stężeniu nastąpił skok przewodnictwa. Stężenie przy którym nastąpił skok przewodnictwa jest krytycznym stężeniem powstawania miceli - w tym momencie tworzą się cząstki koloidalne. Pojedyncze cząsteczki połączyły się w zespoły i część przeciwjonów została bezpośrednio związana z naładowaną micelą w warstwę absorpcyjną. Wykres zależności przewodnictwa właściwego od stężenia pokazuje, że w obszarze niskich stężeń następuje bardzo szybki wzrost przewodnictwa właściwego, a w obszarze wysokich stężeń wzrost przewodnictwa jest łagodniejszy. Z wykresu zależności przewodnictwa równoważnikowego od pierwiastka ze stężenia widać, że ze wzrostem stężenia maleje przewodnictwo równoważnikowe w niskich stężeniach spadek jest stromy, a w wysokich łagodny. Wyznaczone w ćwiczeniu krytyczne stężenie powstawania miceli CMC wynosi 8,27*10-4 [mol/dm3].
1