Część teoretyczna
Proces hydrolizy octanu etylu w środowisku kwaśnym przebiega według następującej reakcji:
H+
CH3COOC2H5 + H2O CH3COOH + C2H5OH
Reakcja ta, zachodząca w środowisku wodnym, katalizowana przez jony wodorowe, jest reakcją pierwszego rzędu. O jej rzędowości decyduje wyłącznie stężenie estru, ponieważ można przyjąć, że stężenie wody nie ulega zmianie, gdyż jest ona w nadmiarze do ilości drugiego substratu.
Szybkość omawianej reakcji określa równanie:
dx/dt =k(a-x)
Gdzie:
a - stężenie początkowe estru
x - stężenie produktu tj. kwasu octowego w danej chwili t
k -stała szybkości reakcji
Przekształcając i całkując ostateczne równanie w granicach czasu od 0 i t i w granicach stężeń od 0 do x znajdujemy następujące wyrażenie na stała szybkości reakcji:
k=1/t ln (a/(a-x))
Obliczanie stałej k wymaga znajomości stężenia początkowego estru a i stężenia estru w danej chwili ( a - x). Kinetykę omawianej reakcji, katalizowanej przez jony wodorowe pochodzące z kwasu solnego, wygodnie jest badać poprzez oznaczenie stężenia produktu. Łączną zawartość kwasu solnego i powstającego kwasu octowego można znaleźć poprzez miareczkowanie roztworu zasadą sodową. Zgodnie z podstawową zależnością analizy miareczkowej ilość kwasu jest proporcjonalna do ilości zasady sodowej potrzebnej do całkowitego zobojętnienia roztworu
(CHCl + x) = Vt (Cz / Vr)
Gdzie:
CHCl - stężenie kwasu solnego
x - stężenie powstającego kwasu octowego
Cz stężenie zasady sodowej użytej do miareczkowania
Vr objętość roztworu pobranego do miareczkowania
Vt objętość zasady sodowej potrzebna do zobojętnienia kwasów zawartych w roztworze w danej chwili
W warunkach doświadczenia, stosunek stężenia zasady sodowej i objętości roztworu pobranego do miareczkowania jest wielkością stałą. Łączną zawartość kwasu octowego i kwasu solnego wyraża równanie:
(CHCl + x) = A Vt
Jeżeli przez V0 oznaczymy objętość zasady sodowej, która zobojętnia stała ilość kwasu solnego, co odpowiada pomiarowi w chwili t = 0, a przez V∞ - objętość zasady sodowej potrzebną do zobojętnienia mieszaniny kwasów zawartej w roztworze po zakończeniu procesu hydrolizy octanu etylu, tj. dla t =∞, to prawdziwe są zależności:
CHCl = AV0
(6)
(CHCl + a) = AV∞
(7)
Zatem, stężenie początkowe estru a można obliczyć stosując równanie:
a = A(V∞ - V0)
(8)
Zaś stężenie estru w dowolnej chwili określa wzór:
(a-x) = A (V∞ - Vt)
(9)
Po podstawieniu wyrażeń (8) i (9) do równania (3) otrzymujemy zależność między stałą szybkości hydrolizy octanu etylu k a uzyskanymi wartościami objętości zasady sodowej V0, Vt, V∞
![]()
(10)
Część obliczeniowa
1.Obliczam stałe szybkości reakcji hydrolizy estru w środowisku HCl o stężeniu:
a) c = 0,5 mol/dm3
![]()
Dla V1
![]()
[ s-1 ]
Dla V2
![]()
[ s-1 ]
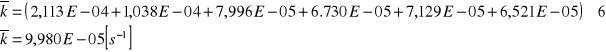
![]()
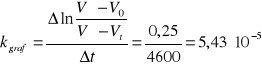
[ s-1 ]
![]()
![]()
![]()
[ s-1 ]
b) c = 1,5 mol/dm3
Dla V1
![]()
[ s-1 ]
Dla V2
![]()
[ s-1 ]
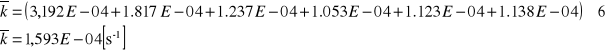
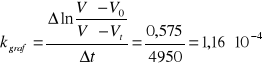
![]()
![]()
[ s-1 ]
Kwas solny c = 0,5 mol/dm3
czas [min] |
czas [s] |
Vt |
ln |
kobl [s-1] |
kśr [s-1] |
kgraf [s-1] |
knum |
|
0 |
0 |
10,5 |
0 |
0 |
|
|
|
|
10 |
600 |
11,5 |
0,1268 |
0,000211 |
|
|
|
|
27 |
1620 |
11,8 |
0,1681 |
0,000104 |
|
|
|
|
41 |
2460 |
12 |
0,1967 |
0,000080 |
9,98*10-5 |
5,43*10-5 |
7,10*10-5 |
|
56 |
3360 |
12,2 |
0,2261 |
0,000067 |
|
|
|
|
71 |
4260 |
12,7 |
0,3037 |
0,000071 |
|
|
|
|
86 |
5160 |
12,9 |
0,3365 |
0,000065 |
|
|
|
|
niesk. |
|
18,9 |
0 |
|
|
|
|
|
Kwas solny C =1,5 mol dm3
czas [min]
|
czas [s] |
Vt |
ln |
kobl [s-1] |
kśr [s-1] |
kgraf [s-1] |
knum |
||
0 |
0 |
31,5 |
0 |
0 |
|
|
|
||
10 |
600 |
33,4 |
0,1915 |
0,000319 |
|
|
|
||
25 |
1500 |
34,1 |
0,2725 |
0,000182 |
|
|
|
||
40 |
2400 |
34,3 |
0,2969 |
0,000124 |
1,593*10-4 |
1,16*10-4 |
1,16*10-4 |
||
55 |
3300 |
34,7 |
0,3475 |
0,000105 |
|
|
|
||
70 |
4200 |
35,6 |
0,4718 |
0,000112 |
|
|
|
||
85 |
5100 |
36,3 |
0,5805 |
0,000114 |
|
|
|
||
niesk |
|
42,4 |
0 |
0 |
|
|
|
||
Wnioski
Stała szybkości reakcji w środowisku kwasu solnego o C=0,5 mol/l jest mniejsza niż stała szybkości w środowisku kwasu o C=1,5 mol/l . Wynika z tego, że im większe stężenie kwasu czyli stężenie jonów wodorowych tym większa stała szybkości reakcji. Reakcja opisana w tym doświadczeniu przebiega szybciej im jest większe stężenie kwasu. Jony wodorowe są katalizatorem i powodują wzrost szybkości tej reakcji.
Wyszukiwarka
Podobne podstrony:
Fizyczna27m, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna u
Sprawozdanie damiana nr 1, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i
poprawa II 25, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna
Chfizyczna5, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna u
moje 4, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna uł, Ch
wfizyczna9, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna uł
chemia fizyczna-ćwiczenie 22, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczn
fizyczna 20, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna u
fizyczna25, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna uł
Wstęp teoretyczny, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i anality
poprawa, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna uł, C
fIZYCZNA5, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna uł,
13 fiza word, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna
fizyczna nr 17 moja, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i anali
moje 18, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna uł, C
iza 25, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna uł, Ch
sprawozdanie 35 wstep, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i ana
więcej podobnych podstron