ĆWICZENIE 8-2
Miareczkowanie potencjometryczne z wykorzystaniem reakcji utleniania i redukcji
CEL ĆWICZENIA:
Celem ćwiczenia jest zapoznanie się z elektrodami typu redox, miareczkowaniem potencjometrycznym układu redox, oraz wyznaczeniem potencjałów standardowych redox. Doświadczenie ma również na celu określenie ilości K4Fe(CN)6 na podstawie miareczkowania potencjometrycznego w analizowanym roztworze.
WSTĘP TEORETYCZNY
Elektrodą redoks - są to elektrody zbudowane z metalu (platyny lub innego obojętnego chemicznie metalu będącego przekaźnikiem elektronów) zanurzonego w roztworze zawierającym układ redox ( jony tego samego pierwiastka na różnych stopniach utleniania).
Elektrody redox znajdują zastosowanie w potencjometrii (miareczkowanie potencjometryczne). Stosuje się wówczas ogniwo pomiarowe złożone z elektrody redoks (badanej) i elektrody odniesienia (porównawczej np. kalomelowej lub chlorosrebrowej). Podczas miareczkowania mierzymy wartość siły elektromotorycznej, która jest różnicą potencjałów elektrody porównawczej i elektrody badanej. Zmiany wartości SEM są wynikiem zmian wartość potencjału elektrody redox, ponieważ potencjał elektrody porównawczej jest stały). Wzrost SEM jest związany ze wzrostem stężenia jonów ( formy utlenionej) układu redox.
WYKONANIE ĆWICZENIA:
Aparatura: pehametr (do pomiaru SEM), nasycona elektroda kalomelowa, elektroda platynowa, zlewka (100cm3), mieszadło magnetyczne, biureta do miareczkowania, kolba miarowa (100cm3), pipeta o pojemności 10cm3,
Roztwór K2Cr2O7 o stężeniu 0,0055mol∙dm-3
Roztwór HCl o stężeniu 0,5 mol∙dm-3
Kolbę o pojemności 100cm3 z nieznaną ilością K2Fe(CN)6 (nieznanym stężeniu) dopełniono do kreski wodą destylowaną i po dokładnym wymieszaniu odmierzono 10cm3 za pomocą pipety Mohra do zlewki.
Do zlewki wlano również 10cm3 HCl oraz umieszczono mieszadełko. Zlewkę ustawiono na podstawie mieszadła magnetycznego, umieszczono w zlewce elektrody podłączone do pehametru. Do zlewki dodano wody destylowanej w celu odpowiedniego zanurzenia elektrod.
Po włączeniu mieszadła oraz pehametru odczytano początkową wartość SEM wpisując dane do tab. Rozpoczęto miareczkowanie potencjometryczne dodając, co jakiś czas porcję 0,5cm3 roztworu K2Cr2O7 za pomocą biurety, po krótkim czasie odczytując za każdym razem wartość SEM, na pehametrze i wpisując dane do tabeli
W zlewce zachodzi następująca reakcja:
6Fe(CN)6 4- + Cr2O7 2- + 14H+ 6Fe(CN)6 3- + 2 Cr3+ +7H2O (1)
W miarę zbliżania się do PRM (punktu równoważności molowej) następowały coraz większe skoki SEM ogniwa
W celu sprządzenia dokładnego wykresu zależności wartości SEM ogniwa od objętości dodawanego roztworu dwuchromianu potasu doświadczenie powtórzono dodając w okolicach dużego skoku SEM mniejsze porcje K2Cr2O7. Dane drugiego miareczkowania umieszczono w Tabeli Nr 1.
Wyznaczono punkt równoważności molowej z wykresów:
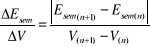
Esem = f(V)∆Esem/∆V = f(V) gdzie, (2)
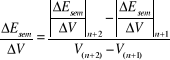
∆2 Esem/∆V2 = f(V) gdzie, (3)
Na podstawie odczytanej z wykresów objętości VPRM i podanego stężenia roztworu K2Cr2O7 (Cm=0,0055mol∙dm-3) oraz objętości roztworu K4Fe(CN)6 użytej domiareczkowania (10cm3) korzystając z równania (1) obliczono masę K4Fe(CN)6 zawartą w 100cm3 analizowanego roztworu.
OPRACOWANIE WYNIKÓW + Obliczenia
Tabela Nr 1. Zestawinie wyników miareczkowania potencjometrycznego roztworu K4Fe(CN)6 za pomocą mianowanego roztworu K2Cr2O7.
Tabela przedstawia zależność zmierzonej siły elektromotorycznej ogniwa od objętości dodanego roztworu K2Cr2O7, oraz obliczenia które posłużyły do sporządzenia wykresów 2 i 3 i wyznaczenia PRM.
Nr pomiaru |
Objętość dodanego roztworu K2Cr2O7 V[cm3] |
Zmierzona wartość Esem [mV] |
∆Esem/∆V |
∆2 Esem/∆V2 |
1 |
0,0 |
270 |
80 |
-0,40 |
2 |
0,5 |
310 |
40 |
0,00 |
3 |
1,0 |
330 |
32 |
0,50 |
4 |
1,5 |
346 |
32 |
0,50 |
5 |
2,0 |
362 |
40 |
0,00 |
6 |
2,5 |
382 |
50 |
8,00 |
7 |
2,6 |
387 |
50 |
-2,22 |
8 |
2,7 |
392 |
90 |
1,43 |
9 |
2,8 |
401 |
70 |
8,75 |
10 |
2,9 |
408 |
80 |
-1,33 |
11 |
3,0 |
416 |
150 |
0,77 |
12 |
3,1 |
431 |
130 |
5,71 |
13 |
3,2 |
444 |
140 |
0,00 |
14 |
3,3 |
458 |
220 |
34,09 |
15 |
3,4 |
480 |
220 |
-5,46 |
16 |
3,5 |
502 |
970 |
-5,91 |
17 |
3,6 |
599 |
440 |
7,78 |
18 |
3,7 |
643 |
180 |
-9,37 |
19 |
3,8 |
661 |
320 |
1,00 |
20 |
3,9 |
693 |
20 |
-1,09 |
21 |
4,0 |
695 |
22 |
3,60 |
22 |
4,5 |
706 |
10 |
-1,14 |
23 |
5,0 |
711 |
28 |
1,00 |
24 |
5,5 |
725 |
12 |
-1,33 |
25 |
6,0 |
719 |
6 |
0,00 |
26 |
6,5 |
722 |
2 |
0,00 |
27 |
7,0 |
723 |
2 |
-2,00 |
28 |
7,5 |
724 |
2 |
|
29 |
8,0 |
725 |
|
|
SPOSTRZEŻENIA i WNIOSKI
Cel doświadczenia został w pełni zrealizowany. Udało nam się wyznaczyć liczbę gramów K4Fe(CN)6 zawartą w 100cm3 badanego roztworu i wynosi ona:
![]()
Na podstawie wykresu Esem=f(V) udało nam się również wyznaczyć wartości standardowe potencjałów elektrod redoks. Wynoszą one kolejno:
![]()
![]()
Wyznaczone wartości prównaliśmy z tablicowymi, które wynoszą odpowiednio:
![]()
0,36 [V]
![]()
1,33 [V]
Naszym zdaniem pomiary, które uzyskaliśmy w trakcie doświadczenia należy uznać za dokładne, zważywszy na fakt, że miareczkowanie przeprowadzaliśmy dwukrotnie uzyskując analogiczne (praktycznie identyczne) wyniki.
Wyszukiwarka
Podobne podstrony:
7[1].1(2), Technologia żywnosci i Żywienie człowieka, 2 semestr, chemia fizyczna, chemia fizyczna, s
SPRAWOZDANIE-4-1-1, Technologia żywnosci i Żywienie człowieka, 2 semestr, chemia fizyczna, chemia fi
10-1-gr-11-A, Technologia żywnosci i Żywienie człowieka, 2 semestr, chemia fizyczna, chemia fizyczna
2015 pyt tren do wykł VII, Technologia żywnosci i Żywienie człowieka, 2 semestr, chemia fizyczna, ch
Numer i tytuł ćwiczenia, Technologia żywnosci i Żywienie człowieka, 2 semestr, chemia fizyczna, chem
ch fizyczna 13, POLITECHNIKA ŁÓDZKA, Technologia Żywności i Żywienia Człowieka, semestr 4, Chemia fi
pytania treningowe wykład II 2015, Technologia żywnosci i Żywienie człowieka, 2 semestr, chemia fizy
Zagadnienia teoretyczne 41, POLITECHNIKA ŁÓDZKA, Technologia Żywności i Żywienia Człowieka, semestr
2015 pytania tren do wykł VI, Technologia żywnosci i Żywienie człowieka, 2 semestr, chemia fizyczna,
pyt tren wykł III 2015, Technologia żywnosci i Żywienie człowieka, 2 semestr, chemia fizyczna, chem
6-1, Technologia żywnosci i Żywienie człowieka, 2 semestr, chemia fizyczna, chemia fizyczna, sprawoz
Część teoretyczna do kolokwium C, POLITECHNIKA ŁÓDZKA, Technologia Żywności i Żywienia Człowieka, se
8-1, Technologia żywnosci i Żywienie człowieka, 2 semestr, chemia fizyczna, chemia fizyczna, sprawoz
Fizyczna 43, POLITECHNIKA ŁÓDZKA, Technologia Żywności i Żywienia Człowieka, semestr 4, Chemia fizyc
wykresy15, POLITECHNIKA ŁÓDZKA, Technologia Żywności i Żywienia Człowieka, semestr 4, Chemia fizyczn
(10-1), Technologia żywnosci i Żywienie człowieka, 2 semestr, chemia fizyczna, chemia fizyczna, spra
moje ChF 54, POLITECHNIKA ŁÓDZKA, Technologia Żywności i Żywienia Człowieka, semestr 4, Chemia fizyc
sprawozdanie-4-1, Technologia żywnosci i Żywienie człowieka, 2 semestr, chemia fizyczna, chemia fizy
więcej podobnych podstron