Opracowanie i dyskusja wyników pomiarów
Przeliczenie odczytanych wartości h' w mmH2O na mmHg i na Pa.
- mmHg
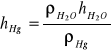
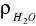
=1·103 kg/m3 gęstość wody
![]()
=13,6·103 kg/m3 gęstość rtęci
![]()
,![]()
- wysokość słupa wody i rtęci
dla pierwszego punktu pomiarowego : h''=103·h'/13600=103·206/13600=15,15 mmHg
- na Pa
760mmHg=1atm=1,013·105 N/m2=1,013·105 Pa
dla pierwszego punktu pomiarowego p'=h''·1,013·105 /760=15,15·1,013·105/760=2018,9Pa
resztę wyników ponizej umieściłam w tabeli.
Nadciśnienie |
h' |
h" |
p' |
p=b+p' |
τ |
T |
nr pomiaru |
[mmH20] |
[mmHg] |
[Pa] |
[Pa] |
[K] |
[K] |
1 |
206 |
15,15 |
2018,9 |
103019 |
4,62 |
373,15 |
2 |
193,5 |
14,23 |
1896,4 |
102896 |
4,59 |
373,12 |
3 |
175 |
12,87 |
1715,1 |
102715 |
4,55 |
373,08 |
4 |
158 |
11,62 |
1548,5 |
102549 |
4,51 |
373,04 |
5 |
143 |
10,51 |
1401,5 |
102401 |
4,46 |
372,99 |
6 |
119 |
8,75 |
1166,3 |
102166 |
4,4 |
372,93 |
7 |
102 |
7,50 |
999,7 |
102000 |
4,36 |
372,89 |
8 |
82,5 |
6,07 |
808,6 |
101809 |
4,31 |
372,84 |
9 |
56 |
4,12 |
548,8 |
101549 |
4,24 |
372,77 |
10 |
23 |
1,69 |
225,4 |
101225 |
4,15 |
372,68 |
|
|
|
|
|
|
|
Podciśnienie |
h' |
h" |
p' |
p=b+p' |
τ |
T |
nr pomiaru |
[mmH20] |
[mmHg] |
[Pa] |
[Pa] |
[K] |
[K] |
1 |
221 |
16,25 |
2166,0 |
98834 |
3,46 |
371,88 |
2 |
195,5 |
14,38 |
1916,0 |
99084 |
3,57 |
371,93 |
3 |
178,5 |
13,13 |
1749,4 |
99251 |
3,61 |
372,00 |
4 |
159,5 |
11,73 |
1563,2 |
99437 |
3,67 |
372,05 |
5 |
143,5 |
10,55 |
1406,4 |
99594 |
3,71 |
372,10 |
6 |
114 |
8,38 |
1117,3 |
99883 |
3,78 |
372,16 |
7 |
83 |
6,10 |
813,5 |
100187 |
3,86 |
372,21 |
8 |
69,5 |
5,11 |
681,1 |
100319 |
3,90 |
372,27 |
9 |
52,5 |
3,86 |
514,5 |
100485 |
3,94 |
372,31 |
10 |
25 |
1,84 |
245,0 |
100755 |
4,01 |
372,37 |
Obliczenie ciśnienie p [Pa] dla nadciśnienia p=b+p' i dla podciśnienia p=b-p'.
b-ciśnienie atmosferyczne=1010hPa
dla pierwszego punktu pomiarowego:p=101000+2018,9=103019Pa
Wykres p=f(
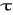
)
Odczyt z wykresu p=f(T) temperatury wrzenia wody Tb odpowiadającą ciśnieniu atmosferycznemu b.
Tb=T=372,63K
Obliczenie na podstawie wykresu p=f(T) metodą graficzną współczynnika prężności pary
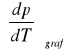
.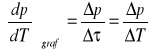
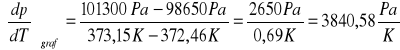
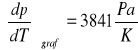
Współczynnik
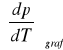
obliczyłam metodą najmniejszych kwadratów wykorzystując funkcję REGLINP w Excelu.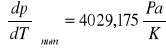
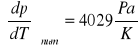
Wiedząc, że molowe objętości wody w stanie pary Vβ i cieczy Vα wynoszą
Vβ=30,062⋅10-3 m3mol-1, Vα=0,019⋅10-3 m3mol-1 obliczam z przekształconego równania Clausiusa-Clapeyrona molową entalpię parowania ΔHpar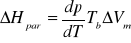
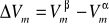
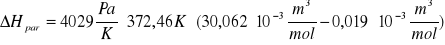
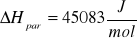
Obliczam molową entropię parowania wody ΔSpar w temperaturze Tb
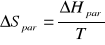
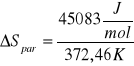
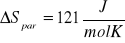
Wartość wynikająca z równania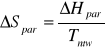
dla wielu cieczy wynosi 88 J/molK.
Uzyskana przeze mnie wartość molowej entalpii parowania wody jest wyższa. Wynika to z tego, że odstępstwa od tej reguły wykazują związki ulegające asocjacji. We wszystkich cieczach ( również w wodzie) wykazujących większe wartości entropii parowania, występuje asocjacja cząsteczek przez wiązanie wodorowe. W przypadku wody dla Tntw=373K i ΔHpar=40656J/mol molowa entropia parowania wody ΔSpar wynosi 109J/mol.
Nadciśnienie |
h' |
hHg |
p' |
p=b+p' |
τ |
T |
nr pomiaru |
[mmH20] |
[mmHg] |
[Pa] |
[Pa] |
[K] |
[K] |
1 |
283 |
20,81 |
2773,6 |
101424 |
4,25 |
373,15 |
2 |
188 |
13,82 |
1842,5 |
100493 |
4,03 |
372,93 |
3 |
167,5 |
12,32 |
1641,6 |
100292 |
3,99 |
372,89 |
4 |
144 |
10,59 |
1411,3 |
100061 |
3,92 |
372,82 |
5 |
125 |
9,19 |
1225,1 |
99875 |
3,88 |
372,78 |
6 |
104 |
7,65 |
1019,3 |
99669 |
3,83 |
372,73 |
7 |
85 |
6,25 |
833,1 |
99483 |
3,77 |
372,67 |
8 |
65 |
4,78 |
637,0 |
99287 |
3,73 |
372,63 |
9 |
43 |
3,16 |
421,4 |
99071 |
3,68 |
372,58 |
10 |
24 |
1,76 |
235,2 |
98885 |
3,62 |
372,52 |
Nadciśnienie |
h' |
hHg |
p' |
p=b+p' |
τ |
T |
nr pomiaru |
[mmH20] |
[mmHg] |
[Pa] |
[Pa] |
[K] |
[K] |
1 |
210 |
15,44 |
2058,1 |
96592 |
2,98 |
371,88 |
2 |
188,5 |
13,86 |
1847,4 |
96803 |
3,03 |
371,93 |
3 |
168 |
12,35 |
1646,5 |
97003 |
3,10 |
372,00 |
4 |
148 |
10,88 |
1450,5 |
97199 |
3,15 |
372,05 |
5 |
128 |
9,41 |
1254,5 |
97396 |
3,20 |
372,10 |
6 |
106,5 |
7,83 |
1043,8 |
97606 |
3,26 |
372,16 |
7 |
88 |
6,47 |
862,5 |
97788 |
3,31 |
372,21 |
8 |
64 |
4,71 |
627,2 |
98023 |
3,37 |
372,27 |
9 |
48,5 |
3,57 |
475,3 |
98175 |
3,41 |
372,31 |
10 |
26 |
1,91 |
254,8 |
98395 |
3,47 |
372,37 |
Celem ćwiczenia było wyznaczenie molowej entalpii i entropii parowania wody na podstawie pomiaru temperaturowego współczynnika prężności pary. Współczynnik prężności pary wyznaczony metodą graficzną wynosi 3841 Pa/K, a metodą numeryczną 4029 Pa/K. Różnica pomiędzy tymi dwiema wartościami wynika ze zbyt małej precyzji wykreślania wykresu i późniejszego odczytu wartości. Dlatego też dalsze obliczenia opierają się na wartości temperaturowego współczynnika prężności pary obliczonej metodą numeryczną. Wyliczona wartość molowej entalpii parowania ΔHpar wynosi 45083 J/mol natomiast molowa entropia parowania wody ΔSpar wynosi 121 J/mol K. Wyniki różnią się od wartości tablicowych (dla wody), gdzie ΔHpar=40,7kJ/mol (p=1atm) a ΔSpar=109 J/molK (t=25°C). Różnice te wynikają z warunków w jakich przeprowadzony został pomiar (p=986,5hPa i t=23°C) oraz z błędów popełnianych podczas odczytu wysokości słupa wody (odczytujący mógł patrzeć pod różnym kątem i z różnej wysokości).
3
Wyszukiwarka
Podobne podstrony:
33 Temperaturowy współczynnik prężności pary wodnej i ental
, chemia fizyczna, wyznaczanie ciepła parowania cieczy z pomiarów prężności pary metodą izoteniskopo
ćw 4 Zależność prężności pary od temperatury destylacja
zadania2 preznosc pary nasyconej oraz gestosc cieczy i gazow, Technologia chemiczna, Podstawy techno
Fizyczna prężność pary nasyconej
POMIAR ENTALPII PAROWANIA WYSOKO WRZĄCEJ CIECZY moje
Wykresy ciśnienia pary wodnej (2)
Preżnosc pary
Wyznaczanie ciepła parowania wody na podstawie zależności temperatury wrzenia od ciśnienia
dachy Metodyka obliczeń izolacyjności cieplnej dachów, określanie ryzyka kondensacji pary wodnej
Wykład 6 1 Produkty kondensacji pary wodnej
T.17 Termodynamika pary wodnej
Entalpia parowania
Wykresy ciśnienia pary wodnej
Folie jako opóźniacze pary wodnej i powietrza
7,2, 7.2, POMIAR ENTALPII PAROWANIA WYSOKO WRZĄCEJ CIECZY
parametry pary wodnej na lini nasycenia, Wykłady i ćwiczenia
więcej podobnych podstron