![]()
lub ![]()
Robert Maniura
Sprawozdanie z ćwiczenia nr 4: Napięcie rozkładowe elektrolitu.
Wstęp teoretyczny:
Jeżeli daną elektrodę metaliczną M zanurzy się do roztworu elektrolitu zawierającego jony Mz+, na granicy zetknięcia metal-roztwór zachodzą dwa procesy:
1) jony Mz+ przechodzą z metalu do roztworu - jest to tzw. prąd anodowy, Ia;
2) jony Mz+ znajdujące się w roztworze wędrują do metalu - jest to tzw. prąd katodowy, Ik.
Jeżeli szybkości tych dwóch procesów są równe, mówimy, że osiągnięty został stan równowagi dynamicznej. W stanie równowagi dynamicznej prąd katodowy Ik i anodowy Ia są równe (Ia = Ik). Elektroda osiąga wtedy potencjał równowagowy, który w tym przypadku wyrazimy wzorem:
![]()
lub ![]()
Jeżeli do takiej elektrody zostanie przyłożone napięcie z zewnątrz (np. podczas elektrolizy), to potencjał tej elektrody ulegnie zmianie. Zmiana ta będzie tym większa, im silniejszy będzie przepływający przez elektrolit prąd. Zjawisko to nosi nazwę polaryzacji elektrolitycznej, natomiast wytwarzającą się różnicę pomiędzy potencjałem elektrody w stanie równowagi a potencjałem podczas przepływu przez nią prądu nazwano nadnapięciem.
Jeżeli oznaczymy potencja elektrody w stanie równowagi przez I a potencjał elektrody podczas przepływu przez nią prądu - II wzór na nadnapięcie będzie miał postać:
= I - II
Przykładowo do elektrolizera nalejmy rozcieńczonego kwasu siarkowego i zanurzmy w nim dwie elektrody (np. platynowe). Zestawmy układ elektryczny składający się z baterii prądu stałego E, miernika napięcia i miliamperomierza. Zbadajmy zależność pomiędzy natężeniem prądu (wskazanym przez miliamperomierz) oraz napięciem przykładanym do elektrod. W doświadczeniu tym stwierdza się, że początkowe zwiększenie napięcia przyłożonego do elektrod nie powoduje dużego wzrostu natężenia prądu i nie obserwuje się zjawiska elektrolizy. Elektroliza zaczyna zachodzić intensywnie dopiero powyżej napięcia około 1,7 V. Przy tym napięciu obserwuje się wydzielanie banieczek gazu na elektrodach. Począwszy od tego napięcia następuje gwałtowny wzrost natężenia prądu.
Napięcie, przy którym zaczyna się elektroliza z intensywnym wydzielaniem się gazów na elektrodach, nazywa się napięciem rozkładowym (oznaczone U). Powodem występowania tego napięcia jest zjawisko polaryzacji, które w przypadku omówionego doświadczenia wyjaśnia się w następujący sposób.
W wyniku przepuszczania przez roztwór kwasu siarkowego(VI) prądu elektrycznego o niedużym natężeniu wydziela się na katodzie wodór wskutek rozkładu H2SO4, a na anodzie - tlen. Powstaje w ten sposób ogniwo tlenowo-wodorowe. Siła elektromotoryczna tak utworzonego ogniwa jest przeciwnie skierowana do napięcia elektrycznego, przyłożonego z zewnętrz do elektrod. W wyniku tego następuje kompensacja napięcia i siły elektromotorycznej i prąd elektryczny w układzie nie osiąga dużych wartości.
W przypadku roztworu kwasu siarkowego(VI) elektroliza powinna intensywnie zachodzić już powyżej 1,23 V, ponieważ taka jest wartość siły elektromotorycznej tworzącego się ogniwa wodorowo-tlenowego. Z doświadczeń wynika, że elektroliza zachodzi jednak dopiero powyżej 1,7 V. Różnica ta 1,7 V-1,23 V jest spowodowana polaryzacją elektrod i jest ona liczbową miarą nadnapięcia.
Wielkość nadnapięcia zależy od wielu czynników, jak: rodzaj elektrod, gęstość prądu, stan powierzchni elektrod itd. Przy zastosowaniu elektrod gładkich nadnapięcie ma większą wartość niż w przypadku elektrod porowatych. Z praktyki wiadomo, że na porowatej platynie wydzielanie wodoru przebiega łatwiej niż na gładkiej. Duże wartości nadnapięcia przy wydzielaniu wodoru wykazują metale, np.: cynk, ołów, rtęć.
Wskutek występowania polaryzacji podczas elektrolizy mogą tworzyć się różne produkty. Na przykład podczas elektrolizy wodnego roztworu chlorku sodowego NaCl na katodzie może wydzielać się wodór lub sód, w zależności od materiału katody. Jeżeli katoda jest z platyny lub grafitu, wydziela się wodór, natomiast gdy katodą jest rtęć, wydziela się sód.
Opracowanie wyników:
Obliczam teoretyczne napięcie rozkładowe elektrolitów.
dla roztworu HCl:
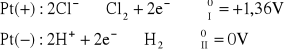
napięcie rozkładowe wynosi: ![]()
dla roztworu NaOH:
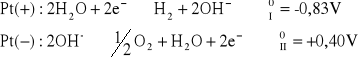
napięcie rozkładowe wynosi: ![]()
dla roztworu ZnSO4:
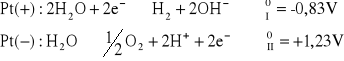
napięcie rozkładowe wynosi: ![]()
dla roztworu CuSO4:
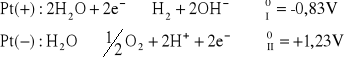
napięcie rozkładowe wynosi: ![]()
Wyznaczam, z wykresów zależności natężenia prądu od przyłożonego napięcia, jakie są wartości napięć rozkładowych dla poszczególnych elektrolitów oraz obliczam nadnapięcia.
dla roztworu HCl: UR = 1,795
nadnapięcie wynosi: ![]()
dla roztworu NaOH: UR = 2,43
nadnapięcie wynosi: ![]()
dla roztworu ZnSO4: UR = 2,71
nadnapięcie wynosi: ![]()
dla roztworu CuSO4: UR = 1,70
nadnapięcie wynosi: ![]()
4. Wnioski:
Prąd dyfuzyjny jest podstawowym prądem wykorzystywanym podczas elektrolizy elektrolitów. Wobec braku migracji i konwekcji (roztwór nie jest mieszany) dyfuzja jest jedyną drogą transportu depolaryzatora do powierzchni elektrody. W takich warunkach prąd graniczny jest proporcjonalny do współczynnika dyfuzji. Obok prądu dyfuzyjnego w polarografii mogą występować:
prąd migracyjny - pojawia się wówczas, gdy stosujemy roztwory elektrolitu o niedostatecznym stężeniu; w takim przypadku jony depolaryzatora migrują w polu elektrycznym, a efektem jest prąd migracyjny;
prąd pojemnościowy - przyczyną występowania tego prądu jest ładowanie się podwójnej warstwy elektrycznej na powierzchni kropli rtęci; prąd ten określa się także mianem prądu ładowania lub prądu kondensatorowego;
prąd katalityczny - jest wynikiem wtórnych reakcji katalitycznych w roztworze;
prąd adsorpcyjny - powstaje w wyniku adsorpcji niektórych związków na powierzchni elektrody;
Czyli na napięcie rozkładowe składają się różne prądy, które powodują że występuje duże różnice między napięciem teoretycznym a rzeczywistym.
Literatura:
Kazimierz Gumiński „Wykłady z chemii fizycznej”;
Wiesław Karpiński „Chemia fizyczna dla techników chemicznych”
Peter William Atkins „Podstawy chemii fizycznej”
1