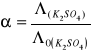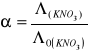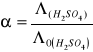Robert Maniura
Sprawozdanie z ćwiczenia nr 5: Przewodnictwo równoważnikowe elektrolitów.
Wyniki ćwiczenia:
Temperatury roztworów 180C.
2. Wstęp teoretyczny:
Szczególnym rodzajem roztworu ciekłego jest ten, w którym cząsteczki rozpuszczone, czy też agregaty tworzące się wokół nich, są naładowane elektrycznie i tworzą jony. Roztwory takie przewodzą prąd elektryczny, a z jego przepływem związana jest elektroliza, czyli wydzielanie się substancji na elektrodach na skutek rozładowania się na nich jonów. Roztwory takie nazywamy roztworami elektrolitów. Substancje, które przy rozpuszczaniu w danym rozpuszczalniku tworzą takie roztwór, nazywamy elektrolitami.
Fundamentalnym zjawiskiem odróżniającym roztwory elektrolitów od innych roztworów jest, jak już powiedziane było wcześniej, ich przewodnictwo jonowe i zjawisko elektrolizy. Podstawowymi prawami elektrolizy są prawa Faradaya, określające związek między ładunkiem elektrycznym, który przepłynął przez roztwór, a wydzieloną na elektrodach masą substancji.
Ładunek ![]()
(gdzie ![]()
to liczba Faradaya równa ![]()
) rozładowuje jeden gramorównoważnik chemiczny jonów. Jeżeli wartościowość jonu jest różna od jedności i wynosi na przykład ![]()
, to wówczas dla rozładowania jednego mola takich jonów potrzeba ładunku wynoszącego ![]()
kulombów. Przez równoważnik elektrochemiczny ![]()
danego jonu rozumiemy liczbę gramów wydzielonych przez przepływ 1 kulomba. Stąd
![]()
gdzie ![]()
jest masą jednego mola jonów.
Zgodnie z tym, jeżeli wartościowość jonów wynosi ![]()
i jeżeli przez roztwór przepływa prąd o natężeniu ![]()
przez czas ![]()
, wówczas liczba moli wydzielonej substancji wyniesie
![]()
stąd na wydzieloną masę otrzymamy wzór ![]()
czyli, znane prawo Faradaya ma postać ![]()
Prawo to mówi, że masa danej substancji, ulegającej na elektrodzie, jest proporcjonalna do ładunku, jaki przepłynął przez obwód, oraz że masy różnych substancji ulegających reakcji na elektrodach przy przepływie danego ładunku są proporcjonalne do ich równoważników elektrochemicznych.
Prawo Faradaya w postaci
![]()
służy jako podstawa definicji jednostki natężenia prądu, ampera. Ta metoda oznaczania wielkości ładunku przepływającego w obwodzie nosi nazwę kulometrii.
W czasie elektrolizy naładowane jony doznają w polu elektrycznym działania siły. Siła ta jest zależna od natężenia pola oraz od ładunku jonu. Dzięki jej działaniu jon uzyskuje pewne przyspieszenie w kierunku linii pola. Przyspieszenie to jest oczywiście odwrotnie proporcjonalne do masy jonu. Zauważmy jednak, że jon, tak jak wszystkie cząstki w roztworze, podlega bezwładnym ruchom cieplnym. W rezultacie zatem działania pola elektrycznego wykazuje on pewną dodatkową składową ruchu wzdłuż linii pola. Dzięki niej jony poruszają się w polu elektrycznym płynąc w roztworze ku elektrodom.
Ruchowi temu przeciwstawia się opór ośrodka. Opór ten zależy od szeregu czynników, przede wszystkim od struktury bliskiego zasięgu, w jakiej tkwi jon, od sił wzajemnych oddziaływań, a zatem od stężenia, od wielkości samego jonu, od lepkości roztworu itp. Opór ten wzrasta szybko wraz z prędkością jonu, tak że jego ruch staje się prawie natychmiast po włączeniu pola ruchem jednostajnym.
Prędkość zatem, z jaką poruszać się będzie jon wzdłuż linii pola, będzie zależeć od natężenia pola, ładunku jonu, jego masy, a również od temperatury, rodzaju ośrodka, stężenia, lepkości, wielkości jonu.
Doświadczenie uczy, że w tych warunkach roztwory elektrolitów stosują się do prawa Ohma.
Ponieważ gęstość prądu, a więc ładunek przepływający w jednej sekundzie przez przekrój 1 cm2, prostopadły do kierunku prądu, jest równa iloczynowi liczby jonów w 1 cm3 i ich prędkości w kierunku pola, a liczba jonów nie zależy od natężenia prądu, przeto ze stosowania się roztworów elektrolitów do prawa Ohma wynika, że prędkość jonów jest proporcjonalna do natężenia prądu.
Opierając się na proporcjonalności wprowadzamy pojęcie ruchliwości jonu. Rozumiemy przez nie bezwzględną wartość jego prędkości przy natężeniu pola równym jedności. Jest to wielkość charakterystyczna dla danego jonu.
Konsekwencją różnej ruchliwości różnych jonów jest, że w przenoszeniu ładunku w roztworze w czasie elektrolizy aniony i kationy biorą udział w różnym stopniu.
Ponieważ roztwór elektrolitu jako całość jest na zewnątrz elektrycznie obojętny i w każdym centymetrze sześciennym roztworu zachodzi równość ładunku obu znaków, przeto spełnione jest wszędzie równanie
![]()
stąd ![]()
a więc ![]()
Oczywiście ![]()
i ![]()
są na ogół różne, gdyż różne są na ogół ![]()
i ![]()
.
Ułamek całkowitego ładunku ![]()
, przepływającego przez przekrój 1 cm2 w ciągu 1 sekundy, przenoszony przez dany rodzaj jonów, nazywamy za Hittorfem liczbą przenoszenia tych jonów. Zgodnie z tą definicją liczby przenoszenia kationów i anionów dane są równaniami
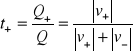
oraz 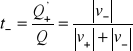
wynika z tej definicji, że ![]()
Z samej definicji liczb przenoszenia wynika, że nie są one wielkością charakterystyczną dla danego jonu, niezależnie od jego partnera. Wyrażają bowiem względne zdolności przenoszenia ładunku.
Na ogół wielkości liczb przenoszenia nie zależą silnie od stężenia roztworu. Szczególnie nieznaczna jest ta zależność u elektrolitów mocnych.
Jeśli chodzi o zależność wartości liczb przenoszenia od temperatury, to na ogół wzrastają one wraz ze wzrostem temperatury do wartości 0,5. nie jest to jednak regułą bezwzględnie obowiązującą.
Wzór na ![]()
podany powyżej podaje ładunek przepływający w ciągu 1 sekundy przez przekrój 1 cm2 prostopadły do kierunku prądu. Wyraża on zatem gęstość prądu ![]()
. Niechaj natężenia pola wynosi ![]()
. Z definicji ruchliwości jonów wynika, że moduły prędkości jonów ![]()
i ![]()
dane są równaniami
![]()
oraz ![]()
gdzie ![]()
i ![]()
oznaczają ruchliwości kationu i anionu. Możemy zatem równanie na ![]()
napisać w postaci
![]()
Wobec stosowania się roztworów elektrolitów do prawa Ohma, możemy napisać również, że
![]()
gdzie ![]()
oznacza przewodnictwo właściwe roztworu.
Przyjmując, że pole w elektrolicie jest jednorodne, możemy ostatnie równanie napisać w postaci
![]()
gdzie ![]()
jest różnicą potencjałów między elektrodami a ![]()
odległością między nimi.
Jeżeli przekrój warstwy elektrolitu, poprzeczny do kierunku prądu, oznaczymy przez ![]()
, to wówczas natężenie prądu dane będzie wyrażeniem
![]()
stąd ![]()
czyli ![]()
gdzie ![]()
oznacza opór przewodzącej warstwy elektrolitu.
Przewodnictwo właściwe ![]()
jest oczywiście odwrotnością oporu właściwego ![]()
Różnice w przewodnictwie właściwym różnych elektrolitów mogą być podstawą tzw. miareczkowania konduktometrycznego.
Badania nad zależnością przewodnictwa właściwego roztworów elektrolitów od temperatury i od stężenia pozwoliły stwierdzić, że przewodnictwo to rośnie z temperaturą. Zachowuje się zatem odmiennie od przewodnictwa metali, które ze wzrostem temperatury maleje.
Inaczej przedstawia się zależność od stężenia. Gdy wychodzimy od stężeń bardzo małych, bliskich zeru, i zwiększamy je przewodnictwo właściwe elektrolitów początkowo rośnie, osiąga maksimum, po czym maleje (spowodowane to jest zmniejszeniem ruchliwości jonów, stałej dysocjacji, itp.).
Ta różnica pomiędzy przebiegiem zależności przewodnictwa od stężenia u elektrolitów słabych i mocnych zaznacza się szczególnie wyraźnie przy porównywaniu tzw. przewodnictw równoważnikowych. Przewodnictwo równoważnikowe jest to przewodnictwo wyrażone równaniem
![]()
gdzie ![]()
to przewodnictwo właściwe a ![]()
stężeniem wyrażonym w gramorównoważniku na jednostkę objętości. Przewodnictwo równoważnikowe rośnie z temperaturą, maleje natomiast ze stężeniem. Krzywa ![]()
odcina na osi rzędnych przy ![]()
pewną charakterystyczną dla danego elektrolitu wartość. Wartość tę nazywamy przewodnictwem równoważnikowym granicznym i oznaczamy symbolem ![]()
. Wyznaczenie tej wartości dla elektrolitów słabych nie jest doświadczalnie możliwe, gdyż przewodnictwo właściwe ![]()
staje się u nich, przy ![]()
, bardzo małe. Nie może być również zastosowana ekstrapolacja graficzna, gdyż przebieg krzywej ![]()
jest przy ![]()
tak stromy, że trudno jest określić ![]()
. U elektrolitów mocnych natomiast można wyznaczyć ![]()
dość dokładnie drogą ekstrapolacji. Jak się bowiem okazuje, zależność ![]()
od ![]()
, dla małych ![]()
, jest u tych elektrolitów dana równaniem ![]()
.
Kohlrausch zauważył, że wartości ![]()
różnych elektrolitów spełniają bardzo charakterystyczne prawidłowości. Jeślibyśmy obliczyli różnice wartości ![]()
dla par soli, różniących się albo wyłącznie kationem, albo wyłącznie anionem, to zauważylibyśmy, że różnice te są stałe. Ta prawidłowość nasunęła Kohlrauschowi myśl, że widocznie w rozcieńczeniu nieskończenie wielkim kationy i aniony biorą udział w przewodzeniu prądu zupełnie niezależnie od siebie. Innymi słowy, że przewodnictwa równoważnikowe graniczne składają się addytywnie z wielkości charakterystycznych dla poszczególnych jonów
![]()
Przy takiej addytywności granicznych przewodnictw równoważnikowych poszczególnych jonów, czyli niezależnego przewodzenia jonów w rozcieńczeniu granicznym, stosunek przewodnictwa równoważnikowego granicznego danego jonu do przewodnictwa równoważnikowego granicznego soli będzie równy liczbie przenoszenia tego jonu w rozcieńczeniu granicznym
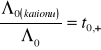
oraz 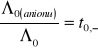
stąd ze znalezionych doświadczalnie ![]()
, ![]()
, ![]()
można obliczyć ![]()
.
Znając ![]()
dla poszczególnych jonów elektrolitów mocnych można obliczyć ![]()
dla elektrolitów słabych. W rozcieńczeniu nieskończenie wielkim równowaga dysocjacji tych elektrolitów jest oczywiście całkowicie przesunięta w stronę jonów, tak że można przyjąć ich pełną dysocjację, a stąd również niezależność przewodzenia jonów.
Jak już było wspomniane, przewodnictwo równoważnikowe wzrasta wraz z temperaturą. Jeśli roztwór elektrolitu nie jest nieskończenie rozcieńczony a elektrolit nie jest mocny, wzrost ten powodowany jest wzrostem zarówno dysocjacji jak i ruchliwości. Jeżeli elektrolit jest mocny lub roztwór jest nieskończenie rozcieńczony, wzrost ten powodowany jest wyłącznie wzrostem ruchliwości.
Prócz temperatury wpływ na ruchliwość jonów, a tym samym i na przewodnictwo równoważnikowe, ma rodzaj rozpuszczalnika.
Zjawiska elektrolitycznego przewodzenia prądu spotykamy nie tylko w roztworach wodnych i niewodnych. Można je obserwować również w stopionych związkach heteropolarnych.
Opracowanie wyników:
Wyznaczam stałą naczyńka.
Stężenie roztworu KCl [mol/l] |
Przewodnictwo właściwe (doświadczalne) [S/cm] |
Przewodnictwo właściwe (teoretyczne) [S/cm] |
Stała naczyńka |
Stała naczyńka (wartość średnia) |
0,1 |
0,01237 |
0,01213 |
0,980598222 |
0,966576449 |
0,01 |
0,001395 |
0,001329 |
0,952688172 |
|
0,001 |
0,000149 |
0,000144 |
0,966442953 |
|
Obliczam przewodnictwo równoważnikowe, stężenie wyrażone w gramorównoważnikach na jednostkę objętości oraz pierwiastek z tego stężenia.
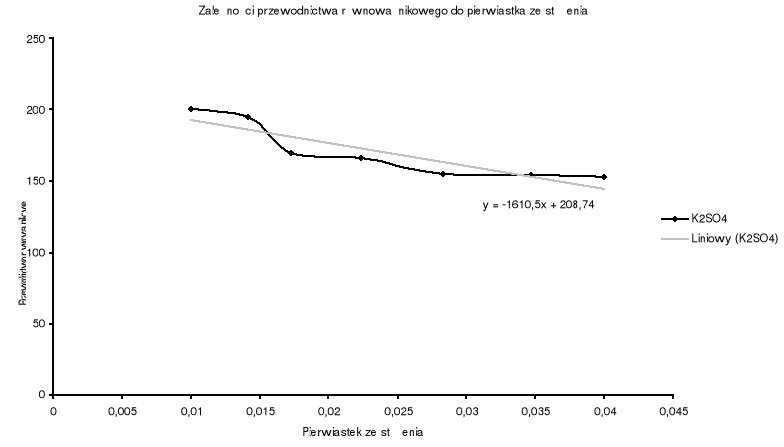
Dla K2SO4.
nr |
Objętość K2SO4 o stężeniu 0,02 mol/l |
Stężenie wyrażone w gramorównoważnikach na jednostkę objętości |
Pierwistek ze stężenia |
Przewodnictwo właściwe (zmierzone) |
Przewodnictwo równoważnikowe (wyliczone) |
1 |
0,25 |
0,0001 |
0,01 |
0,00002 |
200 |
2 |
0,5 |
0,0002 |
0,014142136 |
0,000039 |
195 |
3 |
0,75 |
0,0003 |
0,017320508 |
0,000051 |
170 |
4 |
1,25 |
0,0005 |
0,02236068 |
0,000083 |
166 |
5 |
2 |
0,0008 |
0,028284271 |
0,000124 |
155 |
6 |
3 |
0,0012 |
0,034641016 |
0,000185 |
154,1666667 |
7 |
4 |
0,0016 |
0,04 |
0,000244 |
152,5 |
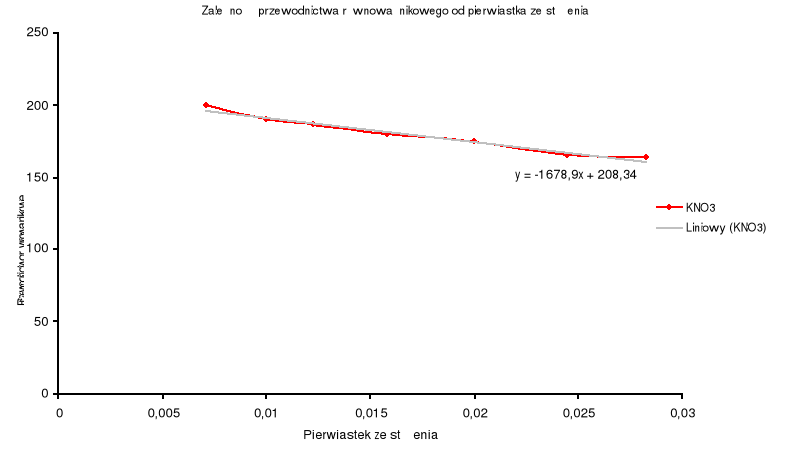
Dla KNO3.
nr |
Objętość KNO3 o stężeniu 0,02 mol/l |
Stężenie wyrażone w gramorównoważnikach na jednostkę objętości |
Pierwistek ze stężenia |
Przewodnictwo właściwe (zmierzone) |
Przewodnictwo równoważnikowe (wyliczone) |
1 |
0,25 |
0,00005 |
0,007071068 |
0,00001 |
200 |
2 |
0,5 |
0,0001 |
0,01 |
0,000019 |
190 |
3 |
0,75 |
0,00015 |
0,012247449 |
0,000028 |
186,6666667 |
4 |
1,25 |
0,00025 |
0,015811388 |
0,000045 |
180 |
5 |
2 |
0,0004 |
0,02 |
0,00007 |
175 |
6 |
3 |
0,0006 |
0,024494897 |
0,000099 |
165 |
7 |
4 |
0,0008 |
0,028284271 |
0,000131 |
163,75 |
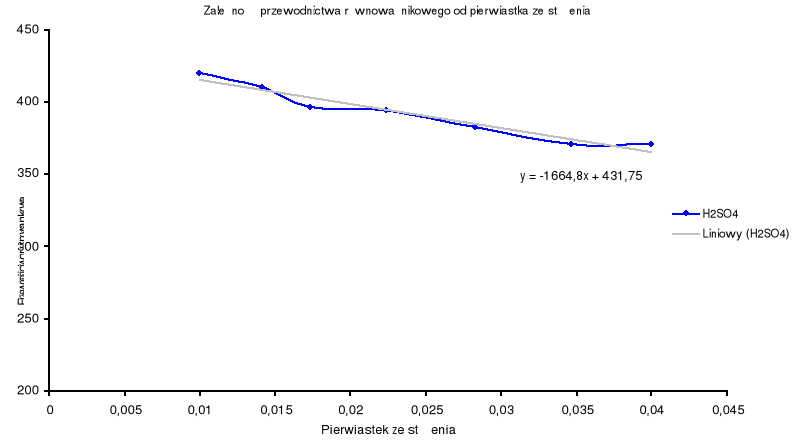
Dla H2SO4.
nr |
Objętość H2SO4 o stężeniu 0,02 mol/l |
Stężenie wyrażone w gramorównoważnikach na jednostkę objętości |
Pierwistek ze stężenia |
Przewodnictwo właściwe (zmierzone) |
Przewodnictwo równoważnikowe (wyliczone) |
1 |
0,25 |
0,0001 |
0,01 |
0,000042 |
420 |
2 |
0,5 |
0,0002 |
0,014142136 |
0,000082 |
410 |
3 |
0,75 |
0,0003 |
0,017320508 |
0,000119 |
396,6666667 |
4 |
1,25 |
0,0005 |
0,02236068 |
0,000197 |
394 |
5 |
2 |
0,0008 |
0,028284271 |
0,000306 |
382,5 |
6 |
3 |
0,0012 |
0,034641016 |
0,000445 |
370,8333333 |
7 |
4 |
0,0016 |
0,04 |
0,000593 |
370,625 |
Wyznaczam przewodnictwo równoważnikowe graniczne metodą ekstrapolacji i obliczam stałą dysocjacji poszczególnych elektrolitów.
Elektrolit |
Przewodnictwo równoważnikowe graniczne wyznaczone metodą ekstrapolacji |
K2SO4 |
208,74 |
KNO3 |
208,34 |
H2SO4 |
431,75 |
nr |
Przewodnictwo równoważnikowe |
Stała dysocjacji |
Przewodnictwo równoważnikowe |
Stała dysocjacji |
Przewodnictwo równoważnikowe |
Stała dysocjacji |
1 |
200 |
0,958129731 |
200 |
0,959969281 |
420 |
0,972785177 |
2 |
195 |
0,934176487 |
190 |
0,911970817 |
410 |
0,949623625 |
3 |
170 |
0,814410271 |
186,6666667 |
0,895971329 |
396,6666667 |
0,918741556 |
4 |
166 |
0,795247677 |
180 |
0,863972353 |
394 |
0,912565142 |
5 |
155 |
0,742550541 |
175 |
0,839973121 |
382,5 |
0,885929357 |
6 |
154,1666667 |
0,738558334 |
165 |
0,791974657 |
370,8333333 |
0,858907547 |
7 |
152,5 |
0,73057392 |
163,75 |
0,785974849 |
370,625 |
0,858425014 |
Znając wartość tablicową jednego z jonów obliczam pozostałe wartości (odczytałem z tablicy przewodnictwo równoważnikowe graniczne jonu ![]()
- ![]()
).
Dla H2SO4:
![]()
Dla K2SO4:
![]()
Dla KNO3:
![]()
Porównanie wyników z wartościami tablicowymi:
nr |
Przewodnictwo równoważnikowe (tablicowe) |
Przewodnictwo równoważnikowe (obliczone) |
Błąd procentowy |
|
73,5 |
126,79 |
72,52% |
|
80,0 |
81,95 |
2,375% |
|
71,46 |
81,55 |
14,05% |
4. Wnioski:
Błędy, które wynikły podczas doświadczenia spowodowane są niedokładnością rozcieńczania roztworów elektrolitów oraz niedokładnym wypłukaniem elektrody po każdorazowym pomiarze. Wszystkie obliczenia wykonane do sprawozdania wykazują jednak, że można z nich stworzyć wykresy nie odbiegające od ogólnie przyjętej zasady, że wykresy przewodnictwa równoważnikowego elektrolitów pokazują spadek tegoż przewodnictwa wraz ze wzrostem stężenia.
Wykresy:
6. Literatura:
Kazimierz Gumiński „Wykłady z chemii fizycznej”.
7
Stężenie roztworu KCl w [mol/l] |
Przewodnictwo właściwe KCl [S/cm] |
0,1 |
12,37 |
0,01 |
1,395 |
0,001 |
0,149 |
nr |
Objętość elektrolitu o stężeniu 0,02 mol/l w [cm3] |
Przewodnictwo właściwe K2SO4 [S/cm] |
Przewodnictwo właściwe KNO3 [S/cm] |
Przewodnictwo właściwe H2SO4 [S/cm] |
1 |
0,25 |
0,020 |
0,010 |
0,042 |
2 |
0,50 |
0,039 |
0,019 |
0,082 |
3 |
0,75 |
0,051 |
0,028 |
0,119 |
4 |
1,25 |
0,083 |
0,045 |
0,197 |
5 |
2,00 |
0,124 |
0,070 |
0,306 |
6 |
3,00 |
0,185 |
0,099 |
0,445 |
7 |
4,00 |
0,244 |
0,131 |
0,593 |
Wyszukiwarka
Podobne podstrony:
PRZEWODNICTWO RÓWNOWAŻNIKWE ELEKTROLITÓW, studia, chemia, chemia fizyczna, sprawozdania
CHEMIA - LABORATORIUM - SPRAWOZDANIE - Wyznaczanie przewodnictwa granicznego elektrolitów, STUDIA
Napięcie rozkładowe elektrolitu, Studia, Politechnika
RÓWNOWAGA CHEMICZNAcw14, Studia, Politechnika
Potencjał standardowy elektrody, Studia, Politechnika
Przewodnictwo równoważnikowe elektrolitów
Siła elektromotoryczna ogniwa galwanicznego, Studia, Politechnika
elektra Temat Y, Politechnika Lubelska, Studia, rok II, Elektorechnika
Ręczna spawanie łukowe elektrodami otulonymi, studia, studia Politechnika Poznańska - BMiZ - Mechatr
Elektronika 1 protokół, Politechnika Lubelska, Studia, Studia, sem VI, energo elektronika, z ksero n
Przewodnictwo równoważnikowe, studia, chemia, chemia fizyczna, sprawozdania
ćw. 3 - spawanie elektrodą otuloną, studia, studia Politechnika Poznańska - BMiZ - Mechatronika, 2 s
Elektrotermia 3T, Politechnika Lubelska, Studia, semestr 5, Sem V, Nowy folder
Elektronika 8 stara, Politechnika Lubelska, Studia, semestr 5, Sem V, Nowy folder
Elektronika 8 2010, Politechnika Lubelska, Studia, semestr 5, Sem V, Nowy folder
ćw 1 - Badanie rezystywności materiałów przewodzących w zależności od temperatury, Politechnika Pozn
Elektronika 3 nowa, Politechnika Lubelska, Studia, semestr 5, Sem V, Nowy folder
więcej podobnych podstron