21.03.2005r.
Łukasz Wojtal
III Chemia
Przewodnictwo równoważnikowe elektrolitów
1. Wstęp teoretyczny
Przewodnictwo jest miarą zdolności elektrolitu do przenoszenia prądu elektrycznego. Opór przewodnika elektrolitycznego R określa prawo Ohma:
![]()
gdzie: U - napięcie przyłożone do elektrod
I - natężenie prądu
Opór R jest proporcjonalny do długości l i odwrotnie proporcjonalny do przekroju S:
![]()
Współczynnik proporcjonalności ρ nazywa się oporem właściwym i wyrażony jest w [Ω·cm].
Przewodnictwem L nazywa się odwrotność oporu, zaś odwrotność oporu właściwego do przewodnictwo właściwe:
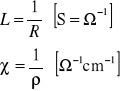
Przewodnictwo równoważnikowe Λ jest przewodnictwem roztworu jednego gramorównoważnika danego elektrolitu zawartego w naczyńku elektrolitycznym, którego ściany boczne stanowią płaskie elektrody platynowe oddalone od siebie o 1 cm.
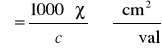
Przewodnictwo równoważnikowe maleje ze wzrostem stężenia, różnie jednak dla elektrolitów mocnych i słabych. Zależne jest także od wartościowości jonów elektrolitu.
Stosunek l/S, nazywany stałą naczyńka i oznaczany jako k, wyznacza się mierząc w tym naczyńku opór roztworu wzorcowego np. KCl, dla którego znana jest wartość przewodnictwa właściwego. Dzięki temu można wyznaczać przewodnictwo właściwe roztworu badanego Rx.
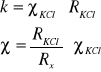
Prawo Kohlrausha dotyczy elektrolitów mocnych. Stosując ekstrapolację przewodnictwa do cႮ0 według równania:
![]()
Kohlraush otrzymał wartości granicznego przewodnictwa równoważnikowego ၌0, które jest sumą granicznych przewodnictw jonowych kationu λ0+ i anionu λ0- i oblicza się go ze wzoru:
![]()
Równanie Deby'e - Hückela - Osangera podaje zależność przewodnictwa równoważnikowego od stężenia:
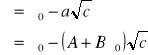
gdzie stałe A i B są określone przez właściwości rozpuszczalnika i typ elektrolitu.
2. Obliczenia
- wyznaczanie stałej naczyńka
![]()
gdzie: R - opór
χ - przewodnictwo właściwe
c [mol/dm3] |
Λ [S] |
R [Ω] |
χ [Ω-1m-1] |
k [m-1] |
0,1 |
1,95·10-2 |
51,28 |
1,28 |
65,64 |
0,01 |
2,10·10-3 |
476,19 |
0,1413 |
67,29 |
0,001 |
2,40·10-4 |
4166,67 |
0,0144 |
60,00 |
wartość średnia k: kśr = 64,31 m-1
przewodnictwo wody destylowanej: Λ = 2,85·10-6 [S]
- wyznaczanie przewodnictwa równoważnikowego
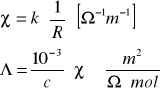
roztwór NaCl
V [cm3] |
1/R [Ω-1] |
χ [Ω-1m-1] |
Λ [m2·Ω-1] |
c [mol/dm3] |
|
0,25 |
2,47E-05 |
1,59E-03 |
0,0317 |
5,00E-05 |
0,0071 |
0,50 |
2,57E-05 |
1,65E-03 |
0,0165 |
1,00E-04 |
0,0100 |
0,75 |
3,34E-05 |
2,14E-03 |
0,0143 |
1,50E-04 |
0,0122 |
1,25 |
5,47E-05 |
3,51E-03 |
0,0141 |
2,50E-04 |
0,0158 |
2,00 |
7,44E-05 |
4,78E-03 |
0,0120 |
4,00E-04 |
0,0200 |
3,00 |
1,05E-04 |
6,73E-03 |
0,0112 |
6,00E-04 |
0,0245 |
4,00 |
1,48E-04 |
9,53E-03 |
0,0119 |
8,00E-04 |
0,0283 |
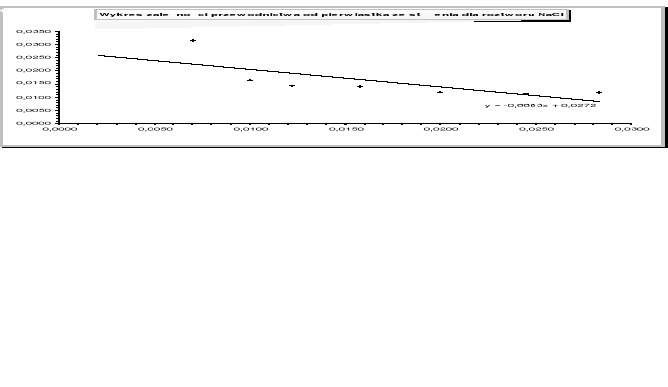
roztwór K2SO4
V [cm3] |
1/R [Ω-1] |
χ [Ω-1m-1] |
Λ [m2·Ω-1] |
c [mol/dm3] |
|
0,25 |
2,57E-05 |
1,65E-03 |
0,0330 |
5,00E-05 |
0,0071 |
0,50 |
5,47E-05 |
3,51E-03 |
0,0351 |
1,00E-04 |
0,0100 |
0,75 |
7,17E-05 |
4,61E-03 |
0,0307 |
1,50E-04 |
0,0122 |
1,25 |
1,13E-04 |
7,28E-03 |
0,0291 |
2,50E-04 |
0,0158 |
2,00 |
1,42E-04 |
9,14E-03 |
0,0229 |
4,00E-04 |
0,0200 |
3,00 |
2,68E-04 |
1,72E-02 |
0,0287 |
6,00E-04 |
0,0245 |
4,00 |
3,59E-04 |
2,31E-02 |
0,0289 |
8,00E-04 |
0,0283 |
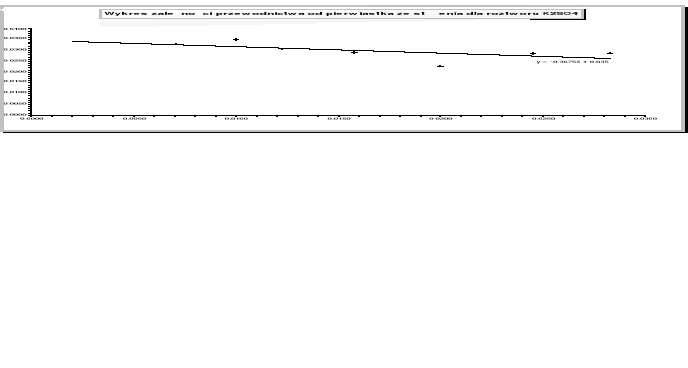
roztwór NaNO3
V [cm3] |
1/R [Ω-1] |
χ [Ω-1m-1] |
Λ [m2·Ω-1] |
c [mol/dm3] |
|
0,25 |
1,52E-05 |
9,74E-04 |
0,0195 |
5,00E-05 |
0,0071 |
0,50 |
3,42E-05 |
2,20E-03 |
0,0220 |
1,00E-04 |
0,0100 |
0,75 |
4,72E-05 |
3,03E-03 |
0,0202 |
1,50E-04 |
0,0122 |
1,25 |
7,42E-05 |
4,77E-03 |
0,0191 |
2,50E-04 |
0,0158 |
2,00 |
1,18E-04 |
7,60E-03 |
0,0190 |
4,00E-04 |
0,0200 |
3,00 |
1,84E-04 |
1,18E-02 |
0,0197 |
6,00E-04 |
0,0245 |
4,00 |
2,42E-04 |
1,56E-02 |
0,0195 |
8,00E-04 |
0,0283 |
- wyznaczanie przewodnictwa granicznego na podstawie linii regresji
elektrolit |
Λ0 |
współczynnik kierunkowy równania D-H-O |
KCl |
0,0272 |
-0,6683 |
NaCl |
0,0350 |
-0,3075 |
NaNO3 |
0,0208 |
-0,0542 |
- wyznaczanie stopnia dysocjacji poszczególnych elektrolitów
![]()
|
stopień dysocjacji |
||
c [mol/dm3] |
NaCl |
K2SO4 |
NaNO3 |
5,0·10-5 |
1,1656 |
0,9426 |
0,9368 |
1,0·10-4 |
0,6064 |
1,0041 |
1,0558 |
1,5·10-4 |
0,5257 |
0,8777 |
0,9718 |
2,5·10-4 |
0,5168 |
0,8316 |
0,9170 |
4,0·10-4 |
0,4395 |
0,6530 |
0,9132 |
6,0·10-4 |
0,4124 |
0,8212 |
0,9489 |
8,0·10-4 |
0,4378 |
0,8249 |
0,9358 |
- sprawdzenie prawa Kolhrausha
၌0 = ၬ0+ + ၬ0-
elektrolit |
wyznaczone ၌0 |
λ0+ |
λ0- |
obliczone ၌0 |
NaCl |
0,0272 |
0,0074 |
0,0076 |
0,0150 |
K2SO4 |
0,0350 |
0,0050 |
0,0076 |
0,0126 |
NaNO3 |
0,0208 |
0,0050 |
0,0072 |
0,0122 |
3. Wnioski i błędy
Obliczam błąd standardowy na podstawie regresji dla poszczególnych elektrolitów:
KCl |
0,0272 ± 0,0054 |
NaCl |
0,0350 ± 0,0033 |
NaNO3 |
0,0208 ± 0,0010 |
Wykres zależności przewodnictwa równoważnikowego od pierwiastka kwadratowego ze stężenia jest linią prostą, co potwierdza założenie Kohlrausha, że przewodnictwo mocnego elektrolitu zależy linowo od stężenia.
Otrzymane wartości granicznego przewodnictwa równoważnikowego różnią się od danych tablicowych. Może to być spowodowane tym, że pomiary były prowadzone w temperaturze 22°C, natomiast dane tablicowe były odczytane dla temperatury 25°C. Ten duży błąd potwierdza to, że zależność granicznego przewodnictwa równoważnikowego od temperatury jest duża. Na powstałe błędy wpływ mogło także mieć niedokładne odmierzanie objętości roztworów soli, co pociągało za sobą różne stężenia elektrolitów.
Obliczony stopień dysocjacji elektrolitów jest wysoki. Jest to potwierdzeniem tego, że rozcieńczone roztwory mocnych elektrolitów są dobrze zdysocjowane.
2
Wyszukiwarka
Podobne podstrony:
PRZEWODNICTWO RÓWNOWAŻNIKWE ELEKTROLITÓW, studia, chemia, chemia fizyczna, sprawozdania
Przewodnrównow 2, studia, chemia, chemia fizyczna, sprawozdania
Przewodnrównow, studia, chemia, chemia fizyczna, sprawozdania
Sprawozdanie 12 do druku, Studia, Chemia fizyczna, Laborki, 12 - Równowaga fazowa ciecz-para
Iloczyn rozpuszczalności soli trodno rozpuszczalnych, studia, chemia, chemia fizyczna, sprawozdania,
HCOOH, studia, chemia, chemia fizyczna, sprawozdania, sprawka
Diagram fazowy Gibbsa, studia, chemia, chemia fizyczna, sprawozdania, sprawka
Entropia mieszania, studia, chemia, chemia fizyczna, sprawozdania, sprawka
Badanie lepkości cieczy metodą Hopplera, studia, chemia, chemia fizyczna, sprawozdania, sprawka
izoterma adsorbcji, studia, chemia, chemia fizyczna, sprawozdania, sprawka
Stała szybkości reakcji jodowania acetonu, studia, chemia, chemia fizyczna, sprawozdania, sprawka
Energia aktywacji przepływu lepkiego, studia, chemia, chemia fizyczna, sprawozdania, sprawka
Krytycznemicele, studia, chemia, chemia fizyczna, sprawozdania
Ciepło rozpuszczania soli jonowej, studia, chemia, chemia fizyczna, sprawozdania, sprawka
Kinetyka reakcji elektroutlenienia 1-propanolu, studia, chemia, chemia fizyczna, sprawozdania, spraw
Elektronowe widma absorpcyjne, studia, chemia, chemia fizyczna, sprawozdania, sprawka
więcej podobnych podstron