Patryk Pakmur 9 października 2003 r.
Ćwiczenie nr 25
Temat: Wyznaczanie równoważnika elektrochemicznego miedzi.
Podstawy teoretyczne
Elektrolity - roztwory wodne kwasów, zasad, soli, które przewodzą prąd elektryczny.
Elektroliza - zjawisko przepływu prądu przez te roztwory , oraz zachodzące przy tym zmiany (procesy chemiczne).
Pierwsze prawo Faradaya
Masy produktów elektrolizy, wydzielone na elektrodach są proporcjonalne do natężenia prądu i czasu jego przepływu, czyli można powiedzieć, że jest proporcjonalne do ładunku przepływającego przez elektrolit:
![]()
![]()
gdzie k - to współczynnik proporcjonalności nazywany równoważnikiem elektrochemicznym, wyrażającym liczbowo masę produktu elektrolizy, wydzieloną na elektrodzie podczas przepływu prądu przez elektrolit ładunku 1C. Równoważnik ten, możemy także interpretować na gruncie rozważań molekularnych. Weźmy, że masa pojedynczego jonu to ![]()
, N to liczba wydzielonych jonów, a e to ładunek. Wówczas otrzymujemy zależność:
![]()
- masa wydzielonej substancji
![]()
- przeniesiony ładunek
Teraz I prawo elektrolizy Faradaya możemy przedstawić w postaci:
![]()
Drugie prawo Faradaya
Masy produktów elektrolizy wydzielona na elektrodach różnych woltometrów podczas przepływu prądu, o tym samym natężeniu i w tym samym czasie są proporcjonalne do gramorównoważników danych substancji
![]()
(1)
Gramorównoważnikiem danej substancji nazywamy stosunek masy gramoatomu pierwiastka lub gramocząsteczki (mola) M związku chemicznego do wartościowości
![]()
(2)
Obydwa prawa Faradaya można sformułować w jednym. Masy wydzielone na różnych woltometrach w jednakowych odstępach czasu t, przez jednakowe prądy I, można wyrazić w następujący sposób:
m1=k1It; m2=k2It
Kiedy podzielimy powyższe równania stronami, otrzymamy:
![]()
Po porównaniu powyższego z (1) mamy:
![]()
więc stosunek gramorównoważników równa się stosunkowi równoważników elektrochemicznych substancji. Z tego wnioskujemy, że
![]()
.
Tę stałą wartość stosunku gramorównoważnika do równoważnika elektrochemicznego danej substancji nazywany stałą Faradaya F:
![]()
skorzystawszy z (2) możemy zapisać
![]()
Ostateczna postać prawa Faradaya:
![]()
1.3 Zjawisko elektrolizy
Przepływ prądu elektrycznego przez dany elektrolit jest związany z ruchem jonów. Jony powstają w taki sposób, że obojętne atomy lub grupy atomowe tracą lub przyłączają do siebie jeden lub więcej elektronów. Liczba tych utraconych lub przyłączonych elektronów decyduje o wartościowości jonu.
Proces wytwarzania się jonów w elektrolicie
Załóżmy, że czynnikiem wiążącym w cząsteczkach związku chemicznym jest przyciąganie elektryczne jonów różnoimiennych (wchodzących w ich skład), widzimy wówczas, że gdy wprowadzimy taką cząstkę do rozpuszczalnika o dużej przenikalności elektrycznej, zmniejszą się siły wzajemnego oddziaływania między jonami. Może temu także towarzyszyć rozpad cząstki na jony, czyli dysocjacja elektrolityczna:
CuSO4→Cu2++SO42-
Stopniem dysocjacji nazywamy stosunek liczby cząsteczek zdysocjowanych do ogólnej liczby cząstek wprowadzonych do rozpuszczalnika. Powstające w wyniku dysocjacji jony są w ciągłym, chaotycznym ruchu. Dzięki temu możliwe jest spotkanie jonów różnoimiennych i ponowne powstanie obojętnej cząsteczki. Jest to tzw. proces rekombinacji. W tym samym czasie inna cząstka może ulec rozpadowi. W roztworze stale odbywają się obydwa procesy, a stosunek cząsteczek zdysocjowanych do niezdysocjowanych jest stała.
Wprowadzenie do roztworu kwasu, zasady lub soli płytek metalowych podłączonych do źródła napięcia wywołuje uporządkowany ruch jonów. Jony dodatnie (kationy) dążą do elektrody ujemnej, a jony ujemne (aniony) do elektrody dodatniej. Po osiągnięciu elektrody ładunki jonu ulegają zobojętnieniu, do jon dodatni dołącza elektrony z katody, a jon ujemny oddaje nadmiarowe elektrony anodzie.
1.4 Schemat układu pomiarowego
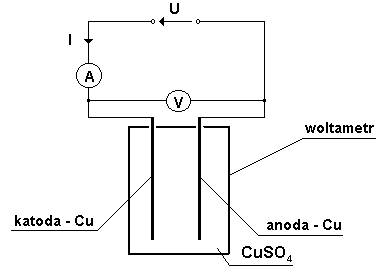
Reakcje zachodzące na elektrodach w czasie przepływu prądu: |
|
Na katodzie (redukcja, czyli pobieranie elektronu)
Cu2++2e→Cu0 H++e→Hads Hads+ Hads→H2↑ |
Na anodzie (utlenianie, czyli oddawanie elektronu)
Cu0→Cu2++2e Cu2++SO42-→CuSO4 OH-+ OH-→Oads+H2O+2e Oads+ Oads→O2↑ |
Wyszukiwarka
Podobne podstrony:
Cw 25 - Wyznaczenie rownowaznika elektrochemicznego miedzi, AKADEMIA TECHNICZNO-ROLNICZA W BYDGOSZCZ
wyznaczanie rownowaznika elektrochemicznego miedzi
sprawozdanie? Wyznaczanie równoważnika elektrochemicznego miedzi i stałej?radaya
Elek- Wyznaczanie równoważnika elektrochemicz miedzi i sta(2, Sprawozdania - Fizyka
Wyznaczanie równoważnika elektrochemicznego miedzi i stałej?radaya na podstawie elektrolizy CuSO4x
24.WYZNACZANIE RÓWNOWAŻNIKA ELEKTROCHEMICZNEGO MIEDZI ORAZ STAŁEJ FARADAYA., Fizyka
wyznaczanie równoważnika elektrochemicznego miedzi oraz st
Wyznaczanie równoważnika elektrochemicznego miedzi i stałej?radaya na podstawie elektrolizy CuSO4
23 Wyznaczanie równoważnika elektrochemicznego miedzi oraz stałej Faradaya
24 WYZNACZANIE RÓWNOWAŻNIKA ELEKTROCHEMICZNEGO MIEDZI ORAZ STAŁEJ FARADAYA doc
wyznaczanie rownowaznika elektrochemicznego wodoru i miedzi, Inżynieria Środowiska PK, Semestr 1, Fi
Wyznaczanie równoważnika elektro-chemicznego miedzi i stałej Faraday'a, LABORATORIUM Z PRZETWORNI
WYZNACZANIE CIEP A MOLOWEGO, laboratorium fizyczne, Laboratorium semestr 2 RÓŻNE
WYZNACZANIE RÓWNOWAŻNIKA ELEKTROCHEMICZ, LABORATORIUM Z PRZETWORNIK˙W
więcej podobnych podstron