1. Wstęp teoretyczny
Zgodnie z zasadą zachowania energii przy zetknięciu się dwóch lub więcej ciał o różnych temperaturach następuje przepływ ciepła od ciała cieplejszego do ciała zimniejszego. Ciało oddające ciepło obniża swoją temperaturę, a ciało pobierające ciepło - podwyższa. Ciepło jest więc formą energii przekazywanej od jednego ciała do drugiego. Temperatura określa stan cieplny ciała.
Ilość ciepła Q pobranego przy ogrzaniu ciała od temperatury T1 do temperatury T2 (lub oddanego przy jego stygnięciu od T2 doT1 ) zależy od rodzaju ciała i jest proporcjonalna do jego masy m i uzyskanej zmiany temperatury:
Q=c·m·ΔT
Współczynnik proporcjonalności c nazywamy średnim ciepłem właściwym w zakresie temperatur od T1 do T2. Przekształcając w/w zależność otrzymujemy wzór na ciepło właściwe:
c=Q/(m·ΔT)
Ciepło właściwe jest to ilość ciepła potrzebna do ogrzania jednostki masy ciała o jednostkę temperatury. Jednostka ciepła właściwego jest J/kg·K
Przy pomiarach ciepła właściwego posługujemy się kalorymetrem tak skonstruowanym, aby ciała znajdujące się w jego wnętrzu były odizolowane termicznie od otoczenia. W celu pomiaru ciepła właściwego c ciała, ogrzewamy je do temperatury t1 i umieszczamy w kalorymetrze z wodą o temperaturze początkowej t0. Bliski kontakt ciała z wodą powoduje szybką wymianę ciepła(energii), dzięki czemu ustala się wspólna temperatura t wody, kalorymetru i badanego ciała.
2. Wykonanie i oznaczenie pomiarów mas
badany śrut ołowiany :
mc = 255,20g = 0,25520kg Δmc = 0,01g = 10-5kg
kalorymetr z pokrywką i mieszadełkiem :
mk = 91,96g = 0,09196kg Δmk = 0,01g = 10-5kg
woda
mw = 138,23g = 0,12323kg Δmw = 0,02g = 10-5kg
Zestawienie pomiarów temperatury wody w kalorymetrze
Pomiar prowadzony był bezpośrednio przed włożeniem ciała do układu.
Błąd wynosi ΔTw = 0,1K
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
295,6 K |
295,7 K |
295,7 K |
295,8 K |
295,8 K |
295,9 K |
296,3 K |
296,6 K |
Pomiar temperatury badanego ciała stałego
Tc = 346,4K
Błąd wynosi ΔTc = 0,1K
Zestawienie pomiarów temperatury wody w kalorymetrze po wrzuceniu ciała stałego
Błąd wynosi ΔT = 0,1K
Pomiar prowadzony w odstępach 10 sekundowych
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
299,5 K |
300,0 K |
300,5 K |
300,8 K |
300,7 K |
300,6 K |
300,6 K |
300,5 K |
300,5 K |
Po ustaleniu się temperatury, pomiar prowadzono co 1 min. przez 5 minut
10 |
11 |
12 |
13 |
14 |
298,8 K |
298,9 K |
298,9 K |
298,9 K |
298,9 K |
Zestawienie tabelaryczne otrzymanych wyników
Masa |
Badane ciało |
mc [kg] |
0,25520 |
Δmc |
10-5kg |
|
Kalorymetr |
mk [kg] |
0,09196 |
Δmk |
10-5kg |
|
Woda |
mw [kg] |
0,13823 |
Δmw |
2 x 10-5kg |
Temperatura |
Początkowa ciała |
Tc [K] |
346,4 |
ΔTc |
0,1 K |
|
Początkowa kalorymetru |
Tw [K] |
296,6 |
ΔTw |
0,1 K |
|
Końcowa (z wykresu) |
Tk [K] |
298,9 |
ΔTk |
0,1 K |
Ciepło właściwe |
Wody |
Cw [ |
4185 |
ΔCw |
8,0 [ |
|
Kalorymetru |
Ck [ |
902,5 |
ΔCk |
0,1 [ |
|
Ciała stałego (wyliczenie) |
Cx [ |
125,509 |
ΔCx |
6,6 [ |
Wykres temperatury jako funkcji czasu
Wyliczenie ciepła właściwego badanego ciała stałego (ołowiu)
Ciepło właściwe obliczamy ze wzoru :
Cx=![]()
[J/kgK]
Cw= 4185 [J/kgK]
mw= 0,13823 [kg]
Ck= 902,5[J/kgK]
Tk = 298,9 [K]
Tw = 296,6 [K]
mc= 0,25520 [kg]
Tc = 346,4 [K]
Cx=![]()
[J/kgK]
Cx= ![]()
[J/kgK]
Cx= 125,509 [J/kgK]
Wyliczenie błędów
Błąd Cx obliczamy na podstawie wzoru metodą różniczki zupełnej :
Δcx=| δcx/δcw|·Δcw+|δcx/δmw|·Δmw+|δcx/δck|·Δck+|δcx/δk|Δmk+|δcx/δmc|·Δmc+
+|δcx/δTc|·ΔTc+|δcx/δTw|+|δcx/δTk|·ΔTk
y = Tk-Tw/mc·(Tc-Tk) y = 0,2
obliczamy pochodne cząstkowe ze wzorów :
δcx/δcw=mw·y; δcx/δmw=cw·y; δcx/δck=mk·y; δcx/δmc=cx/mc;
δcx/δTc= -cx/Tc-Tk;
δcx/δTw= -cx/Tk-Tw; δcx/δmk=ck·y; δcx/δTk= -(δcx/δTk+δcx/δTk)
podstawiamy do wzorów i obliczamy poszczególne składniki sumy :
Δcx= mw·y·Δcw+cw·y·Δmw+mk·y·Δck+ck·y·Δmk+(-cx/mc)Δmc+(-cx/Tc-Tk)·ΔTc+
+(-cx/Tk-Tw)·ΔTw+[-(cx/Tc-Tk)+(-cx/Tk-Tw)] ΔTk
Δcx= ![]()
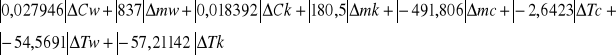
Δcx= 6,6 [J/kgK]
Wnioski
Wartość ciepła właściwego dla ołowiu jaką otrzymaliśmy wyniosła 128,8 J/kg K i jest to wartość bardzo zbliżona do wielkości tablicowej , która wynosi 128 J/kg K.
Wartość błędu bezwzględnego obliczona za pomocą całki zupełnej wyniosła 6,6 J/kg K. Wartość tego błędu jest stosunkowo duża, co z pewnością było spowodowane nieprzestrzeganiem zasad reżimu wykonywania doświadczenia.
Na tak duży błąd mogło wpłynąć niezbyt sprawne przekładanie ołowiu z ultratermostatu do kalorymetru z wodą, a także wlanie małej ilości wody do kalorymetru co mogło mieć wpływ na nieprawidłowe warunki wymiany ciepła i pomiary temperatur. Należy zauważyć że dla poprawnego oszacowania wyniku, należałoby doświadczenie przeprowadzić kilkakrotnie.
Wyszukiwarka
Podobne podstrony:
ściąga z fizyki II, SGSP, Semestr 1, Fizyka, Fizyka lab
C2-1, SGSP, Semestr 1, Fizyka, Fizyka lab
TYTUŁOWA NA LABORKI, SGSP, Semestr 1, Fizyka, Fizyka lab
C4, SGSP, Semestr 1, Fizyka, Fizyka lab
labO3, SGSP, Semestr 1, Fizyka, Fizyka lab
Fizyka lab O4, SGSP, Semestr 1, Fizyka, Fizyka lab
labO3.x, SGSP, Semestr 1, Fizyka, Fizyka lab
lab J4, SGSP, Semestr 1, Fizyka, Fizyka lab
O1(2), SGSP, Semestr 1, Fizyka, Fizyka lab
C1-1, SGSP - Szkoła Główna Służby Pożarniczej, semestr 2, fizyka, lab
J2-5, SGSP, Semestr 1, Fizyka, Fizyka lab
c3, SGSP, Semestr 1, Fizyka, Fizyka lab
Sprawozdanie 3 (Współczynnik Załamania Światła), Energetyka AGH, semestr 3, III Semestr, Fizyka, La
54+, Politechnika Rzeszowska, Elektrotechnika, semestr 2, Fizyka Lab, Sprawozdania, Fizyka Laborator
sciaga egzamin fizykaII, SGSP, Semestr 1, Fizyka, Na egzamin
1B+, Politechnika Rzeszowska, Elektrotechnika, semestr 2, Fizyka Lab, Sprawozdania, Fizyka Laborator
44 sprawozdanie czyjeś, Politechnika Rzeszowska, Elektrotechnika, semestr 2, Fizyka Lab, Sprawozdani
więcej podobnych podstron