ŚWINIE
17. Etiopatogeneza, drogi szerzenia się, występowanie i znaczenie enzootycznego zapalenia płuc świń.
Przewlekła bronchopneumonia
Jedna z głównych przyczyn strat produkcyjnych (upadki, słabe przyrosty, wzrost zużycia karmy o 25%, leki, ograniczenia obrotu)
Do 80% stad na świecie
W Polsce: 20% ogólnej chorobowości, chyba druga przyczyna wszelkich strat po biegunkach
W USA ~ 100 mln dolarów start rocznie
Etiologia i etiopatogeneza
Typowo środowiskowe infekcje mieszane
Ale głównie i pierwotne role Mycoplasma hyopneumoniae - bardzo rozpowszechniony
Tylko kropelkowo się szerzy (zarazek wrażliwy)!!!
Wrażliwe tylko świnie w każdym wieku, głównie młode (od loch i starszych prosiąt kontaktowanie się różnych grup wiekowych)
Między stadami szerzą tylko przerzuty świń
W dobrych - warunkach zakażenie subkliniczne (tylko na rzeźni widać)
W złych - choroba (okres inkubacji 10-16 dni) przy współudziale P. multocida, Bordetella bronchiseptica, Haemophilus sp., paciorkowców, adenowirusa, larwy Acaris itp.
Mała dawka Mycoplasma hyopneumoniae - tylko zmiany mikroskopowe w płucach i odporność
Duża dawka zarazka - typowa choroba
Czynniki środowiskowe sprzyjające chorobie
1) Hodowlane
Transport i bazy kontumacyjne (skupowanie warchlaków do tuczu)
Nieprzestrzeganie zasady „puste-pełne”
Różne grupy wiekowe razem
Nadmierne zagęszczenie
Brak możliwości izolacji chorych zwierząt
2) Zoohigieniczne
Zła temperatura i wilgotność (↓ temp., ↑ wilgotność)
Przeciągi
Gazy szkodliwe (wentylacja, odpływ gnojówki)
Klimat (sezonowość)
Typ tuczarni (gdzie kanał ściekowy, czy ściany lite na 1 m wysokie, czy wybiegi, czy ruszt, żywienie czy suche czy mokre, czy odpadowe)
3) Inne choroby
Patogeneza
M. hyopneumoniae kolonizuje i poraża rzęski nabłonków oskrzeli i oskrzelików
Wokół nich oraz naczyń naciek zapalny
Obraz ropnej bronchopneumonii (kaszel)
Głównie płaty szczytowe (zwątrobiałe)
Osłabiają komórki odpornościowe - działają immunosupresyjnie
W dobrych warunkach zdrowieją powoli (nawet kilka m-cy - kaszel mija, też zmiany makro)
I nabywają odporności (są Ab anty-M. hyopneumoniae, mają też znaczenie diagnostyczne)
W złych warunkach dołączają się inne zarazki i zdrowienie opóźnione lub charłaczenie
Przebieg
Mało typowy
Głównie prosięta od 4 tyg. i tuczniki(3-6 mies.)
Kichanie, wypływ surowiczy z nosa
Potem suchy kaszel, zwłaszcza rano lub po wysiłku, chroniczny (tygodnie, miesiące)
Raczej bez duszności i gorączki
Nawet apetyt długo zachowany
Charłaczenie
Czasem wyprysk skórny lub biegunka
Wybrakowanie lub zdrowienie
18. Rozpoznawanie, diagnostyka różnicowa i zwalczanie enzootycznego zapalenia płuc świń.
Rozpoznawanie
Izolacja M. hyopneumoniae bardzo trudna.
Można wykazać zarazek w drogach oddechowych (IF) lub Ab (ELISA), ale jego powszechność osłabia wymowę wyniku.
W praktyce rozpoznajemy klinicznie (przewlekły suchy kaszel prosiąt i warchlaków w złych warunkach, zmniejszone przyrosty, powtarzalność choroby w stadzie)
Sekcja pomocna - zmiany w wielu narządach.
Diagnostyka różnicowa
Grypa, choroba Aujeszkiego, pomór, pasterelozy, robaczyce
Zwalczanie
Leczenie: tylozyna, tiamulina, linkomycyna - one ograniczają objawy chorobowe; w ostrej postaci: oksytetracyklina + tiamulina; penicyliny nieskuteczne.
Szczepionki: nieskuteczne, gdy nie ma poprawy warunków środowiska, szczepimy tylko, gdy to wpływa na poprawę hodowli.
19. Choroba obrzękowa świń.
Etiologia
Wywoływana przez enterotoksemiczne szczepy E.coli (STEC)
STEC przytwierdzają się fimbriami (F18ab) do nabłonka przewodu pokarmowego. (Świnie bez receptorów w jelicie cienkim - oporne)
STEC wytwarzają shigatoksynę (gł. Stx2e), dawniej toksyna Wero
F18ab oraz Stx2e są immunogenne i przeciwciała miejscowe lub krążące chronią.
Patogeneza
Stx2e niszczy enterocyty, może być krwista biegunka
Stx2e wchłania się do krwi, uszkadza śródbłonek, mięśniówkę tętniczek
Więc obrzęki, a w OUN - zawały, niedokrwienia, rozmiękanie.
Zachorowaniom sprzyjają: przekarmianie (zmiana pH na zasadowe, zahamowanie perystaltyki), wysokobiałkowa dieta, stres odsadu.
Rozpoznawanie
U prosiąt (zwykle 7-10 dni po odsadzeniu) objawy jelitowe słabe, ale obrzęki, zaburzenia nerwowe (zaburzenia koordynacji, chwiejny chód, niezborność, dreszcze, ruchy wiosłowe), obrzęk powiek, obrzęk krtani = choroba obrzękowa.
U cieląt głównie bezobjawowo, rzadko biegunka (2-8 tygodni)
Zmiany A-P: zaczerwienienie brzucha; obrzęk tkanki podskórnej, ściany żołądka i okrężnicy.
Różnicować ze streptokokozą.
Leczenie
Zapobiegawczo głodówka przed odsadzeniem (dawniej stosowano zakwaszacze)
Antybiotyki (enrofloksacyna, streptomycyna), leki moczopędne, sterydy.
Po kastracji podawać długodziałające antybiotyki.
Zwierzęta poić, nawadniać.
20. Etiopatogeneza, drogi szerzenia się, występowanie i znaczenie ZZZN.
Zakaźne zanikowe zapalenie nosa (Rhinitis atrophicans)
Etiologia
Wiele dziesięcioleci niejasna
Teorie: żywieniowa, środowiskowa, genetyczna, zakaźna
Od dawna wiadomo, że to choroba zakaźna
Jakie zarazki?
Podejrzewano mykoplazmy, wirusy, rozmaite bakterie
Aż wykazano, że z ZZZN związane są:
Bordetella bronchiseptica
Pasteurella multocida
Ale nadal nie było jasności, co do etiologii
Przełom w tych sporach nastąpił po odkryciu, że niektóre P. multocida wytwarzają toksynę (tzw. dermonekrotyczną), która wywołuje zmiany kostne jak w ZZZN
Zwolennicy bordetelozy argumentowali, że B. bronchiseptica powoduje podobne zmiany
Dwie formy ZZZN (dwie choroby etiologicznie różne!!)
Sporadyczna (nie postępująca w stadzie) wywoływana przez B. bronchiseptica, nietoksynotwórcze szczepy P. multocida bądź inne bakterie - zmiany kostne przemijające
Enzootyczna (postępująca) wywoływana przez toksynotwórcze szczepy P. multocida - zmiany kostne nieodwracalne
Patogeneza postępującej postaci ZZZN
Raczej upośledzony rozwój kości niż zanik
W pierwszych tygodniach życia
Lochy lub starsze prosięta źródłem zakażenia toksynotwórczymi pasterelami
P. multocida ma małą inwazyjność, ale razem z bordetelami łatwiej kolonizuje jamę nosową!!!
Wywarzane tam toksyny
Toksemia!!!!
Jej wpływ na kości widać najwyraźniej w miejscach ich najszybszego wzrostu
Wady zgryzu i słabszy węch = słabsze przyrosty
Wtórne zapalenia płuc - charłactwo
Patologia ZZZN świń
Zmiany zapalne i wsteczne w błonie śluzowej jamy nosowej
Ciężkie zaburzenia rozwoju kości trzewioczaszki
Zanik małżowin nosowych brzusznych
Skrzywienie przegrody nosowej
Skrócenie i zdeformowanie kości okolicy nosowej
Początkowe objawy u prosiąt:
- Pierwsze objawy choroby między 4 a 12 tygodniem życia.
Kichanie
Świąd (bolesność?) okolicy nosa
Wypływ śluzowo-ropny z nosa
Czasem krwawienie z nosa
Później (2-5 m-cy) powoli postępujące deformacje okolicy nosowej:
Skrócenie (przodozgryz, pofałdowanie skóry) - „mopsowaty” wyraz twarzy
Lub/i skrzywienie
Zatkanie przewodów nosowo-łzowych (widocznym objawem jest zaczernienie pod oczami)
A także zapalenie płuc
Występowanie
Cały świat od dawna
Też Polska (przynajmniej od 1954 roku)
Głównie prosięta i warchlaki
Enzootycznie w stadach
Często skryty przebieg, bo diagnostyka niełatwa
W złych warunkach większe straty
Znaczenie ZZZN - straty spowodowane przez:
↓ Przyrostów
↑ Spożycia paszy
Przedłużenie tuczu
Ograniczenia rozprowadzania świń do celów hodowli
Leki
Upadki?
21. Rozpoznawanie i zwalczanie ZZZN.
Rozpoznawanie
Dawniej metody morfometryczne
Dziś wykazanie toksynotwórczych pastereli w jamie nosowej (test ELISA)
Serologia (obecność przeciwciał antytoksycznych) - zawodzi.
Sekcja - cięcie między 1 a 2 przedtrzonowcem.
Immunoprofilaktyka
Dawniej szczepionki: zabite B. bronchiseptica i P. multocida - zmienne efekty
Nowoczesne szczepionki: zawierają toksoid z toksyną dermonekrotyczną P. multocida - dużo lepsze efekty. Szczepienie loch w ciąży ( pierwszy raz w 6 i 2 tyg. przed porodem, potem 2 tyg. przed każdym porodem)
Leczenie
tetracykliny (oksytetracyklina)
na Bordetellę - sulfonamidy potencjalizowane
22. Afrykański pomór świń.
Bardzo zaraźliwa choroba świń domowych,o przebiegu od nadostrego do przewlekłego i subklinicznego
Wykryty w 1921 roku w Afryce
Występował w Portugalii, Hiszpanii, Francji, we Włoszech, także na Kubie, w Brazylii, ąmeryce Środkowej i Południowej
W 1986 roku w Holandii.
Obecnie endemicznie tylko Afryka i Sardynia.
W Polsce zwalczany z urzędu, ale nie występował.
Etiologia
Rodzina Asfaviridae (DNA), jedyny rodzaj - Asfavirus
Chorobotwórczy dla świń domowych i dzików europejskich, a bezobjawowo zakaża dzikie świnie afrykańskie
Inne gatunki niewrażliwe, z wyjątkiem kleszczy Ornithodovos
Jeden serotyp, ale powstają warianty antygenowe (szczepy o dużej zjadliwości)
Niezwykle oporny - w temperaturze pokojowej we krwi aktywny 15 h, w kale kilkanaście dni, w temp. 56°C - 30 minut, w mrożonym mięsie miesiącami lub latami; w pH 4-13 godzinami, odporny także na wysychanie.
Wrażliwy na rozpuszczalniki organiczne, 2% NaOH (niszczy go po 24 godz.), Virkon
Epidemiologia
Dwa rezerwuary - dzikie świnie afrykańskie i kleszcze
Dwa sposoby krążenia wirusa:
U dzikich świń afrykańskich - bezobjawowe zakażenia z kleszczami jako biologiczny wektor (do 25% zakażeń), które przekazują wirusa transowarialnie i transstadialnie; wydalają wirusa m. in. ze śliną latami zakażając inne świnie, u młodych przejściowa wiremia, dorosłe zakażone bez wiremii.
U świń domowych - pomiędzy osobnikami aerogennie, pośrednio na butach, pojazdach, zlewki z samolotów i statków. Potwierdzono możliwość zakażenia kleszczy z państw pozaafrykańskich.
Patogeneza i odporność
Wnika aerogennie lub alimentarnie, namnaża się w migdałkach
Wiremia i uszkodzenie śródbłonka oraz układu limfatycznego
Wybroczyny i wylewy (błony surowicze, węzły chłonne, pęcherz moczowy, pęcherzyk żółciowy, miedniczki nerkowe)
Płyn w jamach ciała, ciężka leukopenia
Wtórne zapalenie płuc i błon surowiczych
Po przechorowaniu długotrwałe nosicielstwo
Powstają przeciwciała przeciwwirusowe, jednak nie neutralizują wirusa
Potężna odpowiedź komórkowa
Rozpoznawanie
Kliniczne podobieństwo do pomoru i innych chorób
Próba biologiczna na prosiętach odpornych na pomór klasyczny
Można izolować wirusa lub wykrywać testem IF lub ELISA, albo wykryć przeciwciała (ELISA)
Zwalczanie
Choroba nieuleczalna i brak szczepionek
Zwalczanie tylko radykalnymi metodami administracyjnymi
W Afryce są rezerwuary, więc bardzo intensywne opryski, izolacja od dzikich świń.
23. Zespół PRRS.
Zespół rozrodczo-oddechowy świń.(Porcine reproductive and respiratory syndrome - PRRS)
Dawniej nazywana chorobą niebieskiego ucha.
Etiologia i występowanie
Rodzaj Arterivirus z rodziny Arteriviridae (RNA)
Podobny do wirusa zapalenia tętnic koni.
Długotrwałe zakażenie bezobjawowe, a czasem ciężkie choroby (szczepy o różnej zjadliwości)
Pojawił się w 1987 roku w USA, 1988 w Azji i w 1990 w Europie
Błyskawicznie się rozprzestrzenił (Kanada, Niemcy, Holandia, Anglia, Hiszpania itp., też od 1992 roku w Polsce)
Dziś ważne zagrożenie produkcji świń w wielu krajach
Dwa genotypy:
1 („europejski” - wirus Lelystad): Europa (i Kanada)
2 („amerykański” - wirus VR2332): Ameryka, ale i Europa i Azja, tam gdzie nim żywym atenuowanym szczepiono
Obecnie na Litwie dominuje „podgenotyp 1b”
Epidemiologia
Wirus bardzo zaraźliwy: przenoszony przez kontakt bezpośredni (aerogennie, krycie) i pośrednio alimentarnie z nasieniem, uszkodzenie skóry (pokąsania, jatrogennie), śródmacicznie
Źródłem zakażenia zwierzęta w ostrej fazie i zakażone subklinicznie.
Szczególnie zimą łatwo się szerzy
Bo w ↓ temperaturach długo trwa w środowisku
W stadzie świń, które po raz pierwszy z nim się zetknęły zarazek bardzo szybko szerzy się (po 2-3 m-cach 95% zakażonych)
Więc większość chlewni większości krajów endemicznie zakażone
Bo może się namnażać bardzo długo u klinicznie zdrowych świń (można go z gardła wyizolować jeszcze po ponad 5 m-cach)
W Polsce 60% chlewni średnio i wielkotowarowych sero(+),też większość zarodowych.
W Polsce dotychczas tylko genotyp europejski
Patogeneza
Namnaża się głównie w makrofagach (poraża ich „wybuchy tlenowe”) i uwalniany jest z nich albo po lizie albo egzocytozą
Od 12h wiremia i to długotrwała (mimo przeciwciał)
Nawet niewielkie miana (subneutralizujące) pogarszają przebieg
W macicy endometritis i miometritis
Z makrofagami trafia praktycznie do wszystkich narządów
Najwrażliwsze jednak makrofagi płucne prosiąt do 6 tygodnia
Ich aktywacja (IL-1 = gorączka i przyciąganie nacieku monocytów - ostre śródmiąższowe zapalenie)
W małym stopniu niszczone są komórki nabłonkowe, więc słabe zmiany sekcyjne w płucach
Też apoptoza makrofagów w układzie rozrodczym, limfatycznym
Wirus wnika do płodów - krwotoczne zmiany w pępowinie (martwicowe zapalenie tętnic pępowinowych z wynaczynieniami)
Jeśli się urodzą - immunosupresja (zwłaszcza Streptococcus suis)
Przebieg
Zależny od płci, wieku, stadium ciąży i zjadliwości szczepu
•Pierwsze zakażenie stada loch („ostra faza” - około 2 tygodni):
Osowiałość i brak apetytu u wielu zwierząt (5-75%)
Czasem gorączka i objawy oddechowe
Pojedyncze - krótkotrwałe przekrwienie lub zasinienie uszu, ryja, gruczołu mlekowego i sromu
Pojedyncze ronienia w zaawansowanej ciąży (do 110 dnia)
Pojedyncze padnięcia loch (obrzęk płuc lub niewydolność nerek)
Możliwe są objawy neurologiczne
Knury - niechęć do krycia, pogorszenia nasienia
•Po tygodniu faza wynikająca ze śródmacicznych zakażeń:
5-80%: przedwczesne porody, martwo urodzone, mumifikacje
Słabe noworodki (do 80% pada do 7 dni z objawami oddechowymi)
Też słabsze starsze prosięta (zapalenie spojówek, duszność, biegunka)
To trwa 1-4 miesięcy i stopniowo zanika, bo odporność stada
•Potem (o ile nie zwalcza się)
Stado endemicznie latami zakażone
Bo długotrwałe siewstwo i remont wrażliwymi loszkami
Objawy oddechowe głównie u prosiąt po odporności biernej
I zaburzenia rozrodu remontowych loszek
•Prosięta
Wysoka umieralność okołoporodowa
Rodzą się słabe, mało żywotne,
Niemal wszystkie przedwcześnie urodzone giną w kilka godzin po porodzie
Rozkroczność, niedowład zadu, ruchy wiosłowe - objawy ze strony oun.
•U tuczników
Spadek przyrostów o 50-75%, nierównomierne przyrosty
Większa zapadalność na inne choroby zakaźne
Co zwiększa śmiertelność o 12-20%
•Knury
Objawy grypopodobne.
Gorsza jakość nasienia: mniejsza objętość ejakulatu, mniejsza żywotność plemników, zmiany morfologiczne plemników.
Rozpoznawanie
Przebieg, objawy i sekcja - jedynie podejrzenie. Objawy kliniczne i zmiany A-P nie są patognomiczne. (Powiększenie węzłów śródpiersiowych i mostkowych)
Podstawową metodą diagnostyczną jest ELISA - wykrywanie IgG, 9-13 dni po zakażeniu, bardzo czuła, test trwa 3 h, jest podstawą zwalczania.
Izolacja wirusa, ale po śmierci wirus szybko ginie, więc izolować należy od jeszcze żywych
Serologia: odczyn SN („profil immunologiczny stada”)
RT-nested PCR - wykrywanie materiału genetycznego wirusa we krwi 12-24 h po zakażeniu.
Możliwości zwalczania
Uwalniane stad od zakażenia
Depopulacja - najskuteczniejsza, ale najdroższa (tuczarnie!)
Stopniowa depopulacja (etapami, przy tylko własnym remoncie „puste-pełne”!) - tańsza, ale bardziej ryzykowna
Profilaktyka:
Nadzór nad przerzutami świń
Szczepienia
Szczepienia
Są szczepionki z żywym atenuowanym wirusem, także w Polsce
Tylko do szczepień stad zakażonych!!!
Szczepienia nie zapobiegają zakażeniu
Ale ograniczają straty i siewstwo wirusa
Wirus z resztkową zjadliwością (a są wydalane)
Do szczepień prosiąt z reguły między 15 a 42 dniem życia
Ale nie za wcześnie, bo nieskuteczne i nie za późno, bo u zakażonych szczepionka może nasilić przebieg - więc raczej po zbadaniu ich „profilu immunologicznego”
Też szczepienie remontowych loszek i knurków na 8 tygodni przed wprowadzeniem ich do zakażonego stada
Nie szczepić loch powyżej 90 dnia ciąży, bo grozi embriopatiami
Skuteczność jest osłabiona przez genotypy i zmienność wirusa
Szczepionki: Porcilis PRRS (szczep europejski, prosięta, zabezpiecza przed postacią oddechową choroby), Ingelvac PRRS MLV (szczep amerykański, prosięta i lochy, zabezpiecza przed postacią oddechową i rozrodczą choroby)
Można podać rozciery z łożysk lub płodów - jak najszybciej, jak największej liczbie zwierząt by wytworzyła się odporność (?)
24. Pleuropneumonia świń.
Ostre, podostre lub przewlekłe, bardzo zaraźliwe, często śmiertelne włóknikowo-krwotoczne i martwicowe zapalenie płuc i włóknikowe zapalenie opłucnej
Głównie warchlaki i tuczniki
Wiele krajów od 1960 roku, też Polska
Duże straty zwłaszcza w dużych fermach
Etiologia
Actinobacillus (Haemophilus) pleuropneumoniae
G(-) kokopałeczki, β-hemoliza, do wzrostu in vitro potrzebny tzw. czynnik V (agar z krwią go nie zawiera, więc rutynowy posiew go nie wykryje)
Szczepy zjadliwe i niezjadliwe
Dość wrażliwy, po wyschnięciu ginie w ciągu kilku godzin
Wrażliwy też na środki dezynfekcyjne
13 serotypów otoczkowych. Przeciwciała ochronne skorelowane z typem otoczkowym!Więc trudności immunoprofilaktyki
Ale niektóre powodują odporność krzyżową (zakażenie naturalne)
Epizootiologia
Źródło - chore lub nosiciele-ozdrowieńcy
Zakażenie tylko drogą bezpośrednią (kropelkowa)
Zwłaszcza w przepełnionych, źle wentylowanych chlewniach
Knury też mogą zakażać
Więc do stada wnika z bezobjawowo zakażonymi lub przewlekle chorymi
A stres sprzyja szerzeniu
Wrażliwe w każdym wieku, ale straty największe u warchlaków i tuczników
Patogeneza i przebieg
Gwałtowne namnożenie w miąższu płuc
Endotoksyna, hemolizyny (Apx I, Apx II), cytotoksyna (Apx III),toksyny RTX (powodują powstawanie porów w makrofagach i innych kom.=
Po kilku godzinach zapalenie ścian naczyń pęcherzyków płucnych
Więc wysięk i niedożywienie pewnych pęcherzyków
Więc ogniska martwicy (u przewlekle chorych)
A z limfą zakażenie może objąć całe płuca (zwłaszcza płaty przeponowe - ostre zapalenie płuc z dużą śmiertelnością)
Stres (mikroklimat, przepełnienie), brak higieny pogarszają (nie warunkują!)
Więc często ostro: 41-42ºC, pienisty wypływ z nosa, silna duszność -postawa siedzącego psa, otwarty pysk, niewydolność krążenia zasinienie uszu, upadki (głównie 3-4 miesięczne)
Zachorowalność bardzo różna: 8-100%
Śmiertelność bardzo różna: 0.5-100% (Przeciętnie około 25%)
Rozpoznawanie
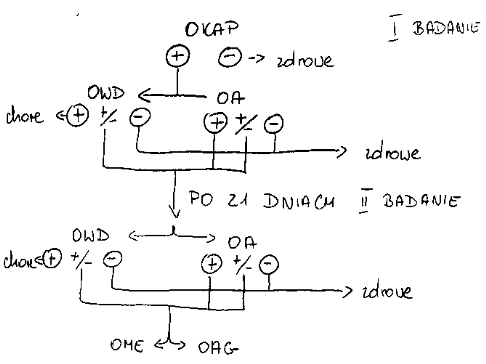
Izolacja zarazka z płuc (należy uprzedzić laboratorium o podejrzeniu pleuropneumonii - potrzebne jest specjalne podłoże)
Badanie serologiczne (OWD, aglutynacja, ELISA, odczyn neutralizacji toksyn) - dość drogie i problemem są wyniki fałszywie + (np. A. suis) czy ujemne
Więc wykrywanie nosicieli:
Posiew wymazów z migdałków
PCR z wymazem - bardzo czuły, ale drogi
Leczenie
trudne, bo przebieg błyskawiczny
beta-laktamy, tiamfenikol, sulfonamidy potencjalizowane, tetracykliny, fluorochinolony - wszystko w wysokich dawkach parenteralnie
Zapobieganie
kontrola i kwarantanna nowych zwierząt, warunki zoohigieniczne
Odporność
U zakażonych - przeciwciała (np. OWD do 10 dnia)
Pozostają miesiącami
Dobrze chronią przed ponownym zachorowaniem
W dużym stopniu też przed innymi serotypami (po szczepieniu - słabiej!)
Siarowe do 5-9 tygodnia życia są wykrywalne, ale już od 3-8 tygodnia za mało, by wyeliminować zarazek z dróg oddechowych
Szczepienia
Szczepionki z inaktywowanym zarazkiem (kilka serotypów)
Np. PLEUROVAC, Biovet serotypy 2, 4, 6, 9
Skuteczność średnia (zależy od serotypu)
Szczepionki podjednostkowe (PORCILIS App) - najistotniejsze Ag błony zewnętrznej + hemolizyny, więc ma być bardziej „uniwersalna”
Autoszczepionki skuteczniejsze, (ale drogie)
W przyszłości donosowe skuteczniejsze?
Trwają prace nad szczepionką z zarazkiem atenuowanym żywym
25. Rozpoznawanie i zwalczanie zakaźnych chorób skóry świń.
CHOROBA PĘCHERZYKOWA ŚWIŃ
PRYSZCZYCA
WYPRYSK PĘCHERZYKOWY ŚWIŃ
PĘCHERZYKOWE ZAPALENIE JAMY USTNEJ
OSPA ŚWIŃ
GRONKOWCOWE WYSIĘKOWE ZAPALENIE SKÓRY
WSZAWICA ŚWIŃ
SARKOPTOZA (ŚWIERZB)
26. Rozpoznawanie i zwalczanie chorób układu ruchu u świń.
WŚCIEKLIZNA
POMÓR ŚWIŃ
CHOROBA PĘCHERZYKOWA ŚWIŃ
PRYSZCZYCA
CHOROBA CIESZYŃSKA (TALFAŃSKA)
CHOROBA AUJESZKIEGO
ACTINOBACILLOZA
TĘŻEC
CHOROBA OBRZĘKOWA ŚWIŃ
ZAKAŻENIE MYKOPLAZMAMI
CHOROBA GLĀSERA
RÓŻYCA
STREPTOKOKOZA
HYPERTERMIA ZŁOŚLIWA
WRODZONA ROZKROCZNOŚĆ PROSIĄT
ZATRUCIE SOLĄ
27. Rozpoznawanie, różnicowanie i zwalczanie zakaźnych ronień u świń.
WIRUSOWE:
1) PRRS j.w.
2) SMEDI - zamieralność śródporodowa, rodzenie zmumifikowanych płodów, śmierć zarodków, niepłodność; przy dwóch jednostkach chorobowych:
parwowiroza
zakażenia enterowirusowe
3) CHOROBA AUJESZKIEGO
Herpesviridae
Liczne upadki do 10 dnia życia
4) POMÓR KLASYCZNY
Pestivirus
Przy wiremii i gorączce mogą być poronienia
5) AFRYKAŃSKI POMÓR ŚWIŃ
6) ZAKAŻENIA CYTOMEGALOWIRUSOWE
wirus PCMV
prosięta martwe lub słabe
7) CIRKOWIRUSOWE ZAKAŻENIA
wirus PCV
uszkodzenia mózgu w życiu płodowym - wrodzona drżączka u noworodków
8) GRYPA ŚWIŃ
przy wiremii mogą być ronienia
9) CHOROBA PĘCHERZYKOWA ŚWIŃ
BAKTERYJNE:
1) LEPTOSPIROZA
L.pomona, L.tarrasowi, L.canicola, L.icterohaemorrhagiae, L.sejroe
późne ronienia w III trymestrze ciąży
rodzą się prosięta martwe, słabe; rozlane zapalenie łożyska
diagnostyka laboratoryjna: odczyn aglutynacji mikroskopowej(OAM), odczyn hemaglutynacji biernej; do badania pobieramy surowicę min. 2 razy w odstępach 2-3 tyg.
L eczenie: penicyliny, amoksycylina; w ciąży: tetracykliny, enrofloksacyna.
szczepienie: 2x w odstępie 2 tyg., średnia skuteczność.
2) BRUCELOZA
B.suis
poronienia w różnym okresie ciąży, głównie w I połowie
zamieralność różna, także w obrębie miotu
stan płodu: autoloza lub obrzęk tkanki podskórnej
ropne zapalenie łożyska, w macicy martwicowo-ropne ogniska
rozpoznawanie: izolacja brucelli z tkanek poronionych płodów (ew. wycinek łożyska), badanie par surowic (odczyn aglutynacji, wiązanie dopełniacza) - krew 10-12 dni po poronieniu
gdy wynik „+” zabezpieczamy stado, izolujemy i zawiadamiamy powiatowego; chore wybijamy, pozostałe - bad. serologiczne.
3) LISTERIOZA
L.monocytogenes
zakażenie od owiec lub z kiszonką
ronienia a brak objawów nerwowych
odklejenie łożyska → poronienie
włóknikowe zapalenie macicy
4) RÓŻYCA
5) INNE: Staphylococcus aureus, E.coli, Bacillus, Corynebacterium pyogenes.
posiew rozstrzyga z czym mamy do czynienia
28. Diagnostyka różnicowa chorób świń z objawami ze strony ośrodkowego układu nerwowego.
POMÓR KLASYCZNY ŚWIŃ
CHOROBA PĘCHERZYKOWA ŚWIŃ
CHOROBA CIESZYŃSKA I TALFAŃSKA
CHOROBA AUJESZKIEGO
CHOROBA WYMIOTNA I WYNISZCZAJĄCA
DRGAWKI ZAKAŹNE
PRRS
WŚCIEKLIZNA
JAPOŃSKIE ZAPALENIE MÓZGU
CHOROBA OBRZĘKOWA
STREPTOKOKOZA ŚWIŃ
CHOROBA GLĀSERA
LISTERIOZA
TĘŻEC
BOTULIZM
ZATRUCIE SOLĄ
HIPOGLIKEMIA
ZATRUCIE FOSFOROORGANIKAMI
HIPOTERMIA
USZKODZENIA
PRZEŻUWACZE
Etiopatogeneza, drogi szerzenia, występowanie i znaczenie pryszczycy.
Etiologia
Rodzina Picornaviridae
Wirus wykryty w 1897 roku przez Loeflera i Froscha
Ponad 230 zarazków w 5 rodzajach:
Enterovirus
Hepatovirus
Rhinovirus
Cordiavirus
Aphtovirus
Brak osłonki, wirus ma 23 µm średnicy
Dwudziestościenne kapsydy zbudowane z 60 jednostek
Każda: 4 główne białka strukturalne (VP1, VP2, VP3, VP4)
VP1 odpowiada za adhezję, stymuluje odpowiedź immunologiczną i wiąże Ab neutralizujące
Jednopasmowy + spolaryzowany RNA (=mRNA)
Zwykle 1 gospodarz lub niewielu
Struktura antygenowa wirusa pryszczycy
7 Serotypów (A, O, C, SAT1, SAT2, SAT3, ASIA1)
Po infekcji pozostaje odporność, ale tylko na dany typ
Ponadto Ag powierzchniowe wirusa bardzo zmienne („dryf antygenowy”)
W obrębie powyższych typów ponad 60 podtypów
One indukują do pewnego stopnia odporność krzyżową na inne podtypy
To bardzo utrudnia immunoprofilaktykę
Patogeneza
Wirus wnika aerogennie (najłatwiej)
Inkubacja 2-14 dni
Replikacja wirusa na podniebieniu, języku i tam białe pęcherze pierwotne z klarownym płynem (lub np. na kończynach), Występuje od XVI wieku
To najgroźniejsza choroba zakaźna stanowiąca zagrożenie dla całego świata
1897 rok - Loefler i Frosch odkrywają wirus pryszczycy (zarazek przesączalny)
Azja, Afryka permanentnie zakażone pryszczycą
Nowa Zelandia - tu nigdy nie było pryszczycy
W Turcji występuje endemicznie
Szwecja oraz pozostałe kraje skandynawskie wolne od pryszczycy
Chorobotwórczość
Setki gatunków wrażliwych
Bydło, owce, kozy, inne przeżuwacze, też dzikie
Świnie domowe i dzikie
Szczury, nutrie, słonie, grizlly
Też wiele zwierząt laboratoryjnych (świnki morskie, myszy, szczury, króliki, chomiki)
Sporadycznie człowiek, ale to zupełnie wyjątkowo
Pryszczyca chyba mylona u człowieka z Hand-Foot and Mouth Disease czyli zakażeniem enterowirusem Coxsackie A
Koń nie wrażliwy na wirus pryszczycy
Wytrzymałość wirusa pryszczycy
Inaktywuje go temp 50ºC i pH <6.5 lub >9
W niskich temp, w obojętnym pH może przeżyć wiele tygodni, a nawet m-cy (do 3 m-cy w temp > 20ºC, a może też w temp 4-20ºC)
Aerozol z dróg oddechowych może być przy dużej wilgotności i braku nasłonecznienie przez kilka godzin zakażony
Dojrzewanie tuszy niszczy go, ale tylko (48h) w mięśniach
W 4ºC do 4 m-cy w ww. chł., szpiku i tłuszczu może przetrwać
gorączka, spada mleczność itp.
Krótka wiremia (2-4 dni) i od niej wtórne pęcherze (kończyny i wymię) i wirus w sercu i mięśniach szkieletowych
Zdarcie pęcherzy - nadżerki, ból, ale dobrze się goi chyba za bakterie (kończyny!)
Myocarditis u młodych głównie duża śmiertelność (śmierć sercowa)
Po wyzdrowieniu jeszcze jakiś czas wydalanie wirusa
Najbardziej zaraźliwa choroba bo:
Wiele dróg wydalania wirusa
Wydalanie już zaczyna się podczas inkubacji
Ogromne ilości wirusa wydalane
Wiele bram wniknięcia
Minimalna dawka wystarcza do zakażenia
Może przetrwać w środowisku
Może szerzyć się z wiatrem
Atakuje wiele gatunków
Skryty przebieg np. u owiec
Nosicielstwo bezobjawowe wirusa
Wydalanie wirusa pryszczycy
(Dni od 1-szych objawów)
Ślina (od 10 dni przed pierwszymi objawami do 9 dni po)
Mleko (-4 +4)
Nasienie (-4 +7)
Wydychane powietrze (-1 +4)
Mocz, kał (-1 +6)
Miejsca zmienione (0 +11)
Wydzielina z pochwy, poroniony płód, złuszczona skóra, części tuszy
Nosicielstwo wirusa
(≥28 dni od zakażenia)
Świnie nie
Bydło, owce, kozy: około 15% nosicieli po chorobie. Mechanizm tego „nielitycznego” zakażenia
Wirus bytuje w przełyku, na podniebieniu i okresowo z wydzieliną z nosa i gardła wydalany
Po kilku miesiącach to się kończy, ale u bydła rekordziści do 3 lat
Bramy wniknięcia wirusa
Aerogennie (bydło - wystarczy 25 wirionów)
Alimentarnie (bydło - wystarczy 3 mln wirionów)
Otarta skóra
Jatrogennie (zastrzyki, badanie)
Szerzenie się pryszczycy
Ruch zakażonych zwierząt
Obrót produktami zakażonymi (mięso z kością z Płd. Am., odpadki kuchenne dla świń!, inne!)
Ruch skażonego powietrza
Ruch skażonych ludzi
Ruch skażonego sprzętu
Rola wiatru w szerzeniu się pryszczycy
Świnie wydychają 3000 razy więcej wirusa niż bydło i to główne źródło skażenia powietrza
Z bydła czy owiec wiatr groźny do 1-2 km, bo wirus się rozprasza, ale od świń dużo dalej
Ważna wilgotność powietrza: jeżeli ponad 60% to aerozol długo utrzymuje się w powietrzu
Ważna pogoda: gdy pochmurnie i wiatr o stałym kierunku to „smugi” wirusa jak dym z ogniska; groźne do 10 km, dalej tylko nad morzem do 250 km
7.03 i 10.03.1981 rok - udokumentowane przeniesienie wirusa z Wielkiej Brytanii do Isla of Wight
Zagrożone głównie bydło, bo „zużywają” dużo powietrza
Źródłem skażenia może być też aerozol powstający w cysternie przy nalewaniu mleka
Występowanie pryszczycy
Występuje od XVI wieku
Nigdy nie było pryszczycy w Nowej Zelandii
Kraje skandynawskie wolne od pryszczycy
Endemicznie występuje w Turcji.
Pryszczyca w 2000 roku:
→Wiele krajów Ameryki Południowej
→Grecja, Rosja, Gruzja, Kazachstan - najbliżej granicy Polski
Pryszczyca w 2001 roku:
→Irlandia
→Holandia
→Francja
→Wielka Brytania
Rola owiec w epidemii w 2001 roku
Wielka Brytania ponad 20 mln owiec
U owiec dość skryta postać
Tylko 50% zakażonego stada miało objawy kliniczne
Objawy głównie w jamie ustnej, kulawizny
Straty z powodu pryszczycy
1. Bezpośrednie
Śmiertelność dorosłych parzystokopytnych do 2-3 % (serce, powikłania przy racicach, wymieniu itp.)
U młodych większa, a u noworodków masowa
Ronienia
Masowa śmiertelność np. żubrów
1. Pośrednie (u pozostałych 100%)
↓ Masy ciała o około 20%
Zatrzymanie mleka i innej produkcyjności
A więc tygodniami (miesiącami) są nieproduktywne, w dodatku wrażliwe na inne typy zarazka
Wstrzymanie obrotu zwierząt (eksportu latami!)
W efekcie katastrofalne skutki gospodarcze
Przebieg i rozpoznawanie pryszczycy u bydła i innych gatunków - diagnostyka różnicowa.
Bydło:
utrata apetytu, otępienie spowodowane wzrostem temperatury ciała do 40 - 41ºC (na początku okresu wiremii
u krów mlecznych znaczny spadek wydajności
ślinienie
pęcherze (pękają w ciągu 24 h), nadżerki, zbielałe płaty nabłonka, goją się szybko - kilka dni
lokalizacja pęcherzy: wewnątrz jamy ustnej, na języku, policzkach, wargach, podniebieniu; w szparze międzyracicowej i na koronce; w strzykach i na wymieniu
kulawizna (niechętnie wstają)
Świnie:
kulawizna, sztywne chodzenie, ból
pęcherze wokół końców racic i w szparze międzyracicowej, mogą rozwijać się na tarczy ryjowej i w jamie ustnej
wysoka śmiertelność prosiąt
ronienie - może być dość powszechne i stanowić problem kliniczny
Owce i kozy:
przebieg zazwyczaj łagodny i nieliczne objawy chorobowe
kulawizna (na jedną lub kilka kończyn)
pęcherzyki (mniejsze niż u innych gat.) wokół krawędzi i w szparze racic, mogą być na języku i płytce zębowej
wysoka śmiertelność jagniąt (myocarditis)
DIAGNOSTYKA RÓŻNICOWA:
→choroba pęcherzykowa świń
→wysypka pęcherzykowa świń
→pęcherzykowe zapalenie jamy ustnej
→księgosusz
→pomór małych przeżuwaczy
→choroba niebieskiego języka
→BVD-MD
→IBR/IPV
→wrzodziejące zapalenie strzyków bydła
→ospa rzekoma
→niesztowica
→zanokcica zakaźna
→oparzenia (słoneczne, chemiczne)
Zwalczanie pryszczycy.
Problemy diagnostyki
Objawy u świń identyczne z chorobą pęcherzykową (też ze Stomatitis Vesicularis, ale to tylko USA)
U owiec, kóz słabe objawy w jamie ustnej, brak ogólnych ewentualnie kulawizna podobna do kulawki czy choroby niebieskiego języka
U bydła podobne zmiany na języku i racicach przy BVD-MD
Więc laboratoryjnie:
Dawniej OWD, SN, ELISA, próba biologiczna na myszach, ale to „typowo” swoiste
Dziś też PCR (Primer dla wszystkich typów)
Do izolacji wirusa - płyn z pęcherzy, nabłonek lub strzępki pryszczycowych zmian nabłonka, płyn przełykowo-gardłowy, krew pełna
Do badań serologicznych - surowisa
Brak szybkich testów (by w 24 h zabić)
Brak doświadczenia lekarzy i laborantów
Odporność
Po przechorowaniu są Ab SN latami
Korelacja między mianem a niewrażliwością
Odporność tylko na dany typ (częściowo podtyp)
Do 2-3 m-cy odporność siarowa
Dla bydła są w miarę skuteczne szczepionki
Szczepionki przeciwko pryszczycy
Były na świecie od dziesięcioleci z inaktywowanym wirusem (lub żywym atenuowanym niekiedy)
Wiele krajów bydło profilaktycznie szczepiło
U bydła uchodziły za dość skuteczne (na dany typ)
U świń nie
Więc u świń nie szczepiono, co poważną luką
Z czasem okazało się, że u bydła słaba odporność
Nie chroniły bydła przed egzotycznymi typami
A ogromne koszty
Często pryszczyca od szczepień - np. w RFN większość wybuchów po 1970 roku od tego, w innych krajach też, bo nie ma metod gwarantujących, że partia szczepionki jest wolna
W Europie w latach 1954-1990 około 75% ognisk pryszczycy była związana z produkcją lub stosowaniem szczepionki!
Strategie zwalczania pryszczycy
Zwalczana z urzęduJak najszybszy ubój źródeł zakażenia
Czasem też zwierząt wokół
Unieszkodliwienie zwłok
Izolacja ognisk choroby
Dezynfekcja
Szczepienia Bez szczepień
Profilaktyczne Z konieczności
(„pierścieniowe”): 2 km wokół ogniska i ubój
Powody „polityki nieszczepienia” przeciw pryszczycy w UE
Zagrożenie przy produkcji i stosowaniu szczepionki
Ograniczona skuteczność u bydła, a zwłaszcza u świń
Trudności odróżnienia nosicieli od zwierząt szczepionych
Więc wszystkie sero(+) są podejrzane o zakażenie
Koszty (szczepionki, szczepień, rejestracji, nadzoru itp.)
Starty eksportu, bo najlepsi importerzy żądają statusu kraju wolnego od pryszczycy
Bez szczepień odzyskanie tego statusu po 3 m-cach od wybicia ostatniego oraz udokumentowanie sero(-)
Jeśli szczepiono - to dopiero po 12 m-cach (o ile sero(-)!)
A jeśli szczepiono i nie wybijano - dopiero po 24 m-ach
Więc polityka „nieszczepienia profilaktycznego” sprawdziła się
Rok 2001 tej oceny nie zmienił
Szczepionki dziś lepsze, ale nadal niedoskonałe, (choć już po tygodniu odporność)
Potrzeba szczepionki markerowej lub innego odróżniania szczepionych od zakażonych (inne epitopy komórek B u zakażonych?)
Od 1991 roku w UE zakaz szczepień profilaktycznych.
Obecne zwalczanie pryszczycy w UE
Od 1983-92 żadnych szczepień profilaktycznych, bo długotrwałe wstrzymanie eksportu (koszty!)
Tylko wybijanie źródeł, izolacja, dezynfekcja
Dążenie do „regionalizacji” - rejony o podobnym statusie epidemiologicznym
Diagnostyczne zaplecze laboratoryjne
Zespoły doradców
Szkolenia i instrukcje postępowania przy podejrzeniu
Środki finansowe i sprzęt w pogotowiu
Ale też utrzymywanie rezerw szczepionek na różne typy i 2001 rok potwierdził sens szczepień interwencyjnych („Tłumiących”)
Cel: UE wolna od zarazka pryszczycy
I zapobieganie zamiast immunoprofilaktyki
Więc nadzór na granicach nad importem
Postępowanie przy zwalczaniu pryszczycy w Polsce:
Obowiązek zgłaszania i zwalczania
Podejrzenie wystąpienia pryszczycy:
pobranie prób do badań laboratoryjnych
izolacja zwierząt
ograniczenie przemieszczania się ludzi i ruchu zwierząt
dochodzenie epizootyczne
odwołanie podjętych środków jeśli wyniki badań „-” lub zwalczanie gdy „+”
Potwierdzenie pryszczycy:
tworzy się obszar zapowietrzony o promieniu min. 3 km - na tym obszarze zwierzęta gatunków wrażliwych są wybijane
tworzy się obszar zagrożony o promieniu 10 km - w nim zwierzęta poddawane są badaniom klinicznym.
Dezynfekcja przy pryszczycy
1-2% NaOH
Mniej żrący jest 4% Na2CO3
0.2-2% kwas cytrynowy, mlekowy, roztwór octu
Kwas azotowy (gnojowica do pH<5)
Mniej skuteczne fenole i zasady amoniowe
Na rynku np. Agrosteril, Aldekol, Virkon
Etiopatogeneza , drogi szerzenia, występowanie i znaczenie brucelozy bydła.
Ważna choroba wielu gatunków zwierząt i człowieka
Występuje na całym świecie
Choroba przewlekła
Dominujące objawy:
Ronienia
Zatrzymanie łożyska
Zaburzenia płodności
Spadek mleczności
Od 1975 r. choroba zwalczana z urzędu
Około 100 lat temu angielski lekarz (Bruce) leczył lekarzy na Malcie wykrył u nich zarazek Micrococcus melitensis
Dr Bang, lek.wet. z Anglii wyizolował z martwych płodów bydlęcych Bacterium abortus bovis
Po I wojnie światowej odkryto związek między zachorowaniami ludzi, bydła, owiec, kóz
1920 r. - połączono te dwa d-u we wspólną grupę Brucella
Jest to ZOONOZA
Choroba zawodowa lek.wet., rzeźników, inseminatorów, itp.
W mniejszym stopniu konsumentów mleka i mięsa
W latach 60-tych kilkanaście % bydła dodatniego rozpoznane w gospodarstwach spółdzielczych
Po II WŚ zaczęto problem ograniczać
Etiologia
Kokopałeczki G(-)
Nie ma otoczki, ruchu, nie wytwarza przetrwalników
Bezwzględne beztlenowce (5-10% CO2 dodatek)
Rosną dobrze na podłożach wzbogaconych
Identyfikacja test aglutynacji
Rożne gatunki brucelli mają wspólne antygeny i każdy z nich daje r-cję aglutynacji, ale nie rozróżni gatunku!
Gatunek |
Główny żywiciel |
Antygen aglutynacyjny |
||
Szczepy „gładkie” |
|
A |
M |
|
|
B. abortus |
Bydło |
+ (przeważa) |
+ |
|
B. melitensis |
Owca, koza |
+ |
+ (przeważa) |
|
B. suis |
Świnia, zając |
+ |
+ |
Szczepy „szorstkie” |
|
|
|
|
|
B. ovis |
Owca |
- |
- nie wykryje się |
|
B. canis |
Pies |
- |
- testem aglutynacji |
Człowiek najwrażliwszy na B. melitensis!, B. suis, B. abortus, B. canis.
Jest ścisłe pokrewieństwo między antygenami Brucella i Yersinia enterocolitica powoduje to duże trudności diagnostyczne.
Czynniki zjadliwości
Endotoksyna (bo G(-))
Czynniki antyfagocytarne
Drobnoustrój ściśle wewnątrzkomórkowy
Poszczególne szczepy różnią się bardzo zjadliwością
„In vitro” wrażliwe na wiele antybiotyków, „in vivo” NIE!
Leczenie antybiotykami daje różne efekty, bo zarazek jest wewnątrz komórki
Dość wrażliwy jna wysychanie, słońce, wysoką temperaturę w 60ºC ginie po 10 minutach
W wilgotnym środowisku, bez słońca może przeżyć 5 m-cy (gleba, woda, ser, masło)
Środki dezynfekcyjne rutynowo stosowane: wapno chlorowane 2,5%, NaOH 2%
Epidemiologia
Powinowactwo gatunków Brucella do żywiciela i u tych żywicieli przebiega choroba enzootycznie
Jeżeli gatunek Brucella „przeskoczy” na innego żywiciela, może wywołać u niego chorobę, ale nie będzie się ona szerzyła wśród tego gatunku żywiciela
Owady ssąco-kłujące mogą być zakażone, ale nie mają u nas znaczenia
Zające odgrywają rolę w przenoszeniu brucelozy na świnie
Poszczególne gatunki Brucella mają upodobania do stref klimatycznych:
Klimat umiarkowany B. abortus
Klimat śródziemnomorski B. melitensis
Wszędzie B. ovis, B. suis
Jest to typowa choroba wielkich stad
Szerzyła się przede wszystkim z zakażonymi jałówkami przy remoncie stada, przy kryciu (teraz inseminacja trochę to wyeliminowała)
Też młode cielęta bez objawów mogą mieć znaczenie w rozprzestrzenianiu choroby (młode bydło przed osiągnięciem dojrzałości płciowej mniej wrażliwe chorują bezobjawowo i są nosicielami; z kałem!)
Zarazek wydalany z płodami, wodami płodowymi (główne źródło - roniące krowy)
Okresowo w mleku, moczu, kale, wypływie z pochwy, nasieniu
Zakażenie pośrednio też przez wilgotne powierzchnie, np. okolice wodopoju
Wnikanie zarazka:
Alimentarnie (pasza, woda)
Nieuszkodzona skóra
Uszkodzona skóra
Lekarz weterynarii zakaża się przez skórę, np. przy odklejaniu łożysk bez rękawic
Patogeneza
Różna zjadliwość szczepów
Zawsze proces przewlekły, od subklinicznych do klinicznie jawnych (dominują poronienia) lub nie powodują zakażenia (młode cielęta)
Zarazek wnika, jest fagocytowany i roznoszony hematogennie i limfogennie docelowo do komórek USŚ oraz układu rozrodczego (głównie ciężarna macica, u samców - jądra, najądrza); zarazki mogą też docierać do stawów, kaletek ścięgnistych, wymienia (zapalenie)
Poronione łożysko - zmiany martwicze w liścieniach, pomiędzy nimi bł. śluz. Obrzękła i zgrubiała, poroniony płód pokryty ropnym wysiękiem, obrzęk tkanki podskórnej, pępowiny, śledziony, wątroby, płyn w jamach ciała, wybroczyny w pęcherzu moczowym i żołądku.
Osobniki żeńskie są wrażliwsze!
W narządach rodnych powstają przewlekłe zmiany, samice ronią między 5 a 6 miesiącem ciąży, rodzą się gorsze, słabsze cielęta, które nie ssą itp., łożysko nie odkleja się endometritis. Problemy z mlecznością. Przewlekłe zapalenie macicy, jałowienie w stadzie.
Potem proces „przycicha”, nawet w następnych ciążach mogą rodzić się zdrowe cielęta. Nie każde cielę od zakażonej krowy jest zakażone
U buhajów zapalenie jąder, najądrzy (ropnie, sekwestry), często jedynym objawem są zmiany w stawach
Bardzo rzadko posocznica
Znaczenie ekonomiczne
Straty z powodu brucelozy bydła (przewidywania statystyczne):
I rok zakażenia stada:
60% zakażonych ronienia lub upadki noworodków
22% zakażonych słabe cielęta (o 20% mniejsza masa urodzeniowa), 10% pada
Po 1-2 latach zakażenia stada:
5% zakażonych ronienia i upadki noworodków
17% zakażonych rodzą się słabe cielęta
15% krów okres między ciążowy wydłuża się do ponad 3 miesięcy
Brucelozy u innych zwierząt
B. melitensis - problem u owiec i kóz nad Morzem Śródziemnym, tak jak u nas u krów ronienia, słabe płody itp., diagnostyka j.w.
B. suis - biotyp I i III u świń. Przewlekłe, utajone zaburzenia rozrodu u świń. Biotyp II - główny rezerwuar to zające i dziki, nie ma ogromnego znaczenia w przenoszeniu. Diagnostyka j.w.
B. canis - bezobjawowo u psów lub objawy niespecyficzne. Mogą być ronienia, mogą rodzić się słabe szczenięta. Zapalenie jąder (nawet zanik), najądrzy, prostaty, skóry moszny - w efekcie bezpłodność u samców. Problem w USA - głównie w dużych hodowlach psów. Są podejrzenia, że zakażenia mogą też być w Polsce (2%)
B. ovis - występuje w Polsce (1-1,5% owiec). Jest mało ch-y, też dla owiec. Ronienia są bardzo rzadko, ale są problemy z płodnością samców z powodu pogorszenia jakości nasienia
Człowiek
Świeżych zakażeń już chyba nie ma, choć diagnozuje się nowe przypadki, ale zakażenie chyba było dawno, bo rozpoznane nowe przypadki u ludzi starszych
Charakter przewlekły zakażenia
Osłabienie, złe samopoczucie, bóle głowy, stawów, powiększenie śledziony, nawrotowa gorączka
Bruceloza importowana z Grecji
Bruceloza od zajęcy - pojedyncze przypadki
Rozpoznawanie i zwalczanie brucelozy bydła.
Zwalczanie Brucelozy w Polsce
Od 1948 r. wybrane stada - badanie i osobniki dodatnie do „izolatorów bangowych”
Od 1951 r. szczepienie jałówek (S-19) ograniczenie strat (żywy osłabiony szczep, nie był obojętny dla człowieka, zaciemniał diagnostykę), nie zmieszała liczby zwierząt zakażonych
Od 1969 r. (kilkanaście % seroreagentów w PGR-ach i spółdzielniach, ≤ 0,5% w gospodarstwach indywidualnych) początek właściwego zwalczania na podstawie „Ustawy o zwalczaniu chorób zakaźnych” z dnia 13.II.1963 r.
Masowe badania serologiczne
Wybijanie osobników dodatnich lub „izolatory bangowe”
Ograniczenie szczepień
Od 1975 r. bruceloza staje się chorobą zwalczaną z urzędu
Likwidacja „izolatorów bangowych”
Zakaz szczepień
Od 01.12.1980 r. Polska krajem wolnym od brucelozy (< 0,5% zakażonych, <0,2% stad > 3 lat bez szczepień)
Ostatnia izolacja B. abortus z poronionego płodu w 1982 r.
Jest obowiązek badania każdego poronionego płodu w kierunku brucelozy (ale nie jest to egzekwowane!)
Na świecie w wielu krajach jest to poważny problem. W latach 90-tych na 170 państw, 140 ma brucelozę na swoim terenie (wg ankiety WHO)
Ostatnio od brucelozy uwolniła się Kanada
Nie ma brucelozy w USA
Zakażenia bydła od dzikich przeżuwaczy
W Azji, Afryce, Ameryce Łacińskiej - problem
Problem też w Grecji, Hiszpanii, Portugalii, we Włoszech
Zjawiska odpornościowe
U bydła yersinoza przebiega bezobjawowo. Trudno, więc rozróżnić zarazek Brucella od Yersinia mają taki sam glikopolisacharyd otoczkowy
We Francji, Belgii znowu zaczęły narastać „+” krowy interpretowano, że są to zakażenia Y. enterocolitica (odczyny nieswoiste). Aż w końcu bydło zaczęło masowo ronić w Holandii
Próba użycia w diagnostyce brucelozy nadwrażliwości późnej - „Uczulenia na `brucellinę'”, lub test z γ-interferonem
IgM powstają szybciej niż IgG, które jednak dłużej się utrzymują
Odczyn aglutynacji wykorzystuje się on szczególnie silnie wychodzi, gdy jest dużo przeciwciał IgM
OWD raczej wykrywa przeciwciała klasy IgG i prowadząc diagnostykę brucelozy staramy się wykryć, czy wysokie miano jest w IgG czy IgM. W przypadku brucelozy zakażeni jest TRWAŁE, organizm nie może uwolnić się od zarazka, więc po pewnym czasie będą IgG. W przypadku, gdy krowa zakaziła się Yersinia enterocolitica, to zakażenia przebiega bezobjawowo, przechodzi, więc powinny być głównie przeciwciała klasy IgM.
Bada się kontrolnie bydło:
OKAP (odczyn kwaśniej aglutynacji płytkowej) - jest stosunkowo swoisty, ale daje też wyniki fałszywie „+” (gdy krowa jest zakażona Yersinia)
Gdy wynik „-„ wierzymy
Gdy wynik „+” mierzymy aglutynacją probówkową (oznaczenie miana aglutynacyjnego) i OWD:
Aglutynacja też daje wyniki fałszywie „+”
Test OWD jest bardziej wiarygodny, ale jest bardziej skomplikowany i drogi, ale czasami też może wychodzić wątpliwie. Wtedy wykonujemy 2 odczyny referencyjne (odwoławcze):
Odczyn z merkaptoetanolem - prosty, robi się aglutynacje probówkową, potem robi się to samo, ale po zadziałaniu na surowice merkaptoetanolem (alkohol niszczący IgM). Gdy odczyn spada - mogła być Yersinia.
Odczyn antyglobulinowy Coombsa - można wykryć przeciwciała nie mające zdolności aglutynacji.
Im mniej zwierząt zakażonych, tym więcej reakcji nieswoistych, a więc bardziej czuły musi być test do wykrywania zwierząt zakażonych
W niektórych krajach stosuje się test ELISA - można nim szukać przeciwciał w mleku, bo jest tak czuły. Można nawet badać mleko zbiorcze (50-60 krów). W ten sposób łatwo też potwierdzić, że stado jest wolne od brucelozy.
Etiopatogeneza, drogi szerzenia, występowanie i znaczenie enzootycznej białaczki bydła.
Przewlekłe, dożywotnie zakażenie wirusowe bydła
Zazwyczaj subkliniczne (dopasowanie ewolucyjne),rzadko nowotworowe
Szeroko rozpowszechnione na całym świecie (też Polska)
Zwalczone tylko w niektórych krajach (bariera handlu!)
W Polsce zwalczana z urzędu od lat 80-tych
Też w UE (OIE - lista B)
W Danii, Wielkiej Brytanii, Niemczech, Czechach - zwalczone
Dużo w krajach tropikalnych (owady?)
W USA 20% bydła mlecznego i 10% mięsnego zakażonego
Zwykle w kraju - do kilku % bydła zakażonego
Ale w pewnych stadach do kilkudziesięciu % (jatrogennie?)
(Zachód) w latach 80-tych stada w 10-90% zakażone
Do 1990 tylko inwentaryzacja białaczki w wybranych oborach
Potem tworzenie obór białaczkowych lub wybijanie
Ale mało konsekwentnie
Więc % zakażonych spada, ale nadal białaczka jest
Restrykcje importowe bydła zakażonego i pewnych produktów
Utrudnienie obrotu w kraju
Obniżona mleczność i płodność niektórych stad zakażonych
Sporadycznie guzy = upadki i brakowanie (i straty mięsa)
Natomiast nie ma znaczenia u innych gatunków niż bydło
Rodzaj Deltaretrovirus, rodzina Reoviridae
Szybko inaktywowany przez rozpuszczalniki organiczne, środki dezynfekcyjne, ciepło, też pasteryzację
Dość szybko ginie poza organizmem (56°C - 30 min)
Białko p24 rdzenia - niezmienne (diagnostyka serologiczna)
gp51 otoczki stymuluje odporność, ale mutacje punktowe
Podobny biochemicznie, biofizycznie, genetycznie i częściowo antygenowo do innych wirusów białaczki ssaków typu C
Słaby potencjał onkogenny (brak własnego onkogenu)
Namnaża się w hodowlach komórkowych bydła i owiec
Zakaża bydło (sporadycznie owce, kozy - też guzy u nich)
Niegroźny dla innych gatunków i ludzi
Nie stwierdzono u ludzi ani wirusa, ani przeciwciał, a krwią ludzi z białaczką nie udało się zakazić cieląt
postać guzowata skóry
postać młodociana białaczki - forma uogólniona i forma grasiczna
enzootyczna białaczka
sporadyczna białaczka bydła -postać limfosarcomy
Rezerwuar - bydło (owce i kozy nie mają znaczenia)
Ale ono wolnego wirusa uwalnia niewiele
Gros jego (uwalniania) to prowirus w limfocytach
Więc przeniesienie limfocytów s.c., i.m., i.v., p.o., i.p., donosowo, domacicznie - wszelakie
Wystarczy 2500 limfocytów (1/100 kropli krwi!!)
Więc najczęściej krew - transfuzje, rektalnie, igły, narzędzia (jatrogennie!!!), dekornuacje, kolczykowanie, tatuaż, korekcja racic, owady itp.,
Śródmacicznie rzadko (do kilka-kilkanaście % płodów)
Dużo limfocytów w siarze, ale przeciwciała, więc małe znaczenie
Nasienie, mleko, ślina itp. - małe znaczenie (chyba, że z krwią!)
Szerzy się dość wolno w stadzie
Wymaga długiego i ścisłego kontaktu, więc różny % zakażeń
Namnaża się i dożywotnio bytuje głównie w limfocytach B
Wbudowany jako prowirus w genomie
Przeciwciała po 1-3 m-ach
I są dożywotnio, (choć ich spadek np. okołoporodowy)
Ale one nie mogą uwolnić od zakażenia
Jednak hamują proces chorobowy, więc bezobjawowo lub:
30-50% długotrwała limfocytoza bez innych objawów
Sporadycznie chłoniakomięsaki u starszych niż 3-5 lat (śledziona, wątroba, nerki, przewód pokarmowy, serce, rdzeń): powiększenie węzłów chłonnych (węzłowica), objawy zależne od lokalizacji - brak apetytu, niestrawność, wzdęcia, zaburzenia ruchu itp.
To = brakowanie lub sporadyczne nagłe upadki (pęknięcie śledzion)
Lub częściej przypadkowe rozpoznania (rzeźnia, jałowość)
U bydła zdarzają się chłoniakomięsaki niezakaźne, zwłaszcza u cieląt (ewentualnie do 3 lat) w grasicy i skórze lub rozsiane
Diagnostyka brucelozy w Polsce - co roku bada się 1/3 populacji, zwierzęta powyżej 1 roku, wszystkie buhaje w stacjach unasienniania.
Występowanie
W Polsce
Znaczenie
Właściwości wirusa (Bovine Leukemia Virus - BLV)
Postaci kliniczne białaczki bydła:
Drogi szerzenia
Patogeneza i odporność
Zakażenie wirusem EBB
(Post lub prenatalne)
Okres
Inkubacji
Prowirus w LB
Odpowiedź immunologiczna
Trwała limfocytoza Przebieg aleukemiczny
Z Bez Z Bez
Tworzenia się guzów
Poronne zakażenie z
uwolnieniem się od wirusa?
21
Wyszukiwarka
Podobne podstrony:
MYKOPLAZMOWE U ŚWIŃ, weterynaria, zakaźne, świnie
Świnie ćw kolo nr 3
Świnie sciaga
Świnie cz. 1, prewencja wet
Świnie ćw kolo nr 3
sciaga swinie
Świnie cz. 1, weterynaria, 5 rok semestr 2, prewencja wet
Tabelki 2, SWINIE - pomory i rozyca -tabela, Jednostka chorobowa
ZAKAŹNE ZAPALENIE ŻOŁĄDKA I JELIT ŚWIŃ, Epi, Swinie
długie świnie 2
CHOROBA AUJESZKY, Epi, Swinie
swinie1, Epi, Epizootiologia
choroby świń, Choroby świnie, Choroba wymiotna i wyniszczająca
parwo swinie
dermatologia kozy, owce, świnie
świnie(1)
więcej podobnych podstron