Wprowadzenie:
Celem ćwiczenia jest wyznaczenie liczby przenoszenia jonów.
Liczby przenoszenia pozwalają odpowiedzieć na pytanie w jaki sposób odbywa się rzeczywisty proces przenoszenia jonów w roztworze elektrolitu pod wpływem pola elektrycznego.
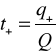
gdzie Q oznacza całkowity ładunek przeniesiony przez roztwór, a q+ jest wielkością ładunku przeniesionego przez kationy. Analogicznie definiujemy liczbę przenoszenia anionu:
![]()
Ponieważ ![]()
, zatem z powyższych równań wynika, że suma liczb przenoszenia jest równa jedności:
![]()
Jeżeli przez roztwór przepuścimy ładunek równy jednemu faradajowi (1F), to dokładnie jeden gramorównoważnik kationów zostanie zredukowany na katodzie, a jeden gramorównoważnik anionów 1utleniony na anodzie. Liczba elektronów otrzymanych na anodzie w wyniku reakcji jest równa liczbie elektronów dostarczonych do katody dla przeprowadzenia procesu redukcji.
Poza tym w ćwiczeniu będzie wykorzystane I prawo Faradaya:
![]()
Jedną z metod eksperymentalnych oznaczania liczb przenoszenia jest metoda Hittorfa. Przestrzeń pomiędzy elektrodami dzielimy na trzy części: katodową, środkową i anodową. Przy założeniu, że przed rozpoczęciem elektrolizy (stan a) w każdej z tych przestrzeni znajduje się dokładnie 6 gramorównoważników elektrolitu typu 1-1 (np. HCl):
Znak + obrazuje gramorównoważnik kationów, zaś znak - gramorównoważnik anionów.
Schemat został wykonany przy założeniu, że prędkość anionu jest trzy razy większa od prędkości poruszania się kationu. Po przeprowadzeniu przez naczyńko 4 faradajów uzyskujemy w rezultacie stan c. Jak widać w przestrzeni środkowej stężenie nie uległo zmianie- zmieniło się jedynie w przestrzeniach elektrodowych. Zmiana stężenia nastąpiła tam w wyniku równoczesnego przebiegu dwóch procesów: reakcji elektrodowej i migracji jonów w polu elektrycznym.
Liczbę przenoszenia można obliczyć licząc zmiany ilości gramorównoważników jonów w przestrzeni anodowej i katodowej (Δnk (a))i dalej podstawiając do wzorów:
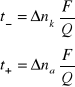
Wyszukiwarka
Podobne podstrony:
15 wyznaczanie ciepła spalania, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, Chem
Zagadnienia do egzaminu I i II sem, Studia PŁ, Ochrona Środowiska, Fizyka, Egzamin
Do druku askorbinowy, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczn
11 wyznaczanie ciepła rozpuszczania, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy,
15 wyznaczanie ciepła spalania(1), Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, C
31 wyznaczanie izotermy mieszania trzech cieczy, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, la
Do druku impulsy, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz
Do druku octowy, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz
mmgg, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II sprawka
spr57, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy
Moje 50 , Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II spr
monia 11, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II spr
2011 info dla studentow sesja letnia OŚ, Studia PŁ, Ochrona Środowiska, Chemia, ogólna i nieorganicz
KOND41vmac, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II s
rad, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II sprawka
więcej podobnych podstron