Przemysław Woiński
166867
Ochrona Środowiska
BiNoŻ
Data: 7.12.2011r
Godziny zajęć: 12:15 - 16:15
Laboratoria Chemii Fizycznej
ĆWICZENIE NR 57
TEMAT: Wyznaczanie stałej dysocjacji słabego kwasu metodą potencjometryczną.
1. Celem ćwiczenia jest wyznaczenie metodą miareczkowania pehametrycznego stałej równowagi reakcji dysocjacji kwasu octowego.
2. Wstęp teoretyczny:
![]()
Stałą dysocjacji przy użyciu aktywności wyraża się wzorem:
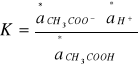
Po zlogarytmowaniu stronami i zastąpieniu aktywności stosunkiem stężeń otrzymujemy
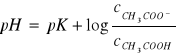
W trakcie miareczkowania roztworu zachodzi reakcja
![]()
W związku z tym, że octan sodu dysocjuje całkowicie ilość jego moli jest porównywalna z ilością moli jonów CH3COO-, a co za tym idzie:
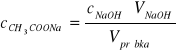
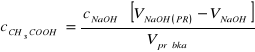
Uwzględniając powyższe równanie otrzymuje:
![]()
3. Dane i wyliczenia:
VNaOH [cm3] |
pH |
0 |
3.24 |
0.5 |
3.50 |
1 |
3.65 |
1.5 |
3.76 |
2 |
3.84 |
2.5 |
3.93 |
3 |
4.00 |
3.5 |
4.05 |
4 |
4.10 |
4.5 |
4.15 |
5 |
4.19 |
5.5 |
4.24 |
6 |
4.28 |
6.5 |
4.33 |
7 |
4.36 |
7.5 |
4.40 |
8 |
4.44 |
8.5 |
4.48 |
9 |
4.52 |
9.5 |
4.56 |
10 |
4.59 |
10.5 |
4.63 |
11 |
4.66 |
11.5 |
4.71 |
12 |
4.75 |
12.5 |
4.79 |
13 |
4.84 |
13.5 |
4.89 |
14 |
4.95 |
14.5 |
4.99 |
15 |
5.02 |
15.5 |
5.09 |
16 |
5.17 |
16.5 |
5.23 |
17 |
5.31 |
17.5 |
5.49 |
18 |
5.59 |
18.5 |
5.94 |
19 |
8.45 |
19.5 |
9.34 |
20 |
9.93 |
20.5 |
10.21 |
21 |
10.40 |
21.5 |
10.41 |
22 |
10.46 |
22.5 |
10.53 |
23 |
10.57 |
23.5 |
10.62 |
24 |
10.66 |
24.5 |
10.69 |
25 |
10.73 |
Odczytuje wartość pKa z powyższego wykresu
pKa = 5.329
Ka = 10-5.3291 = 4.687E-06
5. Wnioski:
W wyniku przeprowadzonego doświadczenia, które celem było wyznaczanie stałej dysocjacji słabego kwasu metodą pehametryczną, ustalono wartość pKa = 5.329. Obliczona wartość jest wyższa od wartości dla tej stałej prezentowanej w literaturze, co najprawdopodobniej spowodowane jest niedokładnością pomiaru.
Punkt przegięcia wykresu 1 odczytuje precyzyjnej z wykresu 2 i jest to wartość 18.5 ml NaOH.
Wyszukiwarka
Podobne podstrony:
mmgg, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II sprawka
Moje 50 , Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II spr
monia 11, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II spr
15 wyznaczanie ciepła spalania, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, Chem
KOND41vmac, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II s
rad, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II sprawka
spr15, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy
Do druku askorbinowy, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczn
Elektroda szklana, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna c
Podczas wymuszonego przep+éywu p+éynu, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wsz
27 poprawa 2, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, Chemia fizyczna
POLSKI, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II spraw
spr26, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy
lab50as, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II spra
hk spr numer 23, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz
11 wyznaczanie ciepła rozpuszczania, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy,
więcej podobnych podstron