Celem mojego ćwiczenia jest wyznaczenie stałej szybkości reakcji sacharozy katalizowanej jonami H+. W tym celu wykonuję moje doświadczenie następująco:
W suchej kolbie miarowej o pojemności 100 ml mieszam roztwory sacharozy i 2n H2SO4 w proporcjach 50ml : 50ml. Jednocześnie włączam lampę sodową, aby rozgrzała się do chwili rozpoczęcia pomiarów. Pobieram od asystenta rurkę polarymetryczną, która jest już z jednej strony zamknięta; uzupełniam ją przygotowanym roztworem, delikatnie nasuwam szkiełko, tak aby nie utworzyły się pęcherzyki i zakręcam rurkę głowicą z drugiej strony. Ze względu na zabezpieczenie przyrządu przed korozją opłukuje rurkę wodą, wycieram i umieszczam w polarymetrze. Ostrość i oświetlenie w przyrządzie jest już ustawione, a więc odczytuje zerowy pomiar kąta skręcenia. Kolejne pomiary kątów skręcenia płaszczyzny polaryzacji odczytuję w odstępach 15-minutowych przez 135 minut od momentu zanotowania pierwszej wartości. Po wykonaniu pierwszego odczytu kolbkę z pozostałym roztworem umieszczam w termostacie o temperaturze 60°C i po okresie 2,5 - 3 godziny odczytuję kąt α∞. Wyniki pomiarów zamieszczam w tabelce:
t [min] |
0 |
15 |
30 |
45 |
60 |
75 |
90 |
105 |
120 |
135 |
αt |
16,50 |
14,50 |
13,10 |
11,40 |
10,00 |
8,60 |
7,20 |
6,20 |
5,00 |
4,05 |
a zanotowana wartość α∞ wynosi -5,1°.
Dla tych danych i α0 - α∞ = 21,6 przeliczam następujące wartości:
t [s] |
αt- α∞ |
y=ln(α0- α∞/ αt- α∞) |
0 |
21,6 |
0,000 |
900 |
19,6 |
0,097 |
1800 |
18,2 |
0,171 |
2700 |
16,5 |
0,269 |
3600 |
15,1 |
0,358 |
4500 |
13,7 |
0,455 |
5400 |
12,3 |
0,563 |
6300 |
11,3 |
0,648 |
7200 |
10,1 |
0,760 |
8100 |
9,15 |
0,859 |
Następnie sporządzam wykres zależności y = kt:
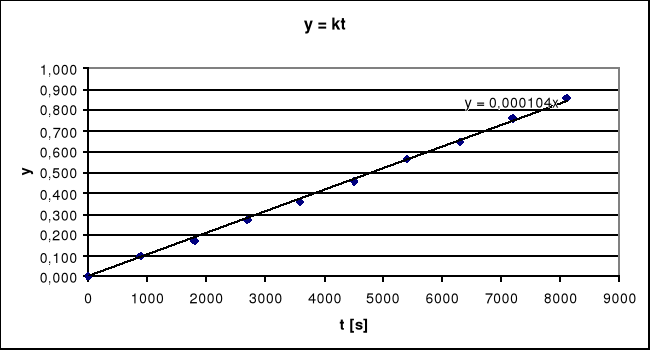
Z wykresu odczytuję stałą szybkości k = 0,000104 [1/s].
Wnioski:
Otrzymana przeze mnie wartość stałej szybkości wynosi k = 0,000104 [1/s]. Doświadczenie moje przeprowadzałem starannie: bardzo dokładnie odczytywałem wartości przy pomocy noniusza na obwodzie koła pionowego lampy sodowej, zachowywałem dokładnie 15-minutowe odstępy między pomiarami; chyba jedynym powodem ewentualnej niedokładności może być fakt, że temperatura, w której termostatowana była reszta mieszaniny sacharozy i 2n kwasu siarkowego(VI) nie osiągnęła zakładanej temperatury 60°C, co mogło wpłynąć na odczytaną wartość kąta α∞, a w efekcie na całość przeprowadzonych obliczeń.
Wyszukiwarka
Podobne podstrony:
mmgg, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II sprawka
spr57, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy
Moje 50 , Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II spr
monia 11, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II spr
15 wyznaczanie ciepła spalania, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, Chem
2011 info dla studentow sesja letnia OŚ, Studia PŁ, Ochrona Środowiska, Chemia, ogólna i nieorganicz
KOND41vmac, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II s
rad, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II sprawka
spr15, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy
Do druku askorbinowy, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczn
Elektroda szklana, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna c
Podczas wymuszonego przep+éywu p+éynu, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wsz
27 poprawa 2, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, Chemia fizyczna
POLSKI, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II spraw
spr26, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy
lab50as, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II spra
więcej podobnych podstron