Obliczenia:
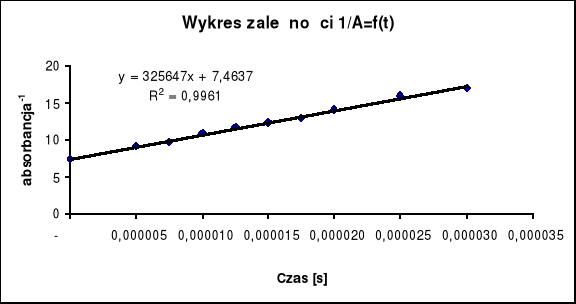
Na otrzymanym wykresie obieram 10 punktów pomiarowych odpowiadających wartością U które zamieściłem w tabeli 1, przyjmując czas to = 0 w punkcie skoku. Wyliczam absorbancję na podstawie wzoru:
![]()
Wyznaczam Ao z wykresu zalezności 1/A = f (t), gdzie odpowiada ona wartości stałej b w równaniu prostej y = ax + b. Ao wynosi w moim przypadku Ao=0,13398
Tabela 1:
Czas T [s] |
U [V] |
(Uo- U)/Uo |
A |
1/A |
- |
0,068 |
1,3696 |
0,1366 |
7,3216 |
0,000005 |
0,056 |
1,2857 |
0,1091 |
9,1622 |
0,000008 |
0,053 |
1,2663 |
0,1025 |
9,7516 |
0,000010 |
0,048 |
1,2353 |
0,0918 |
10,8968 |
0,000013 |
0,045 |
1,2174 |
0,0854 |
11,7055 |
0,000015 |
0,043 |
1,2057 |
0,0813 |
12,3070 |
0,000018 |
0,041 |
1,1943 |
0,0771 |
12,9671 |
0,000020 |
0,038 |
1,1776 |
0,0710 |
14,0871 |
0,000025 |
0,034 |
1,1560 |
0,0629 |
15,8871 |
0,000030 |
0,032 |
1,1455 |
0,0590 |
16,9555 |
Obliczam dawkę zaabsorbowanego promieniowania dla roztworu nasyconego tlenem:
![]()
gdzie:
NA - Liczba Avogadro;
ρ - gęstość ładunku dozymetrycznego
G(OH) - wydajność reakcyjna anionorodników (SCN)-2
Ao - wartość absorbancji po zakończeniu impulsu
= 7,35.103 [1/(M.cm)]
![]()
[Gy]
Wyznaczam wartość stałej szybkości reakcji kr korzystając z równania kinetyki II rzędu uwzględniając prawo Lamberta-Beera:
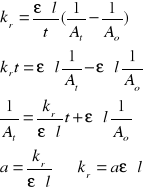
![]()
=325647.7,35.103.1 = 2,39.109 [(1/s)*(dm3/mol)]
Obliczam stosunek wskazań dozymetru fizycznego do wyznaczonej dawki w pojedyńczym impulsie:
![]()
DW- dawka wyznaczona na podstawie wykresu;
DF - dawka dozymetru fizycznego;
Wnioski:
W tym ćwiczeniu otrzymałem następujące wartości:
Ao = 0,13398
D = 62,56 [Gy]
kr = 2,39.109 [(1/s)*(dm3/mol)]
![]()
Stała szybkości reakcji jest bardzo duża co świadczy o dużej szybkości reakcji, a co z kolei wymaga stosowania układów impulsowych do pomiarów
Wyszukiwarka
Podobne podstrony:
Do druku askorbinowy, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczn
Do druku octowy, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz
Wprowadzenie do 44 ch fiz, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, Ch f, bon
mmgg, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II sprawka
spr57, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy
Moje 50 , Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II spr
monia 11, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II spr
15 wyznaczanie ciepła spalania, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, Chem
2011 info dla studentow sesja letnia OŚ, Studia PŁ, Ochrona Środowiska, Chemia, ogólna i nieorganicz
KOND41vmac, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II s
rad, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II sprawka
spr15, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy
Elektroda szklana, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna c
Podczas wymuszonego przep+éywu p+éynu, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wsz
27 poprawa 2, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, Chemia fizyczna
więcej podobnych podstron