1. Wewnętrzna budowa atomów. Równanie Shroedingera. Atom wodoru. Liczby kwantowe. Orbitale.
I. Wewnętrzna budowa atomów
Atom składa się z dodatnio naładowanego jądra, w którego skład wchodzą protony(+) i neutrony(0) i krążące po powłokach - elektrony(-). Protony określają liczbę atomową (Z) pierwiastka i jego rodzaj; liczba protonów = liczbie elektronów. Siły przyciągania elektrostatycznego utrzymują w równowadze układ jądro-elektrony. Własności fizyczne i chemiczne pierwiastków zależą wyłącznie od struktury powłok elektronowych , a nie od budowy ich jąder.
Model Rutheforda - cała masa atomu i jego ładunek są skupione w bardzo małej objętości o promieniu rzędu 10-12m. - jest to jądrowy model atomu. Model ten jest sprzeczny z elektrodynamiką wg której każdy ładunek poruszający się z przyspieszeniem powinien wypromieniowywać energię ale z elektronami tak nie jest. Atomy są stabilne, a widmo promieniowania ma charakter dyskretny a powinien wysyłać widmo ciągłe. Sprzeczności te usunął model Bohra - kwantowy model budowy atomu. Istotę tego modelu stanowią dwa postulaty:
-elektrony w atomie mogą krążyć tylko po pewnych dozwolonych orbitach, dla których moment pędu elektronu jest całkowita wielokrotność n, czyli mvr=n![]()
, gdzie m. - masa elektronu, v - jego prędkość, r - promień orbity elektronu, ![]()
- stała Planca. Elektron krążący po takiej orbicie nie promieniuje energii.
-atom może absorbować lub emitować promieniowanie w postaci kwantu energii E=![]()
v przechodząc z jednej orbity na drugą.
Model Bohra został zastąpiony nowym udoskonalonym modelem, w którym położenie elektronu w danej chwili czasu nie jest dokładnie określone lecz z pewnym prawdopodobieństwem. W opisie budowy atomu stosuje się metody mechaniki kwantowej.
II. Równanie Schroedingera
Pozwala odgadnąć postać funkcji falowej, która spełnia to równanie.
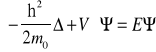
-operator Laplace'a
-gęstość prawdop znalezienia elektronu
=Y (y, p)R[r]
Wzór z uwzględnieniem czasu (pierwsza część równania zmierza do wyznaczenia energii i pędu).
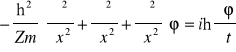
III. Liczby kwantowe
Liczby określające stan energetyczny elektronów.
Główna l.k. - może przybierać dowolne wartości naturalne n=1,2,3... i określa poziomy energetyczne elektronu.
Poboczna (dodatkowa lub azymutalna) - może przybierać wartości całkowite nieujemne l=0,1,2...,n-1 i określa energię związaną z orbitalnym ruchem elektronu dookoła jądra, jest miarą orbitalnego momentu pędu elektronu.
Magnetyczna l.k. - wyznacza orientację momentu magnetycznego elektronu względem linii sił zewnętrznych pola magnetycznego i może przybierać wartości całkowite od -L do L.
Spinowa l.k.- charakteryzuje spin czyli obrót elektronu dookoła własnej osi i może przybierać wartości s=+1/2 -1/2.
Wg zasady Pauliego dwa elektrony w atomie nie mogą mieć identycznych wartości wszystkich czterech liczb kwantowych.
IV. Orbitale
Orbital - obszar przestrzeni wokół jądra, na zewnątrz którego prawdopodobieństwo przebywania elektronu jest zaniedbywalnie małe. Orbitale o liczbie kwantowej L=0 oznacza się literą s, orbital L=1 literą p, orbital L=2 literą d, orbital L=3 literą f. Budowę powłoki elektronowej atomu w stanie podstaw otrzymujemy zapełniając orbitale stopniowo elektronami wg rosnącej energii wiązania. Orbitalowi można przypisać chmury elektronowe o różnym rozmieszczeniu kątowym w przestrzeni.
Rozróżniamy orbitale:
*wiążące - występują gdy spiny elektronów są przeciwne
*antywiążące - zgodne.
Wykres potencjału w zależności od odległości międzyatomowej.
2. Wiązania między atomami. Natura wiązań jonowych i kowalencyjnych. Przykłady.
I. Wiązania między atomami
Potencjał jonizacji I energia potrzebna do usunięcia elektronu z atomu w stanie gazowym.
Powinowactwo do elektronu E energia wydzielana w procesie przyłączania elektronu do atomu w stanie gazowym.
X* = 1/2 (I + E) elektroujemność
Wiązanie jonowe i kowalencyjne są wiązaniami konkurencyjnymi. O tym, który typ wiązania dominuje, decyduje bezwzględna wartość różnicy elektroujemności
jonowe
kowalencyjne
pół na pół
II. Jonowe - międzyatomowe wiązania elektrostatyczne utworzone w wyniku całkowitego przejścia elektronów walencyjnych od atomu mniej elektroujemnego (jon dodatni kation) do atomu bardziej elektroujemnego (jon ujemny anion). Są bezkierunkowe, silne, o dużej trwałości termicznej. Zwiększenie siły wiązania powoduje zwiększenie twardości, temp topnienia i zmniejszenie współcz rozszerzalności cieplnej. Pod względem elektrycznym są umiarkowanymi izolatorami. Pierwiastki z gr. I, II, VI i VII
Li+, Na+, K+, Rb+, Cs+, F-, Cl-, Br-, I-
Na + Cl -> Na+ + Cl
Ca+ O -> Ca2+ + O 2-
III. Kowalencyjne (atomowe) - międzyatomowe wiązanie nieelektrostatyczne utworzone przez uwspólnienie (sparowanie) elektronów pochodzących z obu atomów o zbliżonej elektroujemności i utworzenie pomiędzy nimi 1,2 lub 3 par elektronów wiążących. Wiązanie to jest silnie skierowane w określonych kierunkach. Związki są łatwo lotne i zestalają się w niskich temp tworząc krystaliczną sieć cząsteczkową. Ciała mają dużą twardość, wysoką temp. topnienia, mały współczynnik rozszerzalności cieplnej, są one izolatorami.
H H +H -> H H, H H
Cl2, O2,
N2N + N -> N N, N N
Metaliczne - wiązanie międzyatomowe wynikające z elektrodynamicznego oddziaływania elektroujemnego gazu elektronowego, utworzonego przez wszystkie elektrony walencyjne pierwiastka metalicznego na elektrododatnią jonową sieć krystaliczną, której węzły obsadzają wszystkie jony tego metalu. Wiązania nie mają charakteru kierunkowego. Ciała dobrze przewodzą elektryczność i ciepło, są plastyczne. Cu, Mg, W.
Kowalencyjne spolaryzowane - najprostsze międzyatomowe wiązanie pośrednie między kowalencyjnymi a jonowymi. Między atomami różniącymi się elektroujemnością (znacznie do 2,1). Wiążąca para elektronowa jest przesunięta w kierunku bardziej elektroujemnego atomu. HF
Koordynacyjne - odmiana międzyatomowego wiązania kowalencyjnego spolaryzowanego. Tworząca się w związkach koordynacyjnych i kompleksowych kosztem wolnej pary elektronowej pochodzącej tylko od jednego z łączących się atomów.
H3NBF3
Wodorowe - międzycząsteczkowe lub wewnątrzcząsteczkowe wiązania elektrostatyczne tworzone przez protony H+ z silnie elektroujemnymi pierwiastkami i powodujące asocjację pojedyńczych cząsteczek w większe agregaty.
Wiązania siłami Van Der Waalsa - słabe nieelektrostatyczne wiązania międzycząsteczkowe, w którym uczestniczą trwałe lub indukowane dipole. Dipol - cząsteczki obdarzone biegunowością spowodowaną asymetrycznym rozmieszczeniem ich ładunków elektrycznych. Wiązania słabe, ciała mają małą twardość i niskie temperatury topnienia, duże współczynniki rozszerzalności cieplnej. Zw. organiczne
3. Struktura diamentu, grafitu i sfalerytu. Porównać właściwości grafitu i diamentu.
I. Diament jest jedną spośród kilku krystalicznych odmian węgla. Struktura diamentu: każdy z atomów węgla tworzy po cztery wiązania kowalencyjne (kierunkowe) o kątach między nimi 109028'. Stopień wypełnienia 34%. Ma najczęściej postać ośmiościanu, dwunastościanu rombowego lub sześcianu. Występują w formie mono- lub polikrystalicznej. Jest chemicznie obojętny i wykazuje bdb przewodnictwo cieplne. Odznacza się wysokim wsp. załamania światła, jest dobrym izolatorem. Wykorzystywany do narzędzi skrawających i ściernych, proszek otrzymuje się z obróbki większych. Bezbarwny, błękitny lub niebieski, żółty, brunatny do czarnego. Połysk silny, diamentowy, kruchy, odporny na działanie kwasów, spala się w wysokich temp, odporny na działanie czynników atmosferycznych, ma własności półprzewodnikowe.
II. Grafit - na komórkę przypadają 4 atomy. Stopień wypełnienia 17%. Wiązania w sieci grafitu są niejednakowe, trzy elektrony łączą się z trzema elektronami tworząc o wiele silniejsze wiązania niż w diamencie. Czwarty elektron znajduje się w rezonansie tworząc wiązanie podwójne, dotyczy to wiązania z atomami - jest długie i dlatego słabe podobne do wiązania molekularnego. Przewodzi elektryczność, spala się bardzo trudno w strumieniu tlenu, topi się w łuku elektrycznym, w kwasach nierozpuszczalny. Barwa stalowoszara, połysk zbliżony do metalicznego, nieprzeźroczysty, tłusty, krystalizuje w ukł. heksagonalnym, tworzy warstwy które łatwo mogą przesuwać się względem siebie.
III. Sfaleryt - ZnS - blenda cynkowa, układ regularny, kryształy najczęściej czworościenne, częste bliźniaki. Tworzą skupienia zbite, ziarniste. Brunatny, często czarny, połysk diamentowy, kruchy. Fosforyzuje przy tarciu, rozbijaniu, rozpuszczalny w stężonym HNO3.
.Struktura pasmowa półprzewodników. Półprzewodniki samoistne i domieszkowe.
I. Struktura pasmowa półprzewodników
pasmo:
dozwolone
puste
zabronione
dozwolone
zapełnione
półprzewodnik
Najwyższe pasmo energetyczne zawierające elektrony tak zwane pasmo walencyjne, jest całkowicie zapełnione, ale przerwa energetyczna Eg między ostatnim pasmem zapełnionym i następnym dozwolonym jest mała. Dzięki temu małe dawki energii związane z np. ogrzaniem, naświetlaniem itp. wystarczają do przeniesienia elektronów z pasma walencyjnego do pasma wyższego, zwanego pasmem przewodnictwa.
swobodne
elektrony
poziom akceptorowy
Ef
poziom Ef
donorowy
dziury
W półprzewodniku typu n (w temp. TK) najbliższymi poziomami energetycznymi, w których braki i nadwyżki elektronów mogą być porównywane są: poziom donorowy i poziom bardzo bliski dolnej granicy pasma przewodnictwa. Poziom Fermiego leży więc mniej więcej w połowie odległości wspomnianych poziomów, ogólnie biorąc stosunkowo blisko dolnej granicy pasma przewodnictwa.
W półprzewodniku typu p nadwyżki występują w poziomie akceptorowym, braki zaś w pobliżu górnej granicy pasma walencyjnego (tam gdzie pojawiły się dziury). A zatem poziom Fermiego przypada mniej więcej w połowie odległości wspomnianych poziomów .
W półprzewodniku samoistnym poziom odpowiadający górnej granicy pasma walencyjnego jest w 100% obsadzony, a odpowiadający dolnej granicy pasma przewodnictwa jest w 100% nieobsadzony w temp.zera bezwzględnego. A zatem poziom Fermiego w półprzewodniku samoistnym leży dokładnie w środku przerwy energetycznej Eg .
4. Struktury diamentopodobne i właściwości materiałów półprzewodnikowych o takich strukturach.
I. Struktury diamentopodobne
Podstaw grupą półprzewodników są monokryształy i warstwy krzemu oraz związki pierwiastków III i V grupy ukł okresowego, GaAs, GaP, PbTe. Krystaliczny krzem ma strukturę diamentu a pozostałe wymienione związki krystalizują w większości w strukturę sfalerytu, która wywodzi się ze struktury diamentu, z tym że węzły sieci obsadzone są na przemian pierwiastkami grupy III i V. Kryształy mieszane GaxIn1-xAs, GaPxAs1-x łatwo tworzą struktury diamentopodobne.
II. Węglik krzemu SiC (karborund) - ma wysoką twardość, jest kruchy, wykazuje dużą stabilność termiczną, nie ulega stopieniu a sublimacji. Zachowuje swoje właściwości w podwyższonych temp. odznacza się wysoką odpornością na działanie czynników chemicznych. Nie reaguje z kwasami, wykazuje pewną wrażliwość na działanie zasad. Posiada właściwości półprzewodnikowe.W przyrodzie nie występuje. Otrzymuje się go z: SiO2 + 3C → SiC + 2CO
Krzem w postaci czystej nie występuje, SiO2 - krzemionka w piasku:
SiO2 + 2Mg → Si + 2MgO + ↑O
3SiO2 + 4Al → 3Si + 2Al2O3 + ↑O
German - występuje w przyrodzie w postaci czystej, metaliczny połysk, jest dość twardy ale kruchy, źle przewodzi prąd. Odporny na działanie tlenu oraz rozcieńczonych kwasów i zasad. Ulega działaniu chloru, bromu, kwasu azotowego, kwasu siarkowego. Stosowany w elektronice tranzystorowej (diody, prostowniki, termistory, itd.)
Węgliki spiekane - spieki otrzym z proszków węglików W, T, Mo, Tantalu, V.
WO3 + 4C -> WC + 3CO
7. Kwarc. Polimorfizm kwarcu. Zastosowanie kwarcu. Krzemiany.
I.Kwarc. II. Zastosowanie.
SiO2 - minerał. W przyrodzie występuje jego odmiana α, Trwały w niskich temp. trygonalna.
Polimorfizm - wielopostaciowość. Polimorficznymi odmianami kwarcu są trydymity (,,γ i krystobulity (,. Kryształy słupowe, rzadziej bipiramidalne i tabliczkowe, rozróżnia się kwarce prawe i lewe. Bardzo częste są bliźniaki: delfinackie, brazylijskie, japońskie. Najbardziej rozpowszechnione są odmiany bezbarwne, mlecznobiałe i szare. Do przeźroczystych i półprzeźroczystych należą kryształ górski, ametyst, cytryn, chalcedon, agaty i onyksy. Połysk kwarcu jest szklisty. Przepuszcza promieniowanie nadfioletowe. Reaguje tylko z HF. Przeźroczyste, zabarwione odmiany kwarcu stosowane jako kamienie półszlachetne, używane jako szkło kwarcowe optyczne do budowy przyrządów optycznych w radiotechnice i elektronice, w mechanice precyzyjnej. Ze stopionego kwarcu produkuje się naczynia laboratoryjne, aparaturę chemiczną, lampy kwarcowe. Piaski lub kruszywo kwarcowe, stosowane w przemyśle szklarskim, ceramicznym, do kwarcytowych materiałów ogniotrwałych.
III. Krzemiany - sole powstałe przez połączenie dwutlenku krzemu SiO2 z tlenkami metali. Stosunek SiO2 do tlenku w krzemianach może być różny i wskazuje że sole te wywodzą się nie tylko od prostych kwasów meta - H2SiO3 i orto - H4SiO4, ale od kwasów polikrzemowych. Główny motyw strukturalny to czworościan.
Grupy strukturalne to: krzemiany wyspowe, grupowe, łańcuchowe, pasmowe (wstęgowe) i warstwowe.
8. Perowskit. Przyczyny ferromagnetycznych właściwości tytanianu baru. Przemiany fazowe w barze.
Perowskit
Minerał, tytanian wapnia, CaTiO3, barwy od szarej do żółtobrunatnej i czarnej o połysku diamentowym, krystalizuje w układzie regularnym, twardość 5,5. Występuje w skałach magmowych i metamorficznych bogatych w wapń i tytan a ubogich w krzemionkę.
Tytanian baru otrzymuje się:
BaCO3 + TiO2 → BaTiO3 + CO2↑
II. Przyczyny ferroelektrycznych właściwości BaTiO3:
- wykazuje własności stanu ferroelektrycznego,
- występowanie domen - obszarów o jednakowej polaryzacji w kryształach,
- orientacje domen pod wpływem zewnętrznego pola elektrycznego,
- histereza elektryczna i zależność przenikalności elektrycznej od natężenia pola,
- zanik własności ferroelektrycznych w temp. Curie,
- charakterystyczna zależność: przenikalności od temp. spełnienie prawa Curie-Weissa dla temp. wyższych od temp. Curie.
Stan ferroelektryczny - wiąże się z określoną strukturą krystaliczną a jego zanik - z przemianą fazową do struktury o wyższym stopniu symetrii.
Struktura typu perowskitu - struktura CaTiO3 - tytanian wapnia, w przyrodzie występuje jako minerał, ma strukturę podobną do BaTiO3, PbZrO3.Przemiany fazowe BaTiO3.
III. Tytanian baru jest przedstawicielem związków typu ABO3 o strukturze perowskitu (struktura kryształu jonowego BaTiO3, w temp. powyżej temp. Curie ma symetrię układu regularnego (sześcian)). Ba2+ w narożach, O2- na środkach ścian, Ti4+na środku sześcianu. Podczas ochładzania BaTiO3 ulega deformacji Ba2+, Ti4+ przesuwają się w jednym kierunku względem O2- a górne i dolne jony przesuwają się w kierunku przeciwnym. W wyniku tej deformacji w komórce krystalicznej wytwarza się elektryczny moment dipolowy i zmienia się symetria układu z regularnego na trygonalny.
9. Spinel. Ferryty o strukturze spinelu. Zastosowania ferrytów.
I. Spinel. Ferryty o strukturze spinelu.
Spinele - grupa minerałów o wzorze ogólnym (Mg,Fe2+, Zn, Be ...)(Al., Fe3+, Cr)O4. Pierwiastki dwuwartościowe z wyjątkiem Ba, podobnie jak pierwiastki trójwartościowe mogą zastępować się wzajemnie w szerokich granicach. Stąd uwzględniając domieszki duża zmienność składu chemicznego. Wyróżnia się spinele glinowe (najważniejsze: spinel zwykły, galnit, hercynit) i spinele żelazowe (magnetyt, franklinit), spinele chromowe oraz tytanowe.
Spinel zwykły MgAl2O4 - nie jest ferrytem. Liczne odmiany, układ regularny, kryształy ośmiościenne, często bliźniacze. Tworzy skupienia zwięzłe, ziarniste. Przeźroczysty bezbarwny lub czerwony, różowy, zielony, niebieski, fioletowy. Połysk szklisty, trudno topliwy (21500 C).
Galnit - ZnAl2O4, hercynit FeAl2O4. Odporne na działanie czynników atmosferycznych. Przeźroczyste spinele pozbawione skaz używane jako kamienie szlachetne, w mechanice precyzyjnej na łożyska.
Spinel zwykły ma domieszki: FeO,Fe2O3, ZnO, MnO, Cr2O3, Na2O, K2O, CaO, TiO2, CuO, NiO, CoO, SnO2.
Spinele chromowe - grupa minerałów o wzorze ogólnym (Mg,Fe)(Cr,Al.,Fe)2O4 zawierają 18-62% Cr2O3, 0-18% FeO, 6-16% MgO, 0-33% Al2O3, 2-30% Fe2O3. W zależności od składu chemicznego wyróżnia się chromit właściwy FeCr2O4, rzadko spotykany chromit magnezowy (MgFe)Cr2O4, chromit glinowy Fe(CrAl)2O4. Układ regularny. Czarny, na ogół nieprzeźroczysty, połysk zbliżony do metalicznego. Odmiany zawierające FeO, Fe2O3 mają własności paramagnetyczne. Występują prawie wyłącznie w ultrazasadowych skałach magmowych, są głównymi rudami chromu.
II. Ferryty - łączą własności magnetyczne z własnościami izolatorów. Nie płyną w nich prądy wirowe. Nadają się do pracy na wysokich częstotliwościach - robienie cewek, anten i transformatorów. Większość ferrytów ma strukturę spinelu Fe3O4, MgFe2O4, CoFe2O4, NiFe2O4, CuFe2O4, ZnFe2O4, MnCo2O4, LiFe5O8.
III. Zastosowanie ferrytów:
magnetycznie miękkie - technika stałoprądowa:
-rdzenie pamięciowe, transformatory impulsowe, wzmacniacze magnetyczne, przekaźniki szybko działające, rdzenie do transformatorów telekomunikacyjny do średnich częstotliwości, rdzenie cewkowe, pręty antenowe, głowice magnetofonowe.magnetycznie twarde - technika słabo i silnoprądowa:
-silniki, prądnice, przekaźniki, przyrządy akustyczne, urządzenia sygnalizujące, magnesy skupiające.
10. Defekty struktury krystalicznej i ich wpływ na właściwości materiałów.
I. Defekty kryształów i ich podział:
*elektronowe
*atomowe:
Punktowe - powstają w wyniku:
-braku atomu w pozycji przewidzianej budową idealną (wakans),
-obecnością atomu w pozycji nieprzewidzianej budową idealną, przy czym jest to atom wchodzący w skład chemiczny danej struktury. (atomy międzywęzłowe)
Defekty te są w równowadze termicznej.
Defekt Schottky'ego - brak w strukturze kationu i anionu, podwójne zaburzenie sieci.
Defekt Frankla - brak we właściwym miejscu kationu lub anionu, który został przesunięty w pozycję międzywęzłową.
Ruch defektów - migracja defektów odbywa się przez przechodzenie atomu w trakcie oscylacji z pozycji węzłowych w położenie wakansów lub luk. Proces migracji wymaga pewnej energii zwanej enrgią aktywacji migracji.
Dyslokacje - defekty liniowe - zaburzenia sieci rozmieszczone wzdłuż linii - defekty jednowymiarowe - dyslokacje można traktować jako granice pomiędzy dwoma płaskimi monokryształami.
Przesunięcie - poślizg. Dyslokacja może mieć charakter zamkniętej pętli leżącej wewnątrz monokryształu i nosi nazwę pętli dyslokacji. Dyslokacje śrubowe, krawędziowe.
Dyslokacje określa się dwoma wektorami:
- t - określa kierunek linii dyslokacji w danym punkcie pętli jest on równoległy do linii dyslokacji.
- b - wektor Burgersa - wektor przesunięcia - określa wielkość i kierunek przesunięcia atomów sieci leżących powyżej płaszczyzny poślizgu w stosunku do atomów leżących poniżej płaszczyzny.
Defekty płaszczyznowe - powierzchniowe - mają charakter zaburzeń dwuwymiarowych.
- granice wąskokątowe - wartość kąta dezorientacji bloków - kilka sekund do kilku minut, małe uporządkowanie dalekiego zasięgu, nieco mniejsze uporządkowanie bliskiego zasięgu, są uformaowane przez zespół dyslokacji.
- granice szerokokątowe - granice między ziarnami zorientowanymi powyżej kilku stopni 80 - 100 są charakterystyczne dla ciał polikrystalicznych.
-granice bliźniacze - dwa monokryształy tej samej substancji zrośnięte ze sobą tak, że sieć jednego z nich może być przetransformowana w sieć drugiego przez przekształcenia symetryczne - bliźniaki odbicia, obrotu lub inwersji występują w minerałach, a w metalach bliźniaki wzrostu, przemiany, odkształcenia.
Błędy ułożenia - powstają wskutek zaburzeń w sekwencji ułożenia płaszczyzn atomowych.
Granice domen antyfazowych - błędy wynikające z zajmowania pozycji idealnych przez niewłaściwy atom.
Istnienie kryształu bez defektu możliwe jest tylko w temp. 0 bezwzględnego. W temp. wyższych musi wystąpić pewna liczba defektów, których ilość wyraża się:
![]()
- defekty samoistne Możemy także wprowadzić defekty w procesie powstawania kryształu np. domieszek w półprzewodnikach.
11. Materiały bezpostaciowe i quasikrystaliczne.
I. Materiały bezpostaciowe i quasikrystaliczne.
Ciała pozbawione prawidłowej krystalicznej budowy wewnętrznej i wynikających z niej charakterystycznych własnościach anizotropowych. Charakteryzują się brakiem określonej temp. topnienia i ciągłą zmianą własności ze zmianą temp. zarówno podczas ogrzewania jak i chłodzenia. Należą do nich: szkła; amorficzne półprzewodniki; amorficzne metale ( istnieje tylko uporządkowanie bliskiego zasięgu a nie ma dalekiego).
Szkła otrzymujemy gdy podczas chłodzenia współczynnik lepkości materiału gwałtownie rośnie do nieskończoności.
Grupy szkieł:
- szkło sodowo wapienne (szkło gospodarcze),
- szkło potasowe (droższe szlachetniejsze),
- szkło ołowiowe (szkła optyczne)
- szkło barowo krzemowe (naczynia laboratoryjne),
- szkło kwarcowe (bardzo duża odporność termiczna, lampy)
- szkło klejone (motoryzacja)
- szkło zbrojone
Optoelektronika (zupełnie inne właściwości optyczne). Półprzewodniki amorficzne wykorzystuje się w optyce, są przeźroczyste w widmie długofalowym (podczerwień); lampy obrazowe (łączą duży opór i duże fotoprzewodnictwo). Istnieje możliwość stymulowania rozpuszczalności czynnikami zewnętrznymi.
Materiały quasikrystaliczne:
Polimery (długie łańcuchy węglowe)
Ciała stałe superjonowe
Ciekłe kryształy (w niekiedy zachowują się jak ciecze)
12. Fazy, reguła faz.
I. II. Faza - część układu równowagi , jednorodna pod względem fizycznym, oddzielona od pozostałej jego części powierzchnią rozdziału, przy przekraczaniu której stan termodynamiczny ciała, skład chemiczny lub budowa zmieniają się w sposób nieciągły (skokowy).
Układy jednofazowe nazywamy jednorodnymi, układu dwu i wielofazowe - niejednorodnymi. Dwie odmiany alotropowe tego samego pierwiastka uważa się za dwie różne fazy. Roztwór stanowi jedną fazę, w zakresie składu zmieniającego się w sposób ciągły.
W układach równowagi może występować kilka faz, oznacza się je literami greckimi α, β, γ.
Zasady konstrukcji diagramów fazowych:
S=0 ⇒ układ niezmienny, jego równowaga może istnieć tylko przy pewnej stałej temp. i przy określonym składzie faz (na diagramie punkt)
S=1 ⇒ układ jednozmienny i bez naruszenia jego równowagi można w nim zmieniać w pewnych granicach temp .lub skład ale tylko jednej fazy (na diagramie linia)
S=2 ⇒ układ dwuzmienny bez naruszania równowagi układu można w nim zmieniać dowolnie (w pewnych granicach) temp. i skład 1 fazy lub skład 2 faz lecz bez zmiany temp. (na diagramie płaszczyzna)
S=3 ⇒ na diagramie element objętości, Wykres równowagi jest przestrzenny, dwie osie wartości i jedna temp.
Wyróżnia się cztery rodzaje układów:
*układ z nieograniczoną rozpuszczalnością w stanie stałym (układ równowagi fazowej)
*układ równowagi fazowej z eutektyką (brak możliwości rozpuszczenia A w B, tworzą pierwiastki różniące się właściwościami)
*układ z ograniczoną rozpuszczalnością w stanie stałym i eutektyką (tworzą pierwiastki krystalizujące w różnych układach bądź tych samych ale różnią się wielkością atomów więcej niż 15%)
*układ z perytektyką (tworzą pierwiastki krystalizujące w różnych układach lub tych samych ale różnią się wielkością ziaren więcej niż 15%)
Reguła faz Gibbsa - w określonych warunkach termodynamicznych skład fazowy (ilościowy stosunek między fazami) pozostaje stały.
S = n - f +1 (S - ilość stopni swobody, n - ilość składników niezależnych, f - ilość faz współistniejących).
13. Materiały wielofazowe. Przykłady materiałów wielofazowych innych niż ceramika.
I. Materiały wielofazowe
- stanowią kompozycję wielu faz. Są to fazy chemiczne, różniące się składem. Wyróżniamy materiał osnowy i materiał wewnątrz osnowy (ma on za zadanie zmieniać właściwości fizyczne osnowy). Jest to sztucznie stworzona kompozycja materiału. Materiał kompozytowy ma inne właściwości niż poszczególne składniki.
Układ - zapełniona materią część przestrzeni, resztę stanowi materia nazywana środowiskiem. Układ może być heterogeniczny (niejednorodny) lub homogeniczny (jednorodny).
Faza - określony homogeniczny element objętości o jemu właściwych wartościach entalpii swobody.
Liczba niezależnych składników - najmniejsza liczba rodzajów substancji z których można zbudować chemicznie dany układ.
Liczba niezależnych zmiennych - liczba zmiennych intensywnych, które nie muszą być ściśle określone tzn. można je zmieniać w pewnym zakresie nie powodując zmian fazowych - liczba stopni swobody s.
Przykłady materiałów wielofazowych innych niż ceramika:
*materiały ceramiczno-metaliczne - cermetale - stanowią zazwyczaj połączenie dobrze przewodzącego cieplnie i elektrycznie składnika metalicznego i izolatora jakim jest składnik ceramiczny - dobre cechy metali, brak złych ceramiki.
*materiały porowate - materiały, w których drugą fazą jest gaz zawarty w porach. Stos są jako filtry, cieplne materiały izolacyjne i powłoki ciepłochronne, do izolacji dźwiękowej. Wytwarzane są przez prasowanie i spiekanie. Wyróżnia się:
*ziarniste - stosunkowo dobra odporność na naprężenia cieplne i małe przewodnictwo cieplne przy niezbyt wysokich wymaganiach co do wytrzymałości mechanicznej. W rzeczywistych materiałach ziarnistych muszą występować obszary o różnym ułożeniu ziaren, od luźnego do najgęstszego piramidalnego lub tetraedrycznego.
*komórkowe - otrzymuje się przez wprowadzenie do materiału wypalających się dodatków. Mają małą wytrzymałość mechaniczną i odporność na pełzanie (lub pękanie) w podwyższonych temp.
*piankowe - trudno topliwe substancje ceramiczne w toku ich wypalania wydzielają się małym przewodnictwem cieplnym, dobrymi właściwościami mechanicznymi. Istnieją także materiały piankowe wytwarzane z mikrosfer, tworzących się w lotnych popiołach z elektrowni węglowych.
*wielofazowe materiały kombinowane - kompozyty - materiał makroskopowy monolityczny, dla otrzymania którego połączono komponenty (fazy) o różnych właściwościach, wyższych lub dodatkowych w stosunku do komponentów wziętych osobno. Rodzaje kompozytów:
a. materiał wzmocniony dyspersyjnie - materiał taki składa się ze stałej osnowy, w której równomiernie rozprowadzone są drobne, izomeryczne cząstki innej fazy, wytwarzane są w oparciu o osnowy metaliczne. Cząstki te zapobiegają ruchowi dyslokacji w plastycznej osnowie metalicznej, przez co mają większą sztywność w podwyższonych temperaturach.
b. materiał wzmocniony długimi włóknami,
c. materiał wzmocniony krótkimi włóknami lub wiskerami,
Osnowa spełnia rolę środka przenoszącego naprężenia mechaniczne na włókna. Włókna to twory o wysokiej wytrzymałości mechanicznej oraz dużej sztywności. Nadają się do lekkich, cienkościennych konstrukcji w lotnictwie, kosmonautyce, przemyśle samochodowym, sportowym, przy budowie zbiorników. Rodzaje:
*kompozyty o osnowie z polimerów organicznych wzmacniane włóknami szklanymi i węglowymi,
*kompozyty o osnowie z pirowęgla lub pirografitu wzmacniane włóknami węglowymi,
*kompozyty o osnowie ze szkła lub materiałów krystalicznych wzmacniane włóknami polikrystalicznymi SiC,
*kompozyty o osnowie z aluminium lub tytanu wzmacniane włóknami węglowymi lub B - SiC.
d.materiał o zmodyfikowanej warstwie wierzchniej - wykorzystując dobre własności materiału podstawowego, uzyskuje się zmianę właściwości jego powierzchni, zapewniającą większą odporność chemiczną czy mechaniczną.
14. Rola materiałów ceramicznych w technice. Różne grupy materiałów ceramicznych.
I. Materiały ceramiczne - tworzywa ceramiczne wytwarzane z proszków takich zw. chem. (pochodzenia mineralnego) jak tlenki, krzemiany, glinokrzemiany, tytaniany, fluorki przez wyżarzanie (spiekanie) ich w wysokiej temp. Po wypiekaniu uzyskany materiał jest wytrzymały mechanicznie, ma budowę zwartą lecz niejednorodną. W materiałach ceramicznych można wyróżnić trzy główne fazy: krystaliczną, bezpostaciową - szklistą i pory. Brak jednorodności fizycznej oraz porowatość, która zależy od stopnia spieczenia, mają wpływ na własności fiz.
Materiały ceramicze - charakteryzują się dużą twardością, wys. temp. topnienia, kruchością, dużą wytrzymałością na ściskanie. Materiały ceramiczne:
*ceramika stołowa
*ceramika sanitarna
*ceramika kwasoodporna (naczynia laboratoryjne, części urządzeń chemicznych)
*ceramiczne materiały ogniotrwałe
*ceramika specjalna (dla celów biologicznych - inplanty, dla techniki jądrowej, dla celów kosmicznych)
*wyroby ścierne i odporne na ścieranie (narzędzia, elementy silników)
*elektroceramika
-ceramika elektrotechniczna (kolatory wysokiego napięcia)
-ceramika dla elektroniki (elementy bierna R,C, piezoelektryki, optoelektroniki)
-elektrotermiczna ceramika (elementy grzejne, izolacyjne)
Grupy ceramik.
Ceramika dla elektroniki.
Ceramiczne dielektryki do produkcji kondensatorów ceramicznych:
*z dielektrykiem gazowym
*z dielektrykiem ciekłym
*z dielektrykiem stałym nieograniczonym (szklane, szklano-ceramiczne, ceramiczne)
*z dielektrykiem stałym ograniczonym
Kondensatory ceramiczne:
*o zmiennej pojemności
*o stałej pojemności (typu I i II)
*o ustalonej pojemności w zależności od napięcia
*inne typu III
O tym czy kondensator zaliczamy do typu I czy II decyduje temperaturowy współczynnik pojemności TWP.
![]()
C85 - w temp. 850C; C25 - w temp. 250C; typ I - TWP małe; typ II - TWP duże.
Piezoceramika - używane w praktyce to:
*monokryształy kwarc, nioban litu LiNbO3
*półprzewodniki siarczek kadmu, siarczek cynku
*piezoceramika
Zastosowanie: wzorcowe częstotliwości, przetworniki dużych energii (zapalarki gazowe), filtry, dyskryminatory, rezonatory, eliminatory, np. dyskryminatory - przepuszczają pewien zakres częstotliwości a pozostały wycinają.
Wysokotemperaturowe nadprzewodniki HTS
Elektromagnesy, tomografy, silniki, prądnice, kable przesyłowe lini energetycznych, najszybsze elementy bramkujące, elementy pamięciowe.
Ceramiczne półprzewodniki.
*NTC - do stabilizacji punktów pracy tranzystorów.
*PTC -regulacja automatycznego rozmagnesowania kineskopu telewizora oraz układy rozruchowe silników
Ceramika Elektrotermiczna
Elementy grzejne pieców (sility) w kształcie prętów
Mat. ścierne i odporne na ścieranie
*narzędzia ścierne (ziarna ścierne związane są spoiwem ceramicznym; diament, elektrokorund, węglik krzemu)
*elementy silników samochodowych, wysokoprężnych turbin (denka tłoków, gładzie cylindrów)
15. Ceramika stołowa. Reakcje podczas wypalania czerepu porcelany.
I Ceramika stołowa - porcelana wyrabiana z kwarcu, kadinitu, skaleni.
Wypalanie porcelany:
2[Al.2O3*2SiO2*2H2O] →
1 : 2 kadinit
(I etap) 2 Al2O3*4SiO3 + 4H2O
metakadinit wydzielanie wody
↓
(II etap) 2Al2O3*3SiO2 + SiO2 tlenek krzemu
(III etap) wytwarza się mulit 3:2 skład
I - do 500 0C - suszenie - powstaje metakadinit, wydzielanie wody
II - do 900 0C - rozkład kadinitu na tlenki
III - powyżej 1200 0C - skaleń mięknie (jest w fazie ciekłej) zaczyna wyrastać kryształ mulitu (igłowy kryształ)
Porcelana - tworzywo ceramiczne o czerepie spieczonym białym, nieprzepuszczalnym dla wody i gazów, przeświecający w cienkich warstwach. Porcelana twarda - jest spiekana w temp. ok. 1400 0C zawiera 50% kadinu, 25% kwarcu, 25% skalenia. Porcelana miękka posiada więcej skalenia, niższa temp. spiekania i wypalania, stosuje się więcej barwników podszkliwnych. Porcelana twarda - izolatory i wyroby do celów elektrotechnicznych oraz sprzęt laboratoryjny. Porcelana miękka - p. kostna, skaleniowa używana do celów artystycznych.
Porcelana stołowa - twarda lub miękka. Wypalanie przeprowadza się dwukrotnie - pierwszy raz na biskwit w temp. niższej i drugi raz ze szkliwem.
17. Materiały ceramiczne ogniotrwałe i ich znaczenie w przemyśle hutniczym. Kryteria podziału.
I. Materiały ceramiczne ogniotrwałe Wykazują odporność na długotrwałe działanie wysokich temp, ich zmiany oraz na czynniki mechaniczne i chemiczne; odporność na wstrząsy cieplne, stałość objętości w temp. pracy; odporność na działanie korozyjne różnych czynników.
Kryteria podziału.
Podział ze względu na ogniotrwałość 1500-1700 0C:
*ogniotrwałość zwykła (stożek pirometryczny SP w st. C)
*wysokoogniotrwałe 1770-2000 0C
*o najwyższej ogniotrwałości >2000 0C
Podział wg technologii: produkowane z mas:
*plastycznych
*sypkich
*lejnych
*termoplastycznych
*prasowane na gorąco
Podział w/g obróbki cieplnej:
*niewypalane
*obrabiane cieplnie - suszone
*wypalane
*topiono - odlewane
Podział wg porowatości:
*szczególnie zwarte - porowatość otwarta do 3%
*wysoko zwarte
*zwarte
*o niskiej zwartości - porowatość powyżej 45%
Podział wg składu chemicznego:
*glinokrzemianowe (krzemionkowe, kwarcowo-szamotowe, szamotowe, wysokoglinowe, korundowe, sylikonitowe)
*zasadowe (tlenki Mg i Ca, magnezytowe, magnetyzowo-chronitowe, chronitowo-magnetyzowe, chronitowe)
*inne (karborundowe, cyrkonowe, materiały izolacyjne)
18. Elektroceramika. Ceramika dla elektrotechniki. Dialektyki ceramiczne.
II. Ceramika dla elektrotechniki.
*izolatory wysokiego napięcia WN (liniowe, pniowe, wiszące, wsporcze, przepustowe)
*porcelana elektrotechnicznie twarda (otrzymywana ze skaleni, kwarców, korundu, kadinitu, steatyt)
Steatyt - ceramika oparta na krzemianie magnezowym talku, magnezytu, gliny. Ma bardzo dobre własności elektryczne, małą stratność, dużą wytrzymałość elektryczną. Może być stosowany w dość wysokiej temperaturze i w wielkich częstotliwościach. Jest natomiast krucha i nieodporna na wstrząsy cieplne. Stosowany do produkcji elementów izolacyjnych, konstrukcyjnych, w podzespołach i zespołach radiotechniki pracujących w stałej temp. w wielkich częstotliwościach, pod wysokimi napięciami. Wysokiej klasy steatyt stosowany jest jako dielektryk ceramiczny typu I.
Porcelana elektrotechniczna - rodzaj porcelany twardej o dokładnie spieczonym czerepie koloru białego lub białego z odcieniem kremowym. W skład masy wchodzą kadiny z domieszką gliny plastycznej, drobno zmielony kwarc, skaleń. Czynnikiem mającym duży wpływ na własności elektryczne porcelany jest zawartość K2O, Na2O w skaleniu (większą rezystywność uzyskuje się przy mniejszej zawartości Na2O). Z porcelany elektrotechnicznej produkuje się izolatory nisko i wysokonapięciowe dla prądów małej częstotliwości.
III. Dielektryki ceramiczne - grupa materiałów których wspólną cechą jest ich struktura polikrystaliczna uzyskana przez spieczenie proszków. Popularnie pod pojęciem dielektryków ceramicznych rozumie się materiały elektroizolacyjne ceramiczne. Mają dużą wytrzymałość elektryczną, duży opór właściwy (rezystancję), mały wsp. strat dielektrycznych, różną przenikalność elektryczną, dużą wytrzymałość mechaniczną, dużą trwałość i dużą ogniotrwałość zwykłą.
Zależnie od właściwości fizycznych odpowiadających przeznaczeniu do różnych wyrobów dielektryki ceramiczne dzieli się na dielektryki I i II typu.
a. Dielektryki ceramiczne I typu - grupa elektroizolacyjnych materiałów ceramicznych. Odznaczają się liniową zależnością polaryzacji od natężenia pola elektrycznego tzw. Dielektryki liniowe, nie wykazują histerezy elektrycznej. Oparte są na ceramicznych materiałach paraelektrycznych o przenikalności elektrycznej poniżej 200. Jest to ceramika tytanianowapniowa, rutylowa, tytanianu magnezu, ceramika steatytowa. Stosowany jako dielektryk w kondensatorach niskonapięciowych o mocy biernej do 200 W, w obwodach rezonansowych, do kompensacji cieplnej obwodów radiotechnicznych oraz do kondensatorów wysokonapięciowych kondensatorów mocy, impulsowych o małych pojemnościach.
b. Dielektryki ceramiczne II typu - odznaczają się nieliniową zależnością polaryzacji od natężenia pola elektrycznego - dielektryki nieliniowe. Oparte są na materiałach ferroelektrycznych o dużej przenikalności elektrycznej. Zawierają domieszki pozwalające uzyskać najbardziej płaski przebieg funkcji ε = f(T), mniejszą stratność, większą rezystywność, większą wytrzymałość elektryczną, lepsze własności technologiczne. Dielektryki te klasyfikuje się w grupy IIA i IIF. Dielektryki typu IIA IIB - oparte na tytanianie baru mają przenikalność ok. 1000 i małą stratność. Typ IIC IID oparte na spiekach BaTiO3 z domieszkami mają przenikalność 2000-5000 i średnią stratność.
19. Efekt piezoelektryczny. Piazoelektryki ceramiczne. Diagram fazowy PZT. Metoda rezonansu- antyrezonansu.
I. Efekt piezoelektryczny.
*zjawisko piezoelektryczne proste - polega na wytworzeniu się ładunku na ściankach kryształu (polaryzowaniu się bryły dielektryka w określonym kierunku) pod wpływem naprężenia mechanicznego
![]()
gdzie
Pi - polaryzacja;
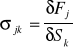
[N/m2] - tensor drugiego rzędu (funkcja liniowa naprężeń); TENSOR - uogólnienie wektora i skalara.
dijkE - moduł piezoelektryczny próbki przy ustalonym natężeniu pola elektrycznego E określający w sposób ilościowy jej właściwości piezoelektryczne.
*zjawisko piezoelektryczne odwrotne - odkształceniu kryształu pod wpływem zewnętrznego pola elektrycznego.
![]()
gdzie
![]()
- tensor drugiego rzędu (funkcja odkształcenia);
![]()
- moduł piezoelektryczny próbki przy ustalonym naprężeniu mech δ;
Ei - natężenie pola zewnętrznego.
W zależności od kierunku zmian składowej polaryzacji - kierunku wektora polaryzacji względem kierunku działania naprężeń zewnętrznych rozróżniamy:
*zjawisko piezoelektryczne poprzeczne - gdy kierunek zmian polaryzacji Pi jest prostopadły do działania zewnętrznych naprężeń mechanicznych,
*zjawisko piezoelektryczne podłużne - gdy kierunek zmian składowej polaryzacji Pi jest równoległy do kierunku działania naprężeń.
II. Ceramika piezoelektryczna - jest materiałem drobnokrystalicznym złożonym z kryształów ferroelektrycznych, które mają strukturę domenową o określonych kierunkach polaryzacji.
III. Ceramika PZT - ceramika oparta na spiekach tytanianu i cyrkonianu ołowiowego. Jest stosowana do przetworników piezoelektrycznych, rezonatorów generujących ultradźwięki. Własności tej ceramiki w znacznym stopniu zależą od techniki polaryzowania próbek.
Własności elektryczne ceramiki PZT.
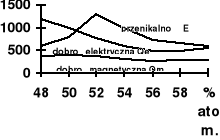
Diagram fazowy PZT
IV. Metoda rezonansu- antyrezonansu jest modyfikacją metody impedancji szeregowej. W metodzie tej dokonuje się pomiarów częstotliwości rezonansu, antyrezonansu i pierwszego overtonu (kolejny rezonans na wyższych częstotliwościach). Dla częstotliwości rezonansowej reaktancja układu zastępczego jest minimalna, a dla częstotliwości antyrezonansowej - maksymalna.
Rezonans - odpowiada rezonansowi mechanicznemu,
antyrezonans - rezonansowi elektrycznemu gałęzi mechanicznej z pojemnością.
Załóżmy że płytka z materiału piezoelektrycznego wykonuje drgania, które mogą być opisane równaniem oscylatora tłumionego, ładunek na płytce jest proporcjonalny do wychylenia:
![]()
mx + kx = 0;
mx + 2Bx + kx = 0;
mx + 2Bx + kx = F0 sinωt - tłumiony z siłą wymuszającą
Aby zaszła taka zależność na płytce musi wystąpić efekt piezoelektryczny.
Układ do badania rezonansu - antyrezonansu
![]()
20. Nadprzewodnicywo. Wysokotemperaturowe nadprzewodniki. Perspektywy i problemy zastosowań.
II. Wysokotemperaturowe nadprzewodniki.
Nadprzewodnictwo - zjaw szybkiego zanikania oporu właściwego (rezystywności) w bardzo niskiej temp bliskiej zera bezwzględnego - jest to temp przejścia. Dotychczas najwyższą temp przejścia w stan nadprzewodnictwa osiągał stop niobu glinu i germanu (Nb3Al0,8Ge0,2). W 1987 Bednon i M*ller wykryli wysokotemperaturowe nadprzewodnictwo w tlenkach metali Ba-La-Cu-O. Po zastąpieniu w Ba-La-Cu-O jonu lantanu przez mniejszy jon Y3+ spowodowało to skok temp przejścia z 20K do 92K. Zastosowanie: elektromagnesy, akceleratory cząstek elementarnych, tomografy, separatory radiowe. Zast perspektywiczne: silniki i prądnice, pojazdy, najszybsze znane elementy bramkujące 1010 Hz, kable przesyłowe linii energetycznych.
21. Specjalne materiały ceramiczne.
Specjalne materiały ceramiczne.
Różne rodzaje materiałów spiekanych odznaczające się charakterystycznymi parametrami technicznymi, nietypowymi dla ceramiki klasycznej. Do ceramiki specjalnej zalicza się materiały o dużej wytrzymałości elektrycznej, małych stratach dielektrycznych, wielkiej rezystywności skośnej i powierzchniowej, określonej przenikalności elektrycznej niezależnej od napięcia, temperatury, częstotliwości i czasu, materiały ceramiczne półprzewodzące, materiały ceramiczne magnetyczne, ceramikę próżnioszczelną, materiały o małym współczynniku rozszerzalności cieplnej, materiały odporne na działanie bardzo gorących gazów stosowane w technice rakietowej, materiały do budowy reaktorów jądrowych - tzw. ceramika nukleoniczna.
Ceramika biologiczna - dobrze tolerowana przez organizm np. Al2O3 - na implanty kostne, biodra, stawy, płytki do łączenia kości, zastawki, zęby.
22. Mikrostruktura ceramiki. Gęstość, porowatość, nasiąkliwość.
I. Mikrostruktura ceramiki.
Ceramika jest materiałem wielofazowym, rozróżnia się następujące fazy: krystaliczną, szklistą i gazową.
Faza krystaliczna - składa się z krystalitów danego związku ceramicznego lub stałego roztworu, przy czym ich skład i struktura są określone poprzez główne właściwości materiału ceramicznego.
Faza szklista - jest amorficzną warstwą wiążącą inne fazy.
Faza gazowa - zapełnia pory ceramiki.
Przestrzenny rozkład faz - zależy od sposobu ich produkcji, rodzaju surowców, kinetyki przemian fazowych oraz warunków wzrostu ziaren i czasu spiekania.
II. Nasiąkliwość - zdolność wchłaniania cieczy przez czerep wypalanej ceramiki. Jest proporcjonalna do porowatości materiału, gdyż ciecz wnika w pory otwarte. Rozróżnia się:
*nasiąkliwość całkowitą
![]()
m0 -próbka sucha
m1 - nasycona H2O
*nasiąkliwość objętościowa
![]()
lub![]()
V1 - obj H2O w próbce
V2 - obj próbki z pomiarów
III. a Porowatość bezwzględna - całkowita - ilość wolnej przestrzeni w materiale ceramicznym stanowiąca różnicę między ciężarem właściwym i objętościowym, wyrażana w procentach. Porowatość całkowita stanowi sumę porowatości otwartej i zamkniętej.
![]()
Pb - porowatość bezwzględna
Y - ciężar właściwy
Y0 - ciężar objętościowy
III. b Porowatość otwarta - pozorna - względna - określana zwykle przez wypełnienie wodą porów stanowiących w materiałach kanaliki lub szczeliny między ziarnami krystalicznymi.
![]()
G0 - ciężar próbki wysuszonej
G1 - ciężar próbki nasyconej wodą
G2 - ciężar próbki zanurzonej w wodzie podczas ważenia
III. c Porowatość zamknięta - pory występujące w materiale ceramicznym wewnątrz ziarn krystalicznych w fazie bezpostaciowej lub na granicach i narożach ziarn krystalicznych, które nie mają połączenia ze swobodną powierzchnią materiału. Porowatość zamkniętą można oznaczyć przez określenie porowatości całkowitej i otwartej.
![]()
PZ - zamknięta, PC - całkowita, PO - otwarta.
IV. a Gęstość - masa właściwa - stosunek masy próbki do jej objętości rzeczywistej, to jest do objętości całkowitej zmniejszonej o objętość porów.
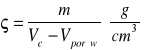
IV. b Gęstość pozorna - stosunek masy próbki do jej całkowitej objętości łącznie z porami.
![]()
26. Przewodnictwo cieplne materiałów ceramicznych.
Ciepło jest to energia jaką, układ o wyższej temperaturze przekazuje znajdującemu się z nim w kontakcie cieplnym układowi o niższej temperaturze w procesie dochodzenia obu układów do równowagi cieplnej. W procesie tym energia wewnętrzna układu o wyższej temperaturze maleje, a energia
wewnętrzna układu o niższej temperaturze rośnie.
Wymiana ciepła może odbywać się trzema sposobami :
1) przez przewodzenie: ma ono miejsce wtedy, gdy dwa ciała o różnych temperaturach znajdują się w bezpośrednim zetknięciu się ze sobą lub gdy
w różnych miejscach danego ciała panują różne temperatury
2) przez unoszenie: jeżeli między dwoma ciałami o różnej temperaturze znajduje się warstwa cieczy lub gazu, to wymiana ciepła odbywa się przez przewodzenie
tego czynnika, lecz również dzięki powstawaniu prądów w cieczy lub gazie
3) przez promieniowanie: każde ciało jest źródłem promieni cieplnych. Ilość ciepła wypromieniowanego przez ciało zależy od jego temperatury, rodzaju
powierzchni i natury ciała promieniującego i przyjmującego promieniowanie
W większości przypadków wymiana ciepła odbywa się jednocześnie paroma z wymienionych sposobów.
2. Prawo Fouriera. Współczynnik przewodnictwa cieplnego.
Przewodzenie ciepła jest to wymiana ciepła między bezpośrednio stykającymi się częściami ciał. Przebiega zgodnie z prawem Fouriera: gęstość strumienia przewodzonego ciepła jest wprost proporcjonalna do gradientu temperatury w kierunku prostopadłym do powierzchni izotermicznej
![]()
λ - współczynnik przewodzenia ciepła (W/m*K) jest to liczbowo ilość ciepła dQ która przepływa w jednostce czasu dτ przez jednostkę przekroju F przy gradiencie temperatury dt/dx względem odległości x=1. Zgodnie z równaniem Fouriera ilość ciepła:
![]()
dQ/dτ - strumień cieplny
Współczynnik przewodzenia ciepła λ zależy od temperatury i jest największy w przypadku ciał stałych (przede wszystkim metali), a najmniejszy - w przypadku gazów. Wymiana ciepła to bezprzeponowe lub przeponowe przenikanie ciepła od ciała o temperaturze wyższej t2 do ciała o temperaturze niższej t1 opisane równaniem: 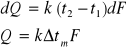
23. Właściwości sprężyste materiałów anizotropowych i wielofazowych.
Wpływ porów właściwości sprężyste materiałów.
I. Właściwości.
Moduł Young'a kompozytu - jest średnią ważoną obydwu faz. Najczęściej występuje przypadek że liczy Poisson'a włókien i osnowy są różne. Przy identycznym wydłużeniu w kierunku równoległym do osi włókien powiązanie ze sobą osnowy i włókien powoduje zmniejszenie poprzecznego skurczu w fazie o większej oraz zwiększenie tego skurczu w fazie o mniejszej liczbie Poisson'a w porównaniu ze stanem w którym obydwie fazy występują osobno. W obydwu fazach muszą wystąpić wzdłuż granic rozdziału naprężenia rozciągające w kierunku prostopadłym do tych granic. Następstwem tego jest wystąpienie w fazach zespolonych w kompozycie dodatkowej energii odkształceń sprężystych w porównaniu ze stanem przy odkształceniu nie powiązanych wzajemnie faz. Jeśli kompozyt zachowuje się idealnie sprężyście to PS/εS=ES. Kompozyty o dobrych właściwościach sprężystych otrzymujemy w przypadku wzmacniania ich np. włóknami węglowymi odznaczającymi się wysokimi wartościami modułu Young'a. Sprężyste odkształcenie się zarówno włókien jak i osnowy występuje tylko do momentu przekroczenia granicy plastyczności osnowy, na ogół bardziej plastycznej niż włókna.
II. Wpływ porów na właściwości sprężyste materiałów.
O odkształceniu sprężystym mówimy wtedy gdy po odjęciu siły próbka wraca do swych pierwotnych rozmiarów. Odkształcenia sprężyste typowych materiałów ceramicznych są bardzo nieznaczne, przy czym do ok. 0,5 - 1 % pierwotnych rozmiarów odkształcenie jest wprost proporcjonalne do obciążenia P.
Pory wywierają wpływ na rozkład naprężeń w fazie stałej i zmniejszenie udziału obciążonej powierzchni przekroju materiału komórkowego. Przenoszenie zewnętrznego obciążenia odbywa się wokół poru.
Pory niekuliste powodują znaczniejszą koncentrację naprężeń niż pory kuliste. Następuje nakładanie się pól naprężeń wokół porów możliwe są odkształcenia zginające, lokalne osłabienia kontaktów pomiędzy obszarami fazy stałej prowadzi to do zmniejszenia współczynnika nachylenia zależności E/E0 względem VP.
27. Pojęcie polaryzacji. Rodzaje polaryzacji. Dielektryk w stałym polu elektrycznym.
I. Pojęcie polaryzacji.
Wektor polaryzacji - suma momentów dipolowych na jednostkę objętości
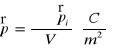
III. Podział dielektryków:
*niepolarne
*polarne
*ferroelektryki
Wektor indukcji
![]()
![]()
![]()
![]()
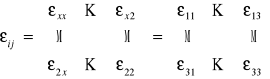
przenikalność dielektryczna to TENSOR II rzędu
![]()
0- przenikalność próżni
![]()
![]()
![]()
r - 1 = podatność elektryczna
![]()
II. Mechanizmy polaryzacji:
Polaryzacja elektryczna - zjawisko wzbudzenia dipoli. Zjawisko orientacji cząstek naładowanych w dielektrykach pod wpływem pola elektrycznego. Wielkość określająca ilościowo zmiany w strukturze elektrycznej materiału polaryzowanego.
Polaryzacja elektronowa - polega na deformacji zewnętrznej powłoki elektronowej atomu, pod wpływem przyłożonego pola elektrycznego elektrony przesuwają się nieznacznie względem rdzeni atomów.
Polaryzacja jonowa - powstaje w kryształach jonowych. Jeśli kryształ składa się z jonów różnego rodzaju pole zewnętrzne może spowodować wzajemne przesunięcie różnoimiennie naładowanych jonów - dodatnie przemieszczą się zgodnie z kierunkiem pola, ujemne przeciwnie do kierunku pola. Może też wystąpić gdy wiązania mają charakter częściowo kowalencyjny jednak taki że orbitale są przesunięte ekscentrycznie w kierunku bardziej elektroujemnych atomów.
Polaryzacja relaksacyjna - polega na zmianie położenia jonów (polaryzacja jonowo-relaksacyjna) lub dipoli (polaryzacja dipolowo-relaksacyjna) pod wpływem pola elektrycznego. Polaryzacja ta rośnie z momentem dipolowym cząstki polaryzowanej, maleje z temp. i czasem relaksacji.
Polaryzacja spontaniczna - istnieje tylko w dielektrykach w których wypadkowa pola pochodzącego od ładunków elementarnych jest różna od 0. Zmienia się nieliniowo w funkcji natężenia pola, stąd powstaje histereza elektryczna.
Polaryzacja orientacyjna - polaryzacja ustawienia - polaryzacja dielektryczna polegająca na częściowym uporządkowaniu cząsteczek dipolowych.
Polaryzacja migracyjna - jest to polaryzacja ładunku przestrzennego (bardzo powolna).
Polaryzacja ferroelektryczna - występowanie pętli histerezy.
29. Ferroelektryki w słabych i silnych zmiennych polach elektrycznych. Pętla histerezy. Układ SAWYERA-TOWERA.
I. Ferroelektryki w słabych i silnych zmiennych polach elektrycznych.
*słabe-nie powoduje przepolaryzowania ferroelektrycznego(stosow.do pomiaru przenikalności w funkcji temperatury)
*silne-powodują przepolaryzowanie tzw.przełączanie kierunków momentów dipolowych(ich orientację):
układ Sawera-Tawera
pętla histerezy
Ukł.Sayera-Tawera
Ukł.Krunina-bada prąd przepolaryzowany w funkcji czasu.
Wyznaczanie pola koercji i przewodnictwa elektrycznego
II. Pętla histerezy odpowiada wielu procesom zachodzącym wewnątrz ferroelektryka. Krzywa OABC to krzywa pierwotna lub krzywa S.
Wielkość polaryzacji określona odcinkiem OD w polu E=0 nazywa się polaryzacją szczątkową albo remanencją. Jeśli kierunek pola elektrycznego zmieni się na przeciwny, to wartość polaryzacji będzie się stopniowo zmniejszała do zera. Wartość pola, przy którym to następuje nazywamy polem koercji (odcinek OF). Zwiększjąc następnie wielkość pola elektrycznego, uzyskujemy stan nasycenia o kierunku przeciwnym do wyjściowego. Cały cykl jest opisany krzywą zamkniętą CDGHC, zwaną pętlą histerezy elektrycznej. W punkcie B wszystkie domeny są zorientowane w jednym kierunku i dlatego polaryzacja w tym punkcie jest równa sumie polaryzacji spontanicznej i indukowanej przez pole elektryczne równe polu w punkcie B. Gdy przedłużymy prostą BC w stronę osi OP, otrzymamy wartość polaryzacji wyznaczoną przez odcinek OK, który odpowiada polaryzacji spontanicznej. W punkcie C próbka ma maksymalną wartość polaryzacji Pm, którą obliczamy ze wzoru:
![]()
Pętlę histerezy cechuje także:
współczynnik prostokątności α i współczynnik kwadratności β
![]()
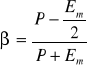
Pętla histerezy elektrycznej ferroelektryka:
III. Układ SAWYERA-TOWERA.
pozwala na bezpośrednią obserwację zjawiska histerezy dielektrycznej. Składa się on z dzielnika oporowego dostarczającego napięcie do poziomych płytek oscylografu oraz do dzielnika pojemnościowego, w którym znajduje się próbka ferroelektryczna Cx. Dzielnik pojemnościowy oprócz badanej próbki zawiera kondensator bezstratny Co, z którego napięcie doprowadza się do pionowych płytek oscylografu katodowego.
Napięcie na tym kondensatorze dane jest równaniem:
![]()
[V]
skąd:
![]()
Napięcie na próbce ferroelektrycznej Cx dane jest równaniem:
![]()
gdzie:
U - napiecie ze źródła.
Schemat układu SAWYERA-TOWERA :
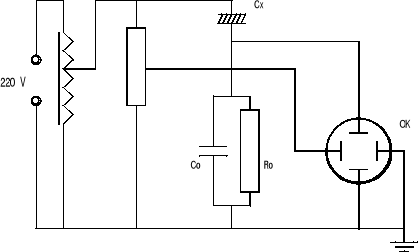
Układ SAWYERA-TOWERA pozwala otrzymać na oscylografie krzywą przedstawiającą zależność
P= f (E) gdzie
![]()
E - natężenie pola elektrycznego
d - grubość próbki
Dielektryk w stałym polu elektrycznym
Po umieszczeniu w polu elektrycznym dielektryka powstaje w nim różne od zera pole elektryczne. Pole to działa pewną \siłą na ładunki elektryczne znajdujące się wewnątrz dielektryka, wskutek czego ładunki dodatnie przesuwają się w kierunku działania pola, a ładunki ujemne w kierunku przeciwnym. Rozsunięcie ładunków dodatnich i ujemnych w przeciwne strony w dielektryku znajdującym się w polu elektrycznym nosi nazwę polaryzacji elektrycznej.
Dielektryk w zmiennym polu elektrycznym. Dyspersja.
Kondensator próżniowy
U = U0 cos t
U = U0 eit
![]()
popłynie prąd o gęstości:
![]()
![]()
![]()
![]()
d - grubość kondensatora
![]()
Dielektryk bezstratny
![]()
jp - prąd przesunięcia, wyprzedza on w fazie natężenie o 900 (
Gdy dielektryk przynosi straty, to:
![]()
jG - prąd przewodnictwa
δ - kąt strat dielektrycznych
![]()
ρ - oporność właściwa materiału
r-przenikalność względna materiału
Dyspersja - rozdrobnienie, pojęcie określające wymiary ziarn materiałów sproszkowanych (surowce mineralne, produkty chemiczne). Dyspersję materiału wyznacza się zwykle za pomocą analizy sitowej, czasami przez pomiar zewnętrznej powierzchni właściwej. Znajomość dyspersji materiałów jest konieczna do projektowania i konstruowania urządzeń w technologii chemicznej i ceramice.
30. Przemiany fazowe w ferroelektrykach. Prawo Curie-Waissa. Podstawy teorii termodynamicznej ferroelektryków. Przamiany fazowe I i II rodzaju. Rozmyte przemiany fazowe.
I. Przemiany fazowe w ferroelektrykach.
Przejścia fazowe ferroelektryków charakteryzują się ostrym maksimum przenikalności dielektrycznej, wpływają na przebieg piezoelektrycznych, elastycznych, optycznych i cieplnych właściwości kryształu. Przejście ferroelektryka przez punkt Curie towarzyszy zmiana symetrii kryształu.
II.Prawo Curie-Weissa:
ε=Cw\(T-T0)
gdzie:
Cw-stała CURIE-WEISSA ,
T0-temp. CURIE-WEISSA,
T-temperatura dielektryka.
IV. a Przejście fazowe pierwszego rodzaju
przejście podczas którego energia wewnętrzna U, objętość próbki V, polaryzacja spontaniczna PS i entropia S zmieniają się w sposób skokowy. Zachodzi przy tym wydzielanie lub pochłonięcie utajonego ciepła przemiany. Temp. Curie-Weiss'a nie pokrywa się z punktem Curie.
IV. b Przejście fazowe drugiego rodzaju -
przejście w którym energia wewnętrzna U, objętość próbki V, polaryzacja spontaniczna PS i entropia S ulegają ciągłym zmianom w obszarze przejścia fazowego a skokowo zmieniają się ich pochodne względem temperatury. Większość ferroelektryków ma w punkcie Curie przejście fazowe drugiego rodzaju.
V. Rozmyte przejście fazowe
paraelektryczno - ferroelektryczne zachodzące stopniowo w szerokim przedziale temperatur.
31. Struktura domenowa ferroelektryków i metody jej badań.
I. Struktura domenowa ferroelektryków i metody jej badań.
Domeny - obszary o uporządkowanej polaryzacji spontanicznej. Jeśli kryształ składa się tylko z jednej domeny, to po jego zewnętrznej stronie powstaje depolaryzujące pole elektryczne. Taki stan spolaryzowania kryształu nie jest stabilny. Podział kryształu na domeny jest wymagany ze względów energetycznych. Wypadkowy moment elektryczny kryształu jest równy zero, a pole depolaryzujące prawie zanika. Charakter rozbicia kryształu na domeny zależy od występowania w nim defektów strukturalnych, deformacji, od przewodnictwa elektrycznego i warunkach w których następuje przejście do fazy ferroelektrycznej, od szybkości chłodzenia i jednorodności temp. w objętości kryształu. Podział kryształu prowadzi nie tylko do zmniejszenia energii depolaryzacji lecz do powstania tzw. energii powierzchniowej warstw granicznych.
Granice między domenami - muszą być obszarami przejściowymi o skończonej grubości. Z warstwą graniczną jest związana pewna energia gdyż po przeciwnych stronach warstwy polaryzacja spontaniczna ma kierunki antyrównoległe, bądź wektory polaryzacji tworzą pewien kąt.
Charakter struktury domenowej - w dużym stopniu zależy od liczby możliwych kierunków orientacji wektora polaryzacji spontanicznej w danej strukturze krystalicznej.
W ferroelektrykach jednoosiowych - kierunki polaryzacji spontanicznej w sąsiednich domenach mogą różnić się tylko o 1800 i mogą w nich występować domeny antyrównoległe. W przypadku ferroelektryków wieloosiowych możliwa jest większa liczba typów domen np. domeny 900 lub 1800. Jeśli wektro polaryzacji domeny jest skierowany prostopadle do powierzchni kryształu to obserwujemy c-domeny, jeśli wektro polaryzacji jest równoległy do powierzchni kryształu to widoczne są a-domeny.
Metody badań:
*metoda trawienia - wykorzystuje się fakt że dodatnie końce domen 1800 trawione są z prędkością największą, ujemne z najmniejszą a boki z pośrednią. W efekcie na powierzchni powstaje relief odpowiadający strukturze domenowej. Zaletą metody jest jej prostota, obraz jest czytelny i łatwy do interpretacji. Wadą jest to że jest to metoda niszcząca, jest to statyczna struktura domenowa, nie daje informacji o strukturze wnętrza próbki.
*mikroskop polaryzacyjny - wykorzystuje się fakt że rozbicie kryształu na domeny jest równoznaczne z rozbiciem go na obszary optycznie anizotropowe. Analogicznie z domenami ferroelektrycznymi, współczynnik załamania światła w różnych kierunkach jest różne. Kierunek momentów dipolowych związany jest z kierunkiem wsp. własności optycznych. Polaryzator i analizator ustawiamy tak by nie przechodziło światło. Ustawiamy próbkę która powoduje skręcenie płaszczyzny polaryzacji. Na próbce pojawia się kolorowe światło. Metoda nieniszcząca, obserwacja zmian str. domenowej. Wady: próbki tylko przeźroczyste, rozmiary domen większe niż długość światła, nie rozróżnia się domen elektrycznych. Domeny można wykorzystać do przechowywania wiadomości.
*metody z wykorzystaniem mikroskopów elektronowych - jeśli na badany obiekt pada wiązka elektronów to w efekcie tego oddziaływania emitowanych jest kilka rodzajów promieniowania, które mogą być źródłem informacji o strukturze badanej próbki.
33. Materiały dla optoelektroniki światłowodowej.
Materiały dla optoelektroniki światłowodowej.
Światłowody dielektryczne-odmiany szkieł (zjawisko całkowitego wew. odbicia na granicy dwóch ośrodków) stosowane do przesyłania fal świetlnych.
Typy światłowodów dielektrycznych:
*jednomodowy o skokowych zmianach współczynnika załamania (dla jednej długości fal świetlnych)
*wielomodowy o skokowych zmianach współczynnika załamania (dla kilku długości fal świetlnych)
*gradientowy - samoogniskujący (zmiana współczynnika załamania zachodzi w sposób ciągły-przejścia płynne)
Zastosowanie-telekomunikacja pierwszej generacji-> światło promieniowania -lasery półprzewodnikowe:
1zakres widzialny-arsenki galu i glinu
2zakres podczerwieni-antymonki galu i glinu
Metody wytwarzania:
*wykorzystanie dwóch tygli ogrzewanych-> powstaje włókno światłowodowe
*wykorzystanie preformy (pręt+rurka). Układ przeciąga się przez piec tunelowy; powstaje ciągły współczynnik załamania.
Szkła muszą cechować się dużą czystością chemiczną. Wytwarzane są najczęściej z fazy ciekłej-bo duża łatwość oczyszczania, lub z fazy gazowej-szkła te mają duże koszty.
Wyszukiwarka
Podobne podstrony:
Wewnętrzna budowa mataerii
Wewnętrzna budowa materii GRUPA A
chemia, BUDOWA ATOMÓW, WIĄZANIA
Wewnętrzna budowa materii GRUPA B
budowa atomow i czasteczek , Budowa atomów i cząsteczek
budowa atomów i cząsteczek sprawdzian, VIII L.O
budowa atomów i cząsteczek sprawdzian VIII L O
Budowa atomów i cząsteczek, LICEUM różne, CHEMIA
budownictwo ogolne budowa stropodachu
drogi tech, budownictwo, semestr V, Budowa dróg i autostrad
BUDOWA ATOMOW W1
Budowa atomów i prawa chemiczne SPRAWDZIAN, do wykorzystania w szkole
pozwolenia wodnoprawne, Budownictwo, Normy budowalne
Odpowiedzi do sprawdzianu 'WEWNĘTRZNA BUDOWA MATERII' GRUPA A, sprawdziany gimnazjum, chemia, 1 gimn
więcej podobnych podstron