1. Wstęp teoretyczny
Ogniwo galwaniczne stanowi układ zbudowany z dwóch półogniw, który może wykonać pracę elektryczną kosztem zmiany energii zachodzącej w układzie w wyniku przemian chemicznych lub zmian stężenia. Półogniwa (elektrody) stanowią najczęściej fazy metaliczne, zanurzone w przewodniku jonowym.
W ogniwie galwanicznym obydwa półogniwa graniczą ze sobą w taki sposób, że po połączeniu przewodnikiem na zewnątrz ogniwa możliwa jest wędrówka ładunku elektrycznego od jednej elektrody do drugiej. W czasie przepływu prąd na elektrodzie dodatniej (katodzie)przebiega reakcja redukcji:
![]()
(1)
A na elektrodzie ujemnej (anodzie) - reakcja utleniania :
![]()
(2)
Elektrony płyną od anody do katody. Proces wypadkowy tych reakcji składowych przedstawia reakcję zachodzącą w ogniwie :
![]()
(3)
Dla każdego ogniwa charakterystyczna jest wielkość różnicy potencjałów pomiędzy dwoma jednakowymi przewodnikami metalicznymi dołączonymi do elektrod, gdy przez ogniwo nie przepływa prąd elektryczny. Zostaje wtedy osiągnięty stan równowagi reakcji elektrodowych w obu półogniwach. Taka równowagowa różnica potencjałów jest definiowana jako napięcie ogniwa w warunkach bezprądowych lub siła elektromotoryczna ogniwa E.
Badanie reakcji chemicznej w ogniwie ma szczególne znaczenie ze względu na możliwość przeprowadzenia w nim procesu w sposób odwracalny. W warunkach izotermicznychno-izobarycznych praca elektryczna, której dostarcza ogniwo, równa jest potencjałowi termodynamicznemu ၄G reakcji zachodzącej w ogniwie :
![]()
(4)
Gdzie: n - liczba moli elektronów biorących udział w pracy ogniwa, F - stała Faradaya, E - siła elektromotoryczna ogniwa.
Jeżeli w układzie przebiega reakcja:
![]()
(5)
To towarzysząca jej zmiana potencjału termodynamicznego ၄G określona jest równaniem:
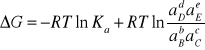
(6)
Gdzie: Ka - stała równowagi reakcji, aD,aE....- aktywności reagentów, R - stała gazowa, T - temperatura reakcji
Łącząc równania (4) i (6) otrzymujemy:
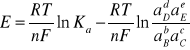
(7)
Siłę elektromotoryczną ogniwa, w którym aktywności wszystkich reagujących substancji są równe jedności, nazywa się standardową siłą elektromotoryczną i oznacza symbolem EႰ. Jej wartość zależy od ogniwa i jest stała w danej temperaturze.
Z równania (7) wynika:
![]()
(8)
A więc
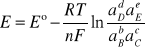
(9)
Zależność określającą związek siły elektromotorycznej ogniwa z aktywnością reagentów, zwaną równaniem Nernsta, można zastosować do obliczania potencjału pojedynczej elektrody, na której zachodzi reakcja utleniania bądź redukcji.
Różniczkując równanie (4) względem temperatury ( pod stałym ciśnieniem) otrzymujemy:
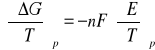
(10)
Porównując otrzymaną pochodną z zależnością wynikająca z II zasady termodynamiki:
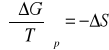
(11)
Otrzymuje się wyrażenie na entropię ΔS reakcji zachodzącej w ogniwie:
![]()
(12)
Na podstawie równań (4) i (12) oraz ogólnej zależności termodynamicznej:
![]()
(13)
Można obliczyć entalpię ΔH reakcji elektrochemicznej ogniwa:
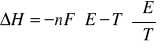
(14)
Zatem, pomiar siły elektromotorycznej ogniwa i jej zależności od temperatury umożliwia wyznaczenie funkcji termodynamicznych ΔH, ΔS i ΔG reakcji zachodzącej w ogniwie.
W badanym ogniwie:
![]()
Nie występuje potencjał dyfuzyjny, ponieważ nasycony roztwór KCl jest elektrolitem wspólnym dla obu elektrod.
Na elektrodzie kalomelowej (katodzie) zachodzi reakcja redukcji:
![]()
Natomiast na elektrodzie chlorosrebrowej (anodzie) - utleniania
![]()
Sumaryczną reakcję zachodzącą w tym ogniwie można przedstawić za pomocą równania:
![]()
Wyszukiwarka
Podobne podstrony:
sprawozdanie 35 wstep, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i ana
Fizyczna27m, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna u
Sprawozdanie damiana nr 1, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i
poprawa II 25, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna
Chfizyczna5, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna u
moje 4, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna uł, Ch
wfizyczna9, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna uł
chemia fizyczna-ćwiczenie 22, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczn
fizyczna 20, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna u
fizyczna25, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna uł
poprawa, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna uł, C
fIZYCZNA5, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna uł,
13 fiza word, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna
fizyczna nr 17 moja, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i anali
moje 18, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna uł, C
iza 25, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna uł, Ch
więcej podobnych podstron