Zakład Chemii Fizycznej
Laboratorium Studenckie
SPRAWOZDANIE
ĆWICZENIE 26
ZALEŻNOŚĆ SEM OGNIWA OD TEMPERATURY
WYKONALI:
Kozieł Urszula
Piotr Gawroński
Technologia Chemiczna
rok III grupa II
SZCZECIN 2002r
CEL ĆWICZENIA:
Celem ćwiczenia jest wyznaczenie zależności SEM ogniwa od temperatury.
WSTĘP:
W przeprowadzonym ćwiczeniu użyto nasyconej elektrody kalomelowej oraz platynowej zanurzonej w r-rze 0,1m J2 w 4% KJ. Po ustaleniu się stanu równowagi tegoż układu, zmnieniając kolejno temperaturę termostatu i regulując przepływ wody chłodzącej, dokonano pomiarów siły elektromotorycznej ogniwa SEM.
W ogniwie zaszły następujące procesy:na anodzie: reakcja utleniania
2Hg = 2Hg+ +2e
2Hg+ + 2Cl- = Hg2Cl2(s)
2Hg + Cl- = Hg2Cl2 (s) + 2e
na katodzie: reakcja redukcji
J2 + 2e = 2J-
Pomiaru SEM przez miliwoltomierz V-544 -różnicy potencjałów elektrod zmierzoną dla ogniwa przez które nie płynie prąd elektryczny, dokonywano dla temperatur 25, 30, 35, 40, i 450C co 3 minuty. Po ustaleniu się wskazań miliwoltomierza, przyjęto wynik jako prawidłowy.
Na podstawie odczytanych wartości siły elektromotorycznej układu, możliwe stało się określenie efektu cieplnego ΔH reakcji oraz zmianę entalpii swobodnej ΔG a także entropię ΔS.
W tym celu posłużono się równaniem Gibbsa i Helmholtza:
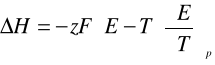
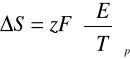
Zależność entalpii i entropii reakcji zachodzącej w ogniwie wiąże się także ze wzorem, który ujmuje zależność pomiędzy entalpią swobodna a siłą elektromotoryczną (E), czyli
![]()
gdzie: ΔG - entalpia swobodna
ΔH - entalpia
ΔS - entropia
z - liczba moli elektronów wymieniona w reakcji (tu: z = 2)
E - zbadana siła elektromotoryczna
F- stała Faradaya =96485,3 [C/mol]
Zestawienie wyników:
T [0C] |
T [K] |
SEM [V] |
25 |
298,15 |
0,4406 |
30 |
303,15 |
0,4386 |
35 |
308,15 |
0,4364 |
40 |
313,15 |
0,4338 |
45 |
318,15 |
0,4285 |
Opracowanie wyników:
1. Sumaryczne równanie reakcji odpowiedzialnej za pracę ogniwa:
J2 + 2Hg +2Cl- = Hg2Cl2(S)+ 2J-
2. Schemat używanego ogniwa zgodny z konwencją sztokholmską:
Hg I Hg2Cl2(s) I Hg2Cl2(nas.),KCl(nas.) I KJ(4%) II KJ(4%)I J2 (0,1m) I J2 I Pt
3. Równanie Nernsta na SEM badanego ogniwa:
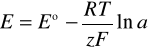
4. Odnalezione w literaturze potencjały normalne elektrod używanych w doświadczeniu:
- elektroda kalomelowa : + 0,2420 V,
- elektroda platynowa : + 0,536 V.
5. Z różnicy potencjałów obliczamy normalną siłę elektromotoryczną ogniwa ![]()
![]()
= + 0,536 - 0,242041 = 0,294 [V]
6. Z równania Nernsta 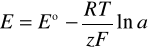
uwzględniając aktywności produktów i substratów (przyjmując dla ciał stałych a=1) otrzymujemy wzór:
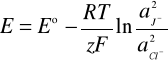
Dla SEM zmierzonej w warunkach standardowych
E= 0,4406 [V]
E0 = 0,294 [V]
R = 8,314 [J/K*mol]
z = 2
F = 96485,3 [C/mol]
otrzymujemy wzór na stosunek aktywności jonów J-/Cl-
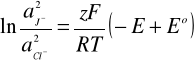
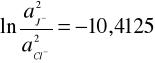
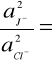
e-10,4125 = 3*10-5
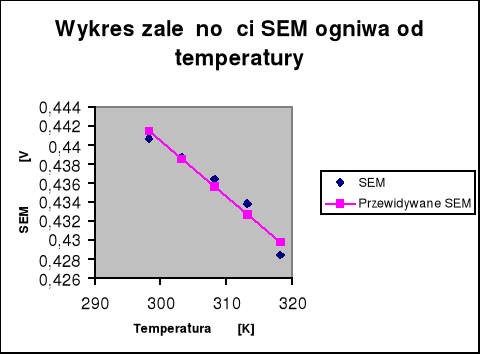
7. Wykres zależności E = f(T):
8. Wyznaczenie wartości współczynnika temperaturowego:
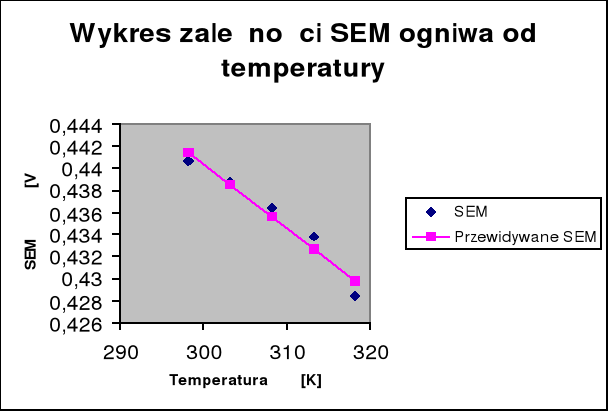
Współczynnik kierunkowy (a) prostej o równaniu ogólny y=ax+b
wynosi -0,00058 , czyli:
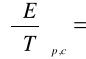
-0,00058 [V/K]
9. Ze wzoru Gibbsa-Helmholtza wyznaczamy wartości entalpii ΔH, entalpii swobodnej ΔG oraz entropii ΔS z jakimi przebiegała reakcja:
Dla T=298,15 [K]
E=0,4406 [V]
F=96485,3 [C/mol]
(dE/dT)p= -0,00058 [V/K]
z=2
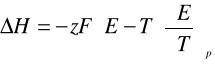
ΔH= -2 * 96485,3 *[ 0,4406 - 298,15 * (-0,00058)]= -118392,6733 [J/mol]
ΔH= -118,38926733 [kJ/mol]
Dla T=298,15 [K]
E=0,4406 [V]
F=96485,3 [C/mol]
(dE/dT)p= -0,00058 [V/K]
z=2
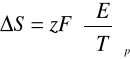
ΔS = 2 * 96485,3 * (-0,00058)
ΔS = -111,9229 [J/mol*K]
Dla E=0,4406 [V]
F=96485,3 [C/mol]
z=2
![]()
ΔG = -2 * 96485,3 * 0,4406 = 85022,84636 [J/mol]
ΔG = -85,02284636 [kJ/mol]
Wyszukiwarka
Podobne podstrony:
lab 7(1), Studia, Politechnika
lab 7, Studia, Politechnika
Lab 9 12, Studia - Politechnika Opolska, Semestr 2, Informatyka
Lab 7 12, Studia - Politechnika Opolska, Semestr 2, Informatyka
INZ LAB 4 CW, Politechnika Lubelska, Studia, semestr 5, Sem V, Sprawozdania, Sprawozdania-dokumenty,
Lab 8 12, Studia - Politechnika Opolska, Semestr 2, Informatyka
SPRAWOZDANIE nr 26, Studia, Politechnika
cz. 2 26, Studia, Politechnika
Robimy elementy belkowe, Studia Politechnika Poznańska, Semestr VI, Systemy MES, Lab-Projekt Wojtek,
lab 25(2), Studia, Politechnika
201 Lab fiz, Studia Politechnika Poznańska, Semestr II, I pracownia fizyczna, LABORKI WSZYSTKIE
LAB++22, Studia, Politechnika
Prawo inżynierskie i ochrona własności intelektualnych. Wykład 3, Studia, Politechnika Łódzka - Pend
ściskanie(lab), Studia, pomoc studialna, Sprawozdania Laborki, Wytrzymałość spr.nr2
Testy biodegradacji, Studia, Politechnika
Chf9, Studia, Politechnika
Wyznaczanie stałej reakcji szybkości zmydlania estru, Studia, Politechnika
więcej podobnych podstron