Szczecin 27.01.03
Tomasz Klama
Krzysztof Juszczyk
Ćwiczenie 25
Pomiar pH w zastosowaniu do wyznaczania
stałej równowagi reakcji dysocjacji
![]()
![]()
WPROWADZENIE
W 1909 roku Sorensen za miarę kwasowo-zasadową przyjął ujemny logarytm stężenia jonu wodorowego, nazwał go wykładnikiem wodorowym pH.
pH = - log [H+] Powstała w ten sposób skala służąca do ilościowego określania własności kwasowo-zasadowych roztworu.Roztwory kwaśne charakteryzuje stężenie jonu wodorowego ,a zasadowe stężenie jonu wodorotlenowego.Przyjęto, że w roztworach kwaśnych , obojętnych i zasadowych niezależnie od stężenia , iloczyn stężeń jonu H+ i OH- w danej temperaturze jest wielkością stałą. Dla temperatury bliskiej pokojowej przyjęto: [H+][OH-]=10-14 pH = -log [H+] pOH = -log [OH-] pH + pOH = 14 Roztwór obojętny posiada [H+] = 10-7 , w roztworach kwaśnych [H+]> 10-7 , a zasadowych [H+]< 10-7, tak więc pH w roztworach wynosi : obojętnym pH = 7 , kwaśnym pH < 7 , a zasadowym pH > 7. W roztworach wodnych słabego kwasu HA ustala się równowaga protolityczna : HA + H2O ↔ H3O+ + A- W przypadku , gdy roztwór jest dostateczni rozcieńczony (aktywność wody aH2O = 1 ) wartość stałej równowagi Ka tej reakcji można przedstawić jako :
Ka=(aH3O*aA-)/aHA (2)
gdzie ai - współczynnik aktywności poszczególnych reagentów.Zlogarytmowanie równania (2) prowadzi do zależności :
logKa=logH3O+ +log(aA-/aHA) (3)
Po podstawieniu: pH = -log aH3O+ (4)
pKa = -log Ka (5) ai = ci * γi (6) gdzie: ci i γi to odpowiednio stężenia i współczynniki aktywności reagentów , otrzymuje się
pH=pKa+log(Ca/CHA)+log(γA-/γHA) (7)
Wprowadzenie do roztworu kwasu HA pewnej ilości soli MA tego kwasu i mocnej zasady , prowadzi do otrzymania roztworu buforowego , którego pH zależy od stosunku stężenia kwasu i soli oraz , w niewielkim stopniu , od współczynników aktywności γA- i γHA .Można to uzasadnić przyjmując, że sól MA , która jest mocnym elektrolitem , ulega całkowitej dysocjacji . Równocześnie jej obecność wywołuje cofnięcie dysocjacji kwasu HA w reakcji (1) tak, że występuje on wyłącznie w formie niezdysocjowanej, a stężenie jonów A- pochodzi tylko z dysocjacji soli MA. Cosól = CM+ = CA- (8) Cokwas = CHA (9) Podstawiając zależności (8) i (9) do równania (7) oraz przyjmując , że dla roztworów bardzo rozcieńczonych współczynniki aktywności γHA i γA- różnią się nieznacznie od jedności, a wtedy
log(γA-/γA)=0 (10)
otrzymujemy:
pH=pKC+log(C0sól/C0kwas) (11) gdzie Kc jest klasyczną stałą równowagi zdefiniowaną za pomocą stężeń.
Wzór (11) zwany równaniem Hendersona - Hasselbalcha umożliwia ustalenie stosunku stężeń kwasu i soli w roztworze, który musi być zachowany, aby uzyskać wzorcowy roztwór buforowy o określonym pH. Konieczna jest w tym przypadku znajomość stałej dysocjacji.
Roztwory buforowe odznaczają się zdolnością zachowania w dużym stopniu stałości wykładnika jonów wodorowych.. Praktycznie pH roztworów buforowych nie ulega zmianom w wyniku dodania lub odparowania pewnej ilości rozpuszczalnika lub też dodania do roztworu niezbyt dużych ilości kwasu lub zasady.
Niezmienność pH roztworów buforowych obserwuje się tylko w pewnych granicach po przekroczeniu, których roztwór traci swoje buforujące własności. W związku z tym przyjęto stosować termin pojemności buforowej dla ilościowego określenia zmiany pH pod wpływem danej ilości mocnego kwasu lub zasady dodanej do ściśle określonej objętości roztworu buforowego. Miarą pojemności buforowej β jest stosunek dodanej ilości kwasu lub zasady Δb do osiągniętej przez to zmiany pH.
β=Δb/Δ(pH) (13)
Pojemność buforowa mieszaniny buforowej wzrasta wraz ze stężeniem roztworów i maleje wraz z ich rozcieńczeniem .Nie wpływa to w sposób widoczny na zmianę pH, jednak jest niekorzystne z uwagi na zmniejszanie pojemności buforowej roztworu..Wyznaczona z równania (11) klasyczna stała równowagi Kc nie jest identyczna z rzeczywistą stałą równowagi Ka. Chcąc wyznaczyć stałą równowagi Ka należy oprzeć się na równaniu sformułowanym za pomocą aktywności
pH=pKa+log(aA-/aHA)=pKa+log(CA/CHA) (14) Zakłada się przy tym , że współczynnik aktywności części niezdysocjowanej γ HA jest równy jedności. O wartościach współczynnika aktywności części zdysocjowanej γA- decyduje sumaryczna siła jonowa roztworu I zdefiniowana : I=1/2∑cizi (15)
zi- ładunki jonów występujące w roztworze
ci- stężenia jonów
Dla stężenia elektrolitów c = 0.001 do 0.01 mol/dm3 współczynnik aktywności jonów można obliczyć :
logγi=-Az2I-2 (16)
stała zależna od stałej dielektrycznej rozpuszczalnika i temp. , dla wody w temp. 25 OC A= 0.509 [dm3 ]1/2 mol -1/2
Dla roztworów o stężeniu do 0.1 [mol/dm3 ] log γi wynosi:
Log γi=-(Az2I-2/(1+αβI-2)) (17)
CEL ĆWICZENIA
Celem jest wyznaczenie stałej równowagi reakcji dysocjacji II stopnia kwasu fosforowego:
H2PO4- ↔ H+ + HPO4 2-
W oparciu o oznaczenia pH roztworów buforowych o znanym stosunku stężeń roztworów dwu soli kwasu fosforowego: 1/15 M Na2HPO4 i 1/15 M KH2PO4 stała równowagi tej reakcji wynosi:
Ka=(aH+*aHPO42-)/aH2PO4-=aH+*(CHPO42-/CH2PO4-)(γHPO42-/γH2PO4-) (20)
W celu określenia stałej równowagi Ka pomiary należy wykonywać dla szeregu roztworów o różnych wartościach stosunku stężeń mniejszych i większych od jedności . Wyznaczona doświadczalnie wartość pH
log(cNa2HPO4/CKH2PO4)+log(γHPO42-/γH2PO4)=0 (26)
daje szukaną wartość Ka na podstawie wzoru (25).
pH=pKa+log(CNa2HPO4/CKH2PO4)+log(γHPO42-/H2PO4)
POMIARY pH ROZTWORÓW Oznaczenie doświadczalne pH roztworów w ćwiczeniu polega na pomiarach siły elektromotorycznej ogniwa , którym jest elektroda kombinowana. Elektroda ta jest jedno prętowym ogniwem pomiarowym składającym się ze szklanej elektrody wskaźnikowej i chlorosrebrowej elektrody odniesienia umieszczonej w jednej obudowie. W praktyce wyznaczenie pH roztworu badanego wymaga uprzedniego wycechowania układu za pomocą roztworów wzorcowych.
OPRACOWANIE WYNIKÓW
Lp |
Na2HPO4 |
KH2PO4 |
pH |
CH+ |
CKH2PO4 |
CNa2HPO4 |
C1/C2 |
log(C1/C2) |
|
cm3 |
cm3 |
|
|
mol/dm3 |
mol/dm3 |
|
|
1 |
3 |
27 |
5,66 |
2,1878*10-6 |
2,9872 |
0,3319 |
0,1111 |
-0,9542 |
2 |
6 |
24 |
6,05 |
8,9125*10-7 |
2,6553 |
0,6638 |
0,25 |
-0,6021 |
3 |
9 |
21 |
6,29 |
5,1286*10-7 |
2,3234 |
0,9957 |
0,4286 |
-0,368 |
4 |
12 |
18 |
6,48 |
3,3113*10-7 |
1,9915 |
1,3276 |
0,6667 |
-0,1761 |
5 |
15 |
15 |
6,7 |
1,9953*10-7 |
1,6596 |
1,6596 |
1 |
0 |
6 |
18 |
12 |
6,83 |
1,4791*10-7 |
1,3276 |
1,9915 |
1,5 |
0,1761 |
7 |
21 |
9 |
7,02 |
9,5499*10-8 |
0,9957 |
2,3234 |
2,3333 |
0,368 |
8 |
24 |
6 |
7,23 |
5,8884*10-8 |
0,6638 |
2,6553 |
4 |
0,6021 |
9 |
27 |
3 |
7,6 |
2,5119*10-8 |
0,3319 |
2,9872 |
9 |
0,9542 |
Wzór na współczynniki aktywności :![]()
HPO42-i ![]()
H2PO4-
log![]()
i=-(Az2iI-2)/(1+I-2) (x)
![]()
B=1(mol/dm3)-1/2
Siła jonowa roztworu I:
I=0,5(CNa++CK++CH2PO4-+4CHPO42-)
Stężenia poszczególnych jonów wynoszą:
CNa+=[2a/(a+b)]Co
CHPO42-=[a/(a+b)]Co
CK+= CH2PO4-=[b/(a+b)]Co'
Co i Co'- stężenia początkowe roztworów
a,b - ilość roztworów w mieszaninie w cm3
X=log a/b+logγi/γk
CNa+ |
CK+ |
CHPO42- |
CH2PO4- |
I |
|
|
log |
X |
mol/dm3 |
mol/dm3 |
mol/dm3 |
mol/dm3 |
mol/dm3 |
|
|
|
|
0,0133 |
0,06 |
0,0067 |
0,06 |
0,08 |
0,448 |
0,112 |
-0,3522 |
-1,3064 |
0,0267 |
0,0533 |
0,0133 |
0,0533 |
0,0933 |
0,4755 |
0,1189 |
0 |
-0,6021 |
0,04 |
0,0467 |
0,02 |
0,0467 |
0,1067 |
0,5003 |
0,1251 |
0,2341 |
-0,1339 |
0,0533 |
0,04 |
0,0267 |
0,04 |
0,12 |
0,5228 |
0,1307 |
0,4259 |
0,2499 |
0,0667 |
0,0333 |
0,0333 |
0,0333 |
0,1333 |
0,5435 |
0,1359 |
0,6021 |
0,6021 |
0,08 |
0,0267 |
0,04 |
0,0267 |
0,1467 |
0,5627 |
0,1407 |
0,7781 |
0,9542 |
0,0933 |
0,02 |
0,0467 |
0,02 |
0,16 |
0,5806 |
0,1451 |
0,97 |
1,338 |
0,1067 |
0,0133 |
0,0533 |
0,0133 |
0,1733 |
0,5973 |
0,1493 |
1,2041 |
1,8062 |
0,12 |
0,0067 |
0,06 |
0,0067 |
0,1867 |
0,6130 |
0,1533 |
1,5563 |
2,5105 |

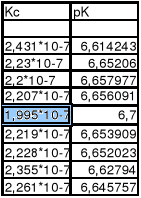
Stała równowagi reakcji dysocjacji I stopnia kw. fosforowego wynosi 1,995*10-7.

Wyszukiwarka
Podobne podstrony:
Lab 9 12, Studia - Politechnika Opolska, Semestr 2, Informatyka
Lab 7 12, Studia - Politechnika Opolska, Semestr 2, Informatyka
Lab 8 12, Studia - Politechnika Opolska, Semestr 2, Informatyka
201 Lab fiz, Studia Politechnika Poznańska, Semestr II, I pracownia fizyczna, LABORKI WSZYSTKIE
LAB++22, Studia, Politechnika
26 lab, Studia, Politechnika
FIZ-25, 1 STUDIA - Informatyka Politechnika Koszalińska, Labki, fizyka1, fiza, fizyka
lab 7(1), Studia, Politechnika
lab. 27, studia mechatronika politechnika lubelska, Studia WAT, semestr 2, FIZYKA 2, LABORKI, labork
lab 7, Studia, Politechnika
LAB F71, 1 STUDIA - Informatyka Politechnika Koszalińska, Labki, fizyka1, fiza, fizyka
Robimy elementy belkowe, Studia Politechnika Poznańska, Semestr VI, Systemy MES, Lab-Projekt Wojtek,
Metrologia 25 protokół, Politechnika Lubelska, Studia, semestr 5, Sem V, Nowy folder
Mikromaszyny 25 protokół, Politechnika Lubelska, Studia, semestr 5, Sem V, Nowy folder
Zal-lab-BP-zaoczne, politechnika lubelska, budownictwo, 3 rok, semestr 5, fizyka budowli, wykład
Prawo inżynierskie i ochrona własności intelektualnych. Wykład 3, Studia, Politechnika Łódzka - Pend
Testy biodegradacji, Studia, Politechnika
więcej podobnych podstron