Glukoza
- budowa, znaczenie i występowanie
Wykonały:
Małgorzata Olczyk
Wioleta Motyka
Wydział : Przyrodniczy
Kierunek : Fizjoterapia
Rok I, semestr I, grupa C
Glukoza
Glukoza (dokładniej: D-glukoza), C6H12O6 - węglowodan należący do cukrów prostych
z grupy aldoheksoz. Jest białym, drobnokrystalicznym ciałem stałym, z roztworów wodnych łatwo krystalizuje jako monohydrat. Bardzo dobrze rozpuszczalna w wodzie (nie zmienia pH roztworu), nierozpuszczalna w etanolu. Ma słodki smak, nieco mniej intensywny od sacharozy.
D-Glukoza jest podstawowym związkiem energetycznym dla większości organizmów, jest rozkładana w procesie glikolizy na kwas pirogronowy. Jest składowana w formie polimerów
- skrobi i glikogenu. Również wykorzystywana jako substrat wielu procesów zachodzących
w komórce - m.in. do produkcji celulozy. Enancjomerem D-glukozy jest L-glukoza, niewystępująca w organizmach wyższych.
Struktura glukozy może być przedstawiona trzema sposobami
O ile wzór strukturalny glukozy w formie prostego łańcucha (aldoheksoza, ryc.1) pozwala zrozumieć niektóre właściwości glukozy, o tyle struktura cykliczna (hemiacetal powstały w reakcji grupy aldehydowej z grupa hydroksylową) - jako termodynamicznie uprzywilejowana
- warunkuje jej pozostałe właściwości. Cykliczna struktura glukozy może być przedstawiona
w postaci płaskiego pierścienia narysowanego perspektywicznie, jak to zaproponował Haworth (ryc.2). Cząsteczka jest tu widoczna z boku i z góry płaszczyzny pierścienia. Zgodnie z konwencją, wiązania najbliższe względem oglądającego są pogrubione, a grupy hydroksylowe znajdują się powyżej lub poniżej płaszczyzny pierścienia. Sześcioczłonowy pierścień, zawierający jeden atom tlenu, w rzeczywistości istnieje w formie krzesełkowej (ryc.3).
Ryc.1 Ryc.2 Ryc. 3
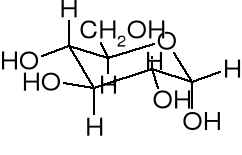
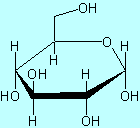
Glukoza - forma α-D-Glukoza α-D-glukoza konformacja
liniowa wg Fischera wg Hawortha krzesełkowa
Wykrywanie glukozy w roztworach
Do wykrywania glukozy przeprowadza się dwie charakterystyczne dla niej reakcje: próbę Trommera i próbę Tollensa (zwana także próbą próbą lustra srebrowego). Obie te próby dowodzą, iż glukoza ma właściwości redukujące.
Próba Trommera
Do świeżo strąconego wodorotlenku miedzi(II) dodaje się roztwór glukozy, następnie całą probówkę ogrzewa się. Po chwili niebieski osad Cu(OH)2 zmienia barwę na czerwoną. Powstała substancja to Cu2O (tlenek miedzi(I)). Opisana powyżej reakcja jest reakcją redukcji miedzi.
2 Cu(OH)2 + glukoza → Cu2O + kwas organiczny + 2 H2O
W tej reakcji wodorotlenek miedzi(II) pełni rolę utleniacza, a glukoza - reduktora. W wyniku redukcji powstaje tlenek miedzi(I), a w reakcji utleniania - kwas organiczny (kwas glukonowy)
i woda (H2O).
Próba Tollensa
Do probówki napełnionej niewielką ilością roztworu azotanu srebra należy dodać kilka kropli stężonego roztworu wodorotlenku sodu (NaOH), a następnie dolewać kroplami roztworu amoniaku (NH3), aż do rozpuszczenia się powstałego wcześniej osadu.
1. AgNO3 + NaOH → AgOH + NaNO3
2.a) 2 AgOH → Ag2O + H2O
2.b) Ag2O + CH2(OH)(CHOH)4CHO → 2 Ag + CH2(OH)(CHOH)4COOH
Tak przygotowaną probówkę należy umieścić w zlewce z gorącą wodą (na łaźni wodnej). Na koniec do probówki dodaje się roztwór glukozy. Podczas ogrzewania substancji o barwie brunatnej - Ag2O (powstałej z reakcji AgNO3 z NaOH) - na ściankach probówki wytrąca się warstewka srebra - lustro srebrowe.
3. Ag2O + glukoza → 2 Ag + kwas organiczny
Tlenek srebra pełni rolę utleniacza, a glukoza - reduktora. Podczas redukcji tlenku srebra powstaje srebro metaliczne (lustro na ściankach probówki), a podczas utleniania glukozy powstaje kwas organiczny (kwas glukonowy).
Ag2O + C6H12O6 → 2 Ag + C6H12O7
Biomedyczne znaczenie węglowodanów
Węglowodany (cukry) są bardzo rozpowszechnione w świecie roślinnym i zwierzęcym. Odgrywają one rolę zarówno strukturalną, jak również i metaboliczną. W roślinach glukoza jest syntetyzowana z di tlenku węgla i wody w procesie fotosyntezy i przechowywania w postaci skrobi lub ulega przekształceniu w celulozę (błonnik) ścian komórek roślinnych. Zwierzęta mogą syntetyzować węglowodany z aminokwasów, ale większa część węglowodanów zwierzęcych jest pochodzenia roślinnego. Glukoza jest najważniejszym węglowodanem, ponieważ większość węglowodanów zawartych w pokarmach jest wchłaniana do krwiobiegu jako glukoza lub jest
w nią przekształcana w wątrobie, a w organizmie z glukozy mogą powstawać wszystkie inne cukry. Glukoza jest bogatym źródłem energii w tkankach ssaków (z wyjątkiem przeżuwaczy)
i uniwersalnym „paliwem” dla płodu. Jest ona przekształcana w inne cukry, odgrywające swoiste role, np. glikogen stanowiący materiał zapasowy, rybozę i deoksyrybozę wchodzące w skład kwasów nukleinowych, galaktozę występującą w laktozie mleka, w pewnych lipidach złożonych oraz w połączeniu z białkami w glikoproteinach, proteoglikanach. Do chorób związanych
z zaburzeniem przemiany węglowodanów zalicza się cukrzycę, galaktozemię, zaburzenia spichrzania glikogenu i nietolerancję laktozy.
Znaczenie glukozy w żywym organizmie
Ze względu na ważną funkcję glukozy - podstawowe źródło energii wszystkich organów,
głównie dla mózgu i mięśni; ważne jest utrzymanie odpowiedniego jej stężenia we krwi organizmów żywych.
Prawidłowe stężenie glukozy we krwi waha się 80-100 mg/100ml. Stałość tego stężenia zapewniają hormony: adrenalina, glukagon, kortyzol, somatotropina i insulina. Obniżenie tego stężenia, spowodowane, np. nadmierną produkcją przez trzustkę insuliny lub też podaniem zbyt dużej dawki jej może doprowadzić do niedocukrzenia, tzw. hipoglikemii a jeśli jest to bardzo duży spadek następuje niedożywienie mózgu, tzw. szok insulinowy cechujący się: osłabieniem, przyśpieszonym tempem, silnym spadkiem ciśnienia tętniczego, drżenie ciała
a w poważnych przypadkach do utraty przytomności i drgań całego ciała, a krańcowo do śmierci mózgu.
Natomiast zbyt wysoki poziom glukozy, sięgający powyżej 300-1000 mg/100ml, zwany hiperglikemią jest spowodowany niesprawnością metabolizmu węglowodanów, co doprowadza do cukrzycy. Choroba ta nie leczona może spowodować między innymi utratę wzroku, uszkodzenie nerek, naczyń krwionośnych i zmiany w mózgu.
Występowanie glukozy
Glukoza występuje w znacznych ilościach w owocach (szczególnie w winogronach)
i miodzie.w medycynie: m.in. jako środek wzmacniający serce, w schorzeniach wątroby, do konserwowania krwi
przemysł spożywczy: wyroby cukiernicze
przemysł włókienniczy: m.in. barwienie skór.
BIBLIOGRAFIA
Biochemia HARPERA - PZWL
Internet :
www.wikipedia.pl
www.chemia_ogolna.webpark.pl
www.chemia.dami.pl
Wyszukiwarka
Podobne podstrony:
metabolizm, Fizjoterapia, Biochemia
pytania do kolosa i egz z odp, Studia, Fizjoterapia, Studia - fizjoterapia, Biochemia, kolosy i egza
Biochemia, fizjoterapia, biochemia, biochemia
Ćwiczenia I, Fizjoterapia, Biochemia
kolokwiumg30, Studia, Fizjoterapia, Studia - fizjoterapia, Biochemia, kolosy i egzamin
kolokwzg10, Studia, Fizjoterapia, Studia - fizjoterapia, Biochemia, kolosy i egzamin
Biochemia- wyklady, fizjoterapia, biochemia, biochemia
biochemia, fizjoterapia, biochemia + biofizyka
kolokwiumg20, Studia, Fizjoterapia, Studia - fizjoterapia, Biochemia, kolosy i egzamin
kolokwiumg50, Studia, Fizjoterapia, Studia - fizjoterapia, Biochemia, kolosy i egzamin
egzamin ćwiczenia 2, Studia, Fizjoterapia, Studia - fizjoterapia, Biochemia, kolosy i egzamin
Pytania egzaminacyjne z biochemii, Fizjoterapia, Biochemia
Glikogen, Fizjoterapia, Biochemia
egzaminpopz1, Studia, Fizjoterapia, Studia - fizjoterapia, Biochemia, kolosy i egzamin
Zagadnienia na kolokwium (1), Fizjoterapia, Biochemia
więcej podobnych podstron