27.10.2010 |
Mateusz Kaniewski |
Gr.V
|
Ćwiczenie 16 |
WYZNACZANIE CIEPEŁ ROZPUSZCZANIA TRUDNO ROZPUSZCZALNYCH WODOROTLENKÓW
|
|
Celem tego ćwiczenia jest doświadczalne wyznaczenie iloczynu rozpuszczalności.
Wykonanie ćwiczenia:
II Opracowanie wyników:
Sól |
1/R [Ω-1] |
χ [Ω-1 cm-1] |
c [mol dm-3] |
L |
L |
Błąd |
Błąd względny pomiaru[%] |
BaSo4 |
8,50E-06 |
4,42E-05 |
7,69E-09 |
5,92E-17 |
1,00E-10 |
1,00E-10 |
100,00 |
|
7,00E-06 |
2,72E-05 |
4,73E-09 |
2,24E-17 |
1,00E-10 |
1,00E-10 |
100,00 |
|
7,00E-06 |
2,72E-05 |
4,73E-09 |
2,24E-17 |
1,00E-10 |
1,00E-10 |
100,00 |
|
6,50E-06 |
2,15E-05 |
3,75E-09 |
1,40E-17 |
1,00E-10 |
1,00E-10 |
100,00 |
|
7,00E-06 |
2,72E-05 |
4,73E-09 |
2,24E-17 |
1,00E-10 |
1,00E-10 |
100,00 |
|
6,50E-06 |
2,15E-05 |
3,75E-09 |
1,40E-17 |
1,00E-10 |
1,00E-10 |
100,00 |
|
6,00E-06 |
1,59E-05 |
2,76E-09 |
7,63E-18 |
1,00E-10 |
1,00E-10 |
100,00 |
BaCO3 |
5,00E-05 |
5,14E-04 |
9,68E-08 |
9,36E-15 |
3,16E-09 |
3,16E-09 |
100,00 |
|
4,50E-05 |
4,58E-04 |
8,61E-08 |
7,41E-15 |
3,16E-09 |
3,16E-09 |
100,00 |
|
3,80E-05 |
3,78E-04 |
7,12E-08 |
5,07E-15 |
3,16E-09 |
3,16E-09 |
100,00 |
|
3,55E-05 |
3,50E-04 |
6,59E-08 |
4,34E-15 |
3,16E-09 |
3,16E-09 |
100,00 |
|
3,20E-05 |
3,10E-04 |
5,84E-08 |
3,41E-15 |
3,16E-09 |
3,16E-09 |
100,00 |
|
2,90E-05 |
2,76E-04 |
5,20E-08 |
2,70E-15 |
3,16E-09 |
3,16E-09 |
100,00 |
|
2,90E-05 |
2,76E-04 |
5,20E-08 |
2,70E-15 |
3,16E-09 |
3,16E-09 |
100,00 |
SrSO4 |
7,80E-05 |
8,32E-04 |
1,49E-07 |
2,22E-14 |
6,31E-07 |
6,31E-07 |
100,00 |
|
5,20E-05 |
5,37E-04 |
9,63E-08 |
9,27E-15 |
6,31E-07 |
6,31E-07 |
100,00 |
|
5,20E-05 |
5,37E-04 |
9,63E-08 |
9,27E-15 |
6,31E-07 |
6,31E-07 |
100,00 |
|
6,20E-05 |
6,50E-04 |
1,17E-07 |
1,36E-14 |
6,31E-07 |
6,31E-07 |
100,00 |
|
6,00E-05 |
6,28E-04 |
1,13E-07 |
1,27E-14 |
6,31E-07 |
6,31E-07 |
100,00 |
|
5,50E-05 |
5,71E-04 |
1,02E-07 |
1,05E-14 |
6,31E-07 |
6,31E-07 |
100,00 |
|
5,50E-05 |
5,71E-04 |
1,02E-07 |
1,05E-14 |
6,31E-07 |
6,31E-07 |
100,00 |
PbSO4 |
3,40E-05 |
3,33E-04 |
5,53E-08 |
3,06E-15 |
1,58E-08 |
1,58E-08 |
100,00 |
|
3,00E-05 |
2,88E-04 |
4,78E-08 |
2,29E-15 |
1,58E-08 |
1,58E-08 |
100,00 |
|
3,10E-05 |
2,99E-04 |
4,97E-08 |
2,47E-15 |
1,58E-08 |
1,58E-08 |
100,00 |
|
3,30E-05 |
3,22E-04 |
5,35E-08 |
2,86E-15 |
1,58E-08 |
1,58E-08 |
100,00 |
|
3,60E-05 |
3,56E-04 |
5,91E-08 |
3,49E-15 |
1,58E-08 |
1,58E-08 |
100,00 |
|
3,30E-05 |
3,22E-04 |
5,35E-08 |
2,86E-15 |
1,58E-08 |
1,58E-08 |
100,00 |
|
3,10E-05 |
2,99E-04 |
4,97E-08 |
2,47E-15 |
1,58E-08 |
1,58E-08 |
100,00 |
PbCO3 |
4,50E-06 |
-1,13E-06 |
-2,03E-10 |
4,11E-20 |
7,94E-14 |
7,94E-14 |
100,00 |
|
4,80E-06 |
2,27E-06 |
4,05E-10 |
1,64E-19 |
7,94E-14 |
7,94E-14 |
100,00 |
|
4,70E-06 |
1,13E-06 |
2,03E-10 |
4,11E-20 |
7,94E-14 |
7,94E-14 |
100,00 |
|
4,60E-06 |
0,00E+00 |
0,00E+00 |
0,00E+00 |
7,94E-14 |
7,94E-14 |
100,00 |
|
4,90E-06 |
3,40E-06 |
6,08E-10 |
3,69E-19 |
7,94E-14 |
7,94E-14 |
100,00 |
|
5,00E-06 |
4,53E-06 |
8,10E-10 |
6,57E-19 |
7,94E-14 |
7,94E-14 |
100,00 |
|
4,80E-06 |
2,27E-06 |
4,05E-10 |
1,64E-19 |
7,94E-14 |
7,94E-14 |
100,00 |
Tabela 1.
Sałej konduktometru obliczamy ze wzoru:
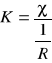
,
gdzie: χ - przewodnictwo właściwe 0,1 M KCl,
![]()
- wartość przewodnictwa dla 0,1 M KCl, mierzona na konduktometrze,
K - stała konduktometru.
![]()
= 0,00103 [Ω-1] - wynik pomiaru przewodnictwa w temperaturze 20oC
χ = 0,01167 [Ω-1 cm-1] - przewodnictwo właściwe 0,1 M KCl w temperaturze 20oC
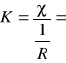
11,3301 [cm-1]
Obliczanie przewodnictwa dla badanych wodnych roztworów soli:
![]()
,
gdzie: χ - przewodnictwo właściwe badanego wodnego roztworu soli,
![]()
- wartość przewodnictwa dla badanego wodnego roztworu soli
K - stała konduktometru.
Wyniki obliczeń zestawiono w Tabeli 1.
Obliczanie stężeń badanych wodnych roztworów soli:
![]()
gdzie: λ+ , λ- - graniczne przewodnictwo równoważnikowe kationu i anionu,
z+ , z- - ładunek kationu i anionu,
c - stężenie,
F - stała Faraday'a,
α+ , α- - liczba kationów lub anionów otrzymanych w wyniku rozpuszczania
soli w wodzie.
Graniczne przewodnictwa odpowiednich anionów i kationów:
λ-
|
λ+ |
1600 |
1272 |
1600 |
1272 |
1600 |
1272 |
1600 |
1272 |
1600 |
1272 |
1600 |
1272 |
1600 |
1272 |
1386 |
1272 |
1386 |
1272 |
1386 |
1272 |
1386 |
1272 |
1386 |
1272 |
1386 |
1272 |
1386 |
1272 |
1600 |
1189 |
1600 |
1189 |
1600 |
1189 |
1600 |
1189 |
1600 |
1189 |
1600 |
1189 |
1600 |
1189 |
1600 |
1410 |
1600 |
1410 |
1600 |
1410 |
1600 |
1410 |
1600 |
1410 |
1600 |
1410 |
1600 |
1410 |
1386 |
1410 |
1386 |
1410 |
1386 |
1410 |
1386 |
1410 |
1386 |
1410 |
1386 |
1410 |
1386 |
1410 |
III. Oszacowanie błędów:
Błąd wyznaczania stałej K:
K = ![]()
ΔK = K1 ( | ![]()
| + | - ![]()
| ) + K2 ( | ![]()
| + | - ![]()
| )
K1 = 0,001759 kcal/K
K2 = 1,926534 kcal/k
Δm = 0,0001g
ΔT = 0,001K
ΔK= 0,00115 kcal/K
Względny błąd ΔK [%] = 0,059754
Błąd wyznaczania ciepła spalania Qsp. :
Qsp. = K ![]()
- 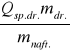
= Q1 - Q2
ΔQ = Q1 ( | ![]()
| + |![]()
| + | - 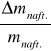
| ) - Q2 (| ![]()
| + | - 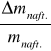
| )
Q1 = 9,499 kcal/g
Q2 = 0,010 kcal/g
Δm = 0,0001g
ΔT = 0,001K
ΔQ= 0,009258 kcal/g
Względny błąd ΔQ [%] = 0,09757
V. Wnioski:
Wyznaczyliśmy entalpię spalania naftalenu, jednak odbiega ona bardzo od standardowej, ponieważ dokonaliśmy błędów przy ważeniu substancji i drucików, co było nieuniknione. Nie spalaliśmy też w warunkach standardowych.
Wyszukiwarka
Podobne podstrony:
30 iloczyn próba, 13
Phonetics and Phonology 30 10 13 Gimson Chapter 4 Decri
30 10 13
30 iloczyn próba3
30 iloczyn próba2
30 iloczyn
30 iloczyn próba
Prez 13 11 30
aneta, jo 13, Do szpitala II poziomu opieki perinatalnej przyjęto ciężarną w 30 tygodniu ciąży z pow
Ko22/3381
więcej podobnych podstron