1. W naczyniu o pojemności 1 dm3 ogrzano do temp. 7210K 73,66g I2 i 1,62g H2. W stanie
równowagi otrzymano 71,68g HI. Proszę wyliczyć stałą równowagi KC.
I2 + H2 ↔ 2 HJ
|
Masa cząsteczkowa [g/mol] |
Masa początkowa [g] |
Liczba moli |
I2 |
254 |
73.66 |
0.29 |
H2 |
2 |
1.62 |
0.81 |
HJ |
128 |
71.68 |
0.56 |
Liczba moli obliczona z proporcji, np.
128 g/mol - 1 mol HJ
71.68 g - x moli HJ
---------------------------------
x = 0.56 mola HJ
Ile przereagowało I2 i H2 :
Z 1 mola I2 i 1 mola H2 otrzymujemy 2.00 mole HJ
A więc z „x „ mola I2 i H2 otrzymaliśmy 0.56 mola HJ
-----------------------------------------------------------------------------
x = 0.28 mola I2 i H2
Stężenie |
I2 |
H2 |
HJ |
Początkowe |
0.29 |
0.81 |
0 |
Przereagowało |
0.28 |
0.28 |
0 |
W stanie równowagi |
0.01 |
0.53 |
0.56 |
Stała równowagi reakcji:
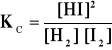
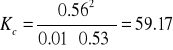
W pewnej temperaturze dla reakcji 3 CH ≡ CH ↔ C6H6 stała równowagi KC = 4. Jakie jest stężenie benzenu w stanie równowagi jeżeli stężenie acetylenu (etinu), c = 0,5 mola/dm3.
3 CH ≡ CH ↔ C6H6
Stała równowagi reakcji:
![]()
stąd: [C6H6] = KC ∙ [C2H2]
[C6H6] = 4 ∙ (0.5)3
[C6H6] = 0.5 mola/dm3
10. Po ustaleniu się równowagi w układzie, w którym przebiega reakcja syntezy NH3
(N2 + 3 H2 ↔ 2 NH3) w temp. 4000C pod ciśnieniem 10,13 x 105 Pa (10 atm) cząstkowe ciśnienia poszczególnych reagentów w stanie równowagi wynoszą:
ciśnienie NH3 = 0.385 atm.
" N2 = 2.404 atm.
" H2 = 7.211 atm.
Obliczyć:
stałe równowagi KP, KC, KX,,
stałą równowagi KP, gdy równanie tej reakcji podane jest w postaci 1/2 N2 + 3/2 H2 ↔ NH3.
a)
N2 + 3 H2 ↔ 2 NH3
Stała równowagi reakcji:
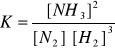
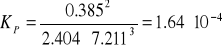
atm -2
![]()
gdzie Δ n = liczba moli produktów - liczba moli substratów
Δ n = -2; T = 400 + 273 = 673 K; R = 0.0820 dm3 atm/mol K
stąd: KC = 1.64 ∙ 10-4 ∙(0.082 ∙ 673) - (-2) = 1.64 ∙ 10-4 ∙ (55.186)2
KC = 0.5 (mol / dm3) -2
KX = KP ∙ P -Δ n
KX = 1.64 ∙ 10-4 ∙ 10 - (-2)
KX = 1.64 ∙ 10-2
b) 1/2 N2 + 3/2 H2 ↔ NH3
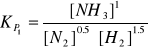
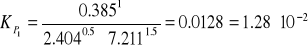
atm-1
lub ze wzoru: ![]()
![]()
19. Stała równowagi dla procesu estryfikacji etanolu kwasem octowym w temp. 298 K wynosi 4.00. Obliczyć skład mieszaniny w stanie równowagi, jeżeli wyjściowy roztwór zawierał
1 mol alkoholu etylowego, 2 mole kwasu octowego i 3 mole wody.
CH3COOH + C2H5OH ↔ CH3COOC2H5 + H2O
Stężenie [mol / dm3] |
CH3COOH |
C2H5OH |
Ester |
H2O |
Początkowe |
2 |
1 |
0 |
3 |
Przereagowało |
x |
x |
- |
- |
W stanie równowagi |
2 - x |
1 - x |
x |
3 + x |
Rozwiązanie |
1.4 |
0.4 |
0.6 |
3.6 |
Stała równowagi reakcji:
![]()
tj. po podstawieniu z tabeli
![]()
stąd:
3 x2 - 15 x + 8 = 0
ponieważ dla równania kwadratowego:
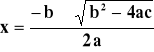
to wiedząc, że ![]()
otrzymujemy dwa wyniki: x1 = 4.39 (nie ma sensu fizycznego)
i x2 = 0.60 mol/dm3 - co daje wyniki dla ostatniej rubryki w tabeli.
Wyszukiwarka
Podobne podstrony:
Rownowaga chem 3, Farmacja, Chemia Fizyczna, zadania
Cisnienie osmotyczne, Farmacja, Chemia Fizyczna, zadania
Program wykladow 07 - 08, Farmacja, Chemia Fizyczna, zadania
Ekstrakcja 2, Farmacja, Chemia Fizyczna, zadania
Destylacja, Farmacja, Chemia Fizyczna, zadania
tech.chem. PGd chemia fizyczna wyklady, Technologia chemiczna, Chemia fizyczna, Wykłady, wykłady na
ula-chem.bazy, Chemia fizyczna
Aniony I-III(1), Farmacja, Farmacja, - Chemia Fizyczna
chemia fizyczna zadania
chemia fizyczna zadania
chem.fiz.równowagi fazowe, Inżynieria środowiska, inż, Semestr III, Chemia fizyczna, laboratorium
Przykładowe zadania z równowagi chemicznej CD CH 2010 2011, Technologia chemiczna, Chemia fizyczna,
zadania fizyczna ćw. 4, Chemia fizyczna dr Cysewski farmacja CM UMK Bydgoszcz
, chemia fizyczna, Równowagi pH w roztworach buforowych
15 wyznaczanie ciepła spalania, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, Chem
Egzamin - chemia fizyczna (2), Egzamin chem.fiz
laborki 3, Chemia fizyczna dr Cysewski farmacja CM UMK Bydgoszcz
chemia fizyczna laboratoria, iwona chem. fiz. ćw. 91
więcej podobnych podstron