|
6b Elektrochemiczne otrzymywanie chloranów(VII)
KClO4 jak i NH4ClO4 są stosowane w pirotechnice i do produkcji materiałów wybuchowych. KClO4 stosuje się również jako odczynnik utleniający w stałych paliwach rakietowych. Jony ClO4- tworzą się przez anodowe utlenianie jonów ClO3-. W taki sposób otrzymuje się NaClO4, ponieważ NaClO3 jest lepiej rozpuszczalny w wodzie niż KClO3.
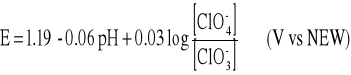
![]()
Reakcja anodowa:
z potencjałem opisanym równaniem Nersta
który jest tylko trochę niższy od potencjału reakcji tworzenia tlenu
![]()
Badania dotyczące wydajności tego procesu wykazały, że trzeba:
1) stosować anodę z polerowanej platyny, aby uniknąć wydzielania się tlenu
2) pracować (z tego samego powodu) przy dużej gęstości prądowej
3) ustalić pH około 7. Wyższe pH faworyzuje wydzielanie tlenu, niższe prowadziłoby do redukcji katodowej jonów ClO4-.
4) unikać śladowych nawet ilości chlorków. Jeśli jony Cl są obecne w roztworze to one właśnie utleniają się na elektrodzie. Z tego powodu chlorany(VII) otrzymuje się z chloranów(V) wstępnie oczyszczonych i przekrystalizowanych.
5) ustalić temperaturę między 30 a 40oC. Taka wartość jest wynikiem kompromisu: podwyższenie
6) pracować (w przeciwieństwie do innych produkcji elektrochemicznych) w systemie nieciągłym, tak aby utrzymać duże stężenie ClO3- w elektrolizerze. Stwierdzono bowiem, że wydajność znacznie spada ze zmniejszeniem się stężenia ClO3- .
Reakcje katodowe. Na katodzie wydziela się wodór. Jeśli roztwór zawiera K2CrO4 ani chlorany(V) ani chlorany(VII) nie są redukowane.
Wykonanie ćwiczenia
Porównamy dla tego samego zużycia energii wydajności otrzymanego chloranu(VII) w zależności od kwasowości elektrolitu.
Warunki prowadzenia procesu
Naczyńko: zlewka o poj. 250 cm3
Anoda: płytka platynowa 5x3 cm (A=30 cm3)
Katoda: siatka żelazna otaczająca anodę
Elektrolit:
200 cm3 r-ru zawierającego 350g NaClO3 na litr nasyconego KClO4 (nasycenie roztworu chloranem(VII) ma na celu unikniecie błędu w obliczeniach wydajności w trakcie końcowego wytrącania KClO4).
pH =3 (za pomocą H2SO4)
Temperatura: ze względu bezpieczeństwa pracujemy w temperaturze niższej (15-20oC) niż to jest praktykowane w przemyśle.
Gęstość prądu anodowego: 20 A/dm2 lub i=6A
Czas trwania elektrolizy: 60 min
Oznaczanie wytworzonego KClO4.
Po zakończonej elektrolizie (w tej samej zlewce) przeprowadzamy NaClO4 w słabo rozpuszczalny KClO4 (rozpuszczalność 1.1 g/100g H2O).
W tym celu należy dodać do zlewki z elektrolitem 50 cm3 roztworu nasyconego KCl i KClO4. Zamieszać i poczekać aż wydzieli się krystaliczny osad. Przesączyć osad przez tygiel z porowatym dnem. Do przemywania używać nasyconego r-ru KClO4. Po wysuszeniu tygla z osadem (60oC) zważyć osad.
Wyniki
1) masa otrzymanego KClO4 m =
2) ilość moli otrzymanego KClO4 n = m/106.5
3) Ładunek elektryczny Q = i t , Q = 10 A . 3600 s
4) teoretyczna liczba moli KClO4 przy 100% wydajności nt = Q/F ,
m = (10 A . 3600 s)/ 96500C
5) wydajność w = n / nt
6) wyjaśnić czym może być spowodowane obniżenie wydajności poniżej 100%.
![]()
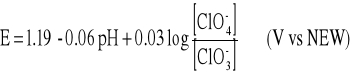
![]()
Wyszukiwarka
Podobne podstrony:
Cwiczenie 7b, UŁ Chemia, Elektrochemia
Cwiczenie 7a, UŁ Chemia, Elektrochemia
chemia fizyczna-ćwiczenie 22, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczn
ĆWICZENIE 14, Studia - Chemia kosmetyczna UŁ, II rok, III semestr, CHEMIA NIEORGANICZNA laboratorium
ĆWICZENIE 11, Studia - Chemia kosmetyczna UŁ, II rok, III semestr, CHEMIA NIEORGANICZNA laboratorium
chemia fizyczna-ćwiczenie 13, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczn
Sprawozdanie ćwiczenia nr 14damiana, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia
Fizyczna27m, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna u
Sprawozdanie damiana nr 1, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i
Tarcie na poziomie atomowym, UŁ Chemia, Technologia chemiczna
poprawa II 25, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna
Chfizyczna5, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna u
ćwiczenie 14 inteligentne systemy elektryczne, systemy inteligentne
moje 4, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna uł, Ch
ĆWICZENIE 9, Studia TOŚ, chemia analityczna-labor. semestr III
IMiR-program cwiczen, MiBM, Nauczka, 2 semstr, elektrotechnika
więcej podobnych podstron
