ORBITALE S
l=0, m=0
wszystkie orbitale s są sferycznie symetryczne
orbitale s różnią się lb węzłów (tzn. taka odległość, na której czynniki wielomianowej funkcji falowej równa się 0)
wzrost wartości zwiększa dł promienia orbitalu s
ORBITALE P
L=1, M=-1,0,1
e na orbitalu maja niezerowy moment pędu
Ukierunkowanie - trzy orbitale 2p, gdy l=1 różnią się wartościami ml (liczba ml informuje o momencie pędu wzdłuż wyróżnionej osi)
Symetryczny rozkład gęstości prawdopodobieństwa względem odpowiednich osi układu
Płaszczyzna węzłowa
Orbitale we wszystkich kierunkach mają taką samą energię
Rozmiar orbitalu p zależy od głównej liczby kwantowej
ORBITALE D
l=2, ml=-2,-1,-0,1,2
Pięć orientacji orbitali d w przestrzeni
ELEKTROUJEMNOŚĆ
Elektroujemność
Miara zdolności atomu, będącego składnikiem cząsteczki do przyciągania elektronu w swoją stronę.
Elektroujemność
Wzrasta w okresie wraz ze zwiększaniem się liczby atomowej pierwiastka
Maleje w grupach wraz ze zwiększaniem liczby powłok elektronowych (przejście od lżejszych do cięższych pierwiastków)
ENERGIA JONIZACJI
Energia jonizacji - energia niezbędna do usunięcia elektronu z orbity walencyjnej atomu danego pierwiastka
Ekranowanie przez elektrony rdzenia
Ładunek jądra
Budowa elektronowa powłoki walencyjnej
Zajęcie jednego orbitalu przez dwa elektrony - odpychanie między elektronami
HYBRYDYZACJA SP3 - NA PRZYKŁADZIE CH4
Orbital zhybrydyzowany powstaje w wyniku interferencji konstruktywnej i destruktywnej orbitali 2s i 2p w różnych obszarach.
Kombinacje liniowe tworzące 4 równocenne orbitale zhybrydyzowane:
h1 = s +px+py+pz h2 = s - px - py+pz
h3 = s -px+py-pz h4 = s +px-py-pz
Orbital zhybrydyzowany składa się z wielkiego płata, skierowanego ku jednemu z wierzchołków tetraedru
Kąt między osiami orbitali zhybrydyzowanych równa się 109,47Ⴐ
Orbital utworzony w jednego orbitalu s i trzech orbitali p nazywany jest orbitalem zhybrydyzowanym sp3.
Wszystkie cztery wiązania ၤ są identyczne z wyjątkiem położenia w przestrzeni (każdy z orbitali zhybrydyzowanych sp3 ma ten sam skład)
Ukierunkowanie orbitali zhybrydyzowanych wpływa na wzmocnienie wiązań, w których uczestniczą
HYBRYDYZACJA SP2 - NA PRZYKŁADZIE C2H4
Orbital zhybrydyzowany powstaje w wyniku nałożenie się orbitalu s i dwóch orbitali p.
Wyniku kombinacji trzech orbitali atomowych powstają trzy orbitale zhybrydyzowane:
h1= s + 21/2py
h2 = s + (3/2)1/2 px - (1/2)1/2 py
h3 = s - (3/2)1/2 px - (1/2)1/2 py
Na podstawie równań można stwierdzić, iż orbitale zhybrydyzowane leżą w jednej płaszczyźnie i są skierowane ku wierzchołkom trójkąta równobocznego
Każdy z dwóch atomów C o hybrydyzacji sp2 tworzy 3 wiązania ၤ poprzez sparowanie elektronu z elektronem zhybrydyzowanym drugiego C oraz orbitalami H.
Trzeci niezhybrydyzowany orbital p tworzy wiązanie ၰ (uniemożliwienie rotacji względem wiązania C-C)
Kąty między wiązaniami ၤ wynoszą 120Ⴐ
HYBRYDYZACJA SP - NA PRZYKŁADZIE C2H2
Orbital zhybrydyzowany powstaje w wyniku nałożenie się orbitalu s i orbitalu p.
Wyniku kombinacji dwóch orbitali atomowych powstają dwa orbitale zhybrydyzowane:
h1= s + pz
h2= s - pz
Orbitale zhybrydyzowane leżą wzdłuż osi łączącej jądra atomów C
Elektrony na dwóch pozostałych, niezhybrydyzowanych orbitalach p każdego atomu C, prostopadłych do osi cząsteczki tworzą dwa prostopadłe względem siebie wiązania ၰ.
Siły van der Waalsa są odpowiedzialne za występowanie oddziaływań między cząsteczkowych. Na tego typu oddziaływania składa się wiele procesów jednostkowych, z których najważniejsze to:
przyciąganie się cząstkowych ładunków różnoimiennych cząsteczek
odpychanie się ładunków jednoimiennych (oddziaływania kulombowskie)
odpychanie wynikające pośrednio z zasady Pauliego i wyłączenia elektronów z obszarów przestrzeni, gdzie występuje nakładanie się orbitali sąsiadujących atomów
-----------------------
Etap inicjowania łańcucha
Cl2 + hၮ Ⴎ 2ClႷ
Etapy wzrostu łańcucha
ClႷ + CH4 Ⴎ HCl + CH3Ⴗ
CH3Ⴗ + Cl2 Ⴎ CH3Cl + ClႷ
Etapy zakończenia łańcucha
ClႷ + ႷCl Ⴎ Cl2
CH3Ⴗ + ႷCH3 Ⴎ CH3CH3
CH3Ⴗ + ႷCl Ⴎ CH3Cl
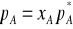
Prawo Raoulta - stosunek prężności pary każdego składnika mieszaniny do jego prężności pary w czystej cieczy, pA/ jest w przybliżeniu równy ułamkowi molowemu tego składnika (A) w roztworze:
![]()
Niektóre mieszaniny, szczególnie gdy ich składniki są chemicznie podobne spełniają prawo Raoulta bardzo dobrze. Mieszaniny, które spełniają to prawo w całym zakresie składu składnika A i B nazywamy roztworami idealnymi. Dla roztworów idealnych:
Według teorii Brönsteda-Lowry'ego kwasem jest substancja, która zawiera cząsteczki lub jony zdolne do oddawania protonów - donor, natomiast zasadą jest substancja zawierająca cząsteczki lub jony zdolne do przyjmowania protonów - akceptor.
Kwas A oddając proton staje się zasadą B. Zasada B przyjmując proton staje się z powrotem kwasem A
A Ⴋ B + H+
Kwas A jest zatem sprzężony z zasadą B.
W powyższej definicji nie wspomniano o rozpuszczalniku - jest ona słuszna również w przypadkach gdy nie ma rozpuszczalnika.
Według teorii Brönsteda-Lowry'ego kwasem są nie tylko cząsteczki obojętne, ale również jony dodatnie lub ujemne
HSO4- + H2O Ⴋ H3O+ + SO42-
NH4+ + H2O Ⴋ H3O+ + NH3
Podobnie zasadami według tejże teorii są zarówno cząsteczki obojętne, jak i jony dodatnie i ujemne
NH3 + H2O Ⴋ NH4+ + OH-
CO32- + H2O Ⴋ HCO3- + OH-
Przykład korozji żelaza w modelu kroplowym
Trzeba przyjąć założenie, że kropelka wody o odczynie lekko kwaśnym (lub zasadowym), zawierająca pewną ilość rozpuszczonego tlenu jest w kontakcie z metalem. Rozpuszczone cząsteczki tlenu znajdujące się w pobliżu krawędzi styku kropli z metalem, gdzie stężenie O2 jest większe , ulegają redukcji przez elektrony dostarczone przez żelazo z obszaru o powierzchni A.
Utlenianie żelaza może zachodzić w obszarze odległym od obszaru wzbogaconego w tlen.
Elektrony są transportowane przez metal.
Przekazane elektrony są uzupełniane przez inne elektrony, generowane w reakcji:
Fe Ⴎ Fe2+ + 2e-
Podstawowe metody zapobiegania korozji metali:
Powlekanie powierzchni nieprzepuszczalną warstwą
Powłoki galwaniczne
Ochrona kinetyczna - pasywacja
Ochrona katodowa
Ochrona katodowa elektrolityczna
Roztworami buforowymi są roztwory wodne:
słabych kwasów i ich soli z mocnymi zasadami (np. CH3COOH + CH3COONa) lub wodorosoli z mocną zasadą (np. H2CO3 + NaHCO3)
słabych zasad i ich soli z mocnymi kwasami (NH3 + NH4Cl)
wodorosoli kwasu fosforowego (V) (np. NaH2PO4 + Na2HPO4)
Koagulacja - zmniejszenie stopnia dyspersji fazy rozproszonej i przejście zolu, będącego układem koloidalnym nie w pełni trwałym w żel.
Czynniki mogące wywołać proces koagulacji:
dodanie koloidu o znaku przeciwnym
dodanie elektrolitu, zmniejszającego potencjał elektrokinetyczny
działanie promieniami ၢ i ၧ
ogrzewanie
działanie mechaniczne, np. wytrząsanie
dehydratację spowodowaną środkami odwadniającymi
wymrażanie
WŁAŚCIWOŚCI JONITÓW
Pęcznienie - spowodowane jest ono dyfuzją wody w głąb przestrzennej struktury jonitu i dążeniem jonów zawartych w wymieniaczach do osiągnięcia charakterystycznej dla nich solwatacji. Jest ono tym większe, im więcej grup jonowymiennych zawiera jonit i większy jest stopień dysocjacji i hydratacji oraz mniejsze stężenie roztworu otaczającego jonit. Zwiększenie usieciowania szkieletu zmniejsza stopień pęcznienia, który zależy również od odczynu i temperatury. Pęcznienie jonitu decyduje o ruchliwości jonów, a więc o szybkości wymiany jonowej. Zawartość wody w spęczniałym jonicie mieści się zwykle w granicach 50-90%.
Selektywność - wybiórcza wymiana danego przeciwjonu w obecności innych przeciwjonów. O selektywności jonitu możemy mówić wtedy, gdy stosunek ilościowy dwóch rodzajów wymienianych jonów po osiągnięciu stanu równowagi jest inny w wymieniaczu niż roztworze.
Zdolność wymienna - główny parametr charakteryzujący chemiczne właściwości jonitu oraz jego przydatność w procesach oczyszczania wody. Zdolność wymienna jonitu określa ilość miligramorównoważników wymienianych przeciwjonów na jednostkę masy lub objętości wymieniacza jonowego.
Zdolność wymienna robocza (użytkowa) ma znaczenie praktyczne, gdyż stanowi tę część całkowitej zdolności wymiennej, która może być wykorzystana w czasie eksploatacji jonitu i wyraża liczbę mikrogramorównoważników przeciwjonów, które są wymieniane przez jednostkową ilość jonitu, aż do chwili przebicia złoża jonowymiennego.
BENZEN
Każdy atom węgla jest związany z trzema innymi atomami; do tego celu wykorzystuje on orbitale o hybrydyzacji sp2, leżące w tej samej płaszczyźnie.
Cząsteczka benzenu jest płaska - wszystkie atomy węgla i wodoru znajdują się w tej samej płaszczyźnie.
Cząsteczka benzenu jest bardzo symetryczna - każdy atom węgla leży w wierzchołku sześciokąta foremnego, a każdy kąt między wiązaniami wynosi 120Ⴐ.
Oprócz trzech orbitali zhybrydyzowanych sp2 każdy z atomów węgla dysponuje jeszcze orbitalem p. Składa się on z dwóch równych pętli - jednej leżącej powyżej, a drugie poniżej płaszczyzny, w której znajdują się trzy pozostałe orbitale, tzn. powyżej i poniżej płaszczyzny pierścienia.
Orbital p jednego atomu węgla może się nakładać z orbitalem sąsiedniego atomu, w wyniku czego dochodzi do sparowania elektronów i utworzenia dodatkowego wiązania ၰ.
Orbital p każdego atomu węgla nakłada się w równym stopniu z orbitalami p obu sąsiadujących z nim atomów węgla. W rezultacie powstają dwie ciągle chmury elektronowe o kształcie pierścienia kołowego, jedna leżąca powyżej, a druga poniżej płaszczyzny wyznaczonej przez atomy pierścienia.
Jedynie płaska struktura cząsteczki umożliwia nakładanie się orbitali p w obu kierunkach, co w konsekwencji powoduje delokalizację elektronów i stabilizację układu.
![]()
![]()
![]()
Wyszukiwarka
Podobne podstrony:
wszystkie pytania - ciąg - sciąga - długopisy, Inżynieria Środowiska PW semestr I, chemia, sesja
chemia- ściąga I, Inżynieria Środowiska PW semestr I, chemia, sesja
sciaga chemia, Inżynieria Środowiska PW semestr I, chemia, sesja
13. egzamin 17 09 04, Inżynieria Środowiska PW semestr I, chemia, sesja
SESJA ZIMOWA 2006, Inżynieria Środowiska PW semestr I, chemia, sesja
zestawy 28 pyt Ai B mini, Inżynieria Środowiska PW semestr I, chemia, sesja
testy 1rok egz2, Inżynieria Środowiska PW semestr I, chemia, sesja
11. testy 1rok v4, Inżynieria Środowiska PW semestr I, chemia, sesja
egzamin test v3, Inżynieria Środowiska PW semestr I, chemia, sesja
9. testy 1rok v4a, Inżynieria Środowiska PW semestr I, chemia, sesja
egzamin 2004sciaga, Inżynieria Środowiska PW semestr I, chemia, sesja
10. testy 1rok egz6, Inżynieria Środowiska PW semestr I, chemia, sesja
testy 1rok egz3, Inżynieria Środowiska PW semestr I, chemia, sesja
8. testy 1rok vegz, Inżynieria Środowiska PW semestr I, chemia, sesja
więcej podobnych podstron