TEST 1
Izotopy to:
nuklidy o tej samej liczbie atomowej i różnej liczbie neutronów w jądrze,
nuklidy o tej samej liczbie masowej, lecz różnych liczbach atomowych Z,
nuklidy o tej samej liczbie neutronów (A-Z), lecz różnych wartościach A i Z,
nuklidy o stałej liczbie nukleonów i różnych liczbach atomowych.
Wartości liczbowe elektroujemności pierwiastków rozmieszczonych w układzie okresowym wykazują następujące kierunki zmian tego parametru w okresach i grupach:
wzrastają w okresie wraz ze zwiększaniem się liczby atomowej pierwiastka i maleją w grupach wraz ze zwiększaniem się liczby powłok elektronowych,
maleją w okresie wraz ze zwiększaniem się liczby atomowej pierwiastka i maleją w grupach wraz ze zwiększaniem się liczby powłok elektronowych,
maleją w okresie wraz ze zwiększaniem się liczby atomowej pierwiastka i wzrastają w grupach wraz ze zwiększaniem się liczby powłok elektronowych,
wzrastają w okresie wraz ze zwiększaniem się liczby atomowej pierwiastka i wzrastają w grupach wraz ze zwiększaniem się liczby powłok elektronowych.
Które stwierdzenie(a) dotyczące budowy acetylenu nie jest (są) prawdziwe:
elektrony dwóch niezhybrydyzowanych orbitali p każdego z atomów węgla C, prostopadłych do osi cząsteczki tworzą dwa, prostopadłe względem siebie wiązania π,
w cząsteczce występują trzy pojedyncze wiązania δ i dwa podwójne wiązania π,
orbitale zhybrydyzowane sp leżą w osi łączącej dwa jądra atomów węgla w cząsteczce,
każdy z dwóch atomów węgla w cząsteczce ma dwa zhybrydyzowane orbitale sp powstałe z kombinacji dwóch orbitali atomowych.
Liczba koordynacyjna (LK) w związkach kompleksowych jest:
liczbą jonów (cząsteczek) ligandu koordynowanych z atomem centralnym,
wartością liczbową odnosząca się do wartościowości jonu,
liczbą atomów połączonych bezpośrednio z atomem centralnym,
miarą elektroujemności donora par elektronowych w cząsteczce.
Termin „oddziaływanie dyspersyjne” odnosi się do:
efektu rozpraszanie światła przez cząsteczki znajdujące się w roztworze wodnym,
oddziaływania jądra na warstwy zewnętrzne w cząsteczce koloidu,
efektu Tyndala,
zagadnień związanych z powstawaniem dipoli indukowanych.
Przemianie węgla
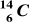
w azot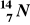
towarzyszy emisja:fali uderzeniowej,
promieniowania β,
promieniowania α,
promieniowania γ.
Zjawisko kapilarne jest efektem istnienia:
potencjału normalnego w układach redox,
napięcia powierzchniowego,
drgań rozciągających w cząsteczkach znajdujących się w roztworze,
pola elektrostatycznego.
Punkt potrójny na diagramie fazowym:
odpowiada takim warunkom, w których w układzie istnieją trzy różne fazy jednocześnie,
jest punktem przecięcia rzutu prostopadłego temperatury krytycznej na oś temperatury,
odpowiada warunkom normalnym,
jest punktem przecięcia dwóch linii równowagi faz.
Kwasy wieloprotonowe są:
najsłabiej zdysocjowane na pierwszym stopniu dysocjacji, znacznie mocniej na drugim i na dalszych,
zdysocjowane w równych stopniu bez względu na ilość oddanych protonów na kolejnych etapach dysocjacji,
najsilniej zdysocjowane na pierwszym stopniu dysocjacji,
związkami nie ulegającymi procesom dysocjacji, gdyż potrzebna jest znacznie większa energia do usunięcia protonu z takiej cząsteczki w porównaniu do kwasów jednoprotonowych.
W reakcji HSO4 - + H2O → SO42- + H3O+ , anion HSO4 - jest:
solą,
zasadą,
utleniaczem,
reduktorem.
Zgodnie z prawem Henry'ego, jeżeli rozpuszczony w cieczy gaz jest w stanie równowagi, to stężenie gazu w roztworze jest proporcjonalne do:
ilości cząsteczek rozpuszczalnika,
objętości roztworu,
prężności pary tego gazu nad powierzchnią roztworu,
masy molowej rozpuszczalnika.
Katalizator to substancja, która:
przyspiesza reakcję chemiczną, ale nie ulega przy tym zmianie,
jest substratem reakcji,
powstaje jako produkt reakcji heterolitycznego rozpadu wiązania,
rola polega na obniżeniu energii aktywacji.
13. Reakcja
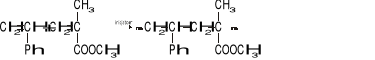
jest przykładem reakcji:
polimeryzacji,
wymiany jonowej,
kopolimeryzacji,
Fentona.
Reakcje dysproporcjonowanie to reakcje:
wymiany jonowej,
reakcje redoks, w których zachodzi równocześnie samoutlenienie i samoredukcja atomów tego samego pierwiastka w cząsteczce,
rodnikowe zachodzące po etapie inicjacji,
które nie zachodzą w warunkach naturalnych.
W odniesieniu do szeregu elektrochemicznego prawdziwe są następujące stwierdzenia:
ze wzrostem wartości ujemnej potencjału, zmniejszają się właściwości redukcyjne pierwiastków,
ze wzrostem wartości dodatnich potencjału, maleje podatność pierwiastków do przyjmowania elektronów,
w ogniwie galwanicznym, elektroda o bardziej ujemnym potencjale stanowi katodę, względem elektrody o mniej ujemnym lub dodatnim potencjale,
w układzie, w którym znajdują się pierwiastki o różnych potencjałach, nie może dojść do przepływu elektronów.
Kwas chlorowy (VII) HClO4 jest:
mocnym elektrolitem,
słabym elektrolitem,
substancją nie ulegającą procesom dysocjacji,
substancją ulegającą procesom dysocjacji tylko w niewielkim stopniu.
Hydrolizie nie ulegają:
sole słabych kwasów i mocnych zasad,
sole mocnych kwasów i zasad,
sole mocnych kwasów i słabych zasad,
sole słabych kwasów i słabych zasad.
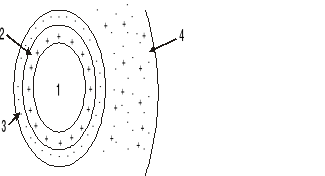
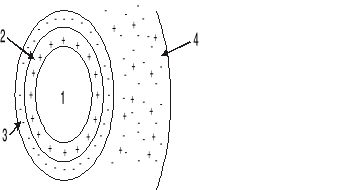
Na rysunku przedstawiono model cząsteczki koloidu.
Cyfry zamieszczone na rysunku oznaczają:
1- polimolekularne jądro, 2 - zaadsorbowana warstwa przeciwjonów, 3 - zaadsorbowana warstwa jonów potencjałotwórczych, 4 - powłoka dyfuzyjna.
1- polimolekularne jądro, 2 - zaadsorbowana warstwa jonów potencjałotwórczych, 3 - zaadsorbowana warstwa przeciwjonów, 4 - powłoka dyfuzyjna.
1- polimolekularne jądro, 2 - powłoka dyfuzyjna, 3 - zaadsorbowana warstwa jonów potencjałotwórczych, 4 - zaadsorbowana warstwa przeciwjonów,
1+2+3 - granulę, 4 - micelę.
Zdolność wymienna robocza jonitu oznacza:
objętość roztworu jaką można przepuścić przez jednostkową ilość jonitu do momentu przebicia złoża jonowymiennego,
maksymalny przepływ roztworu przez jednostkową ilość jonitu jaki można ustawić bez pogorszenia efektywności procesu wymiany jonowej,
liczba mikrogramorównoważników przeciwjonów, które są wymieniane przez jednostkową ilość jonitu do momentu przebicia złoża jonowymiennego,
objętość roztworu jaką trzeba przepuścić przez złoże jonowymienne w celu jego regeneracji.
Które ze stwierdzeń opisujących budowę cząsteczki metanu są prawdziwe:
każdy z czterech atomów wodoru jest połączony z atomem węgla wiązaniem podwójnym,
zhybrydyzowane orbitale wiążące sp2 są skierowane ku wierzchołkom trójkąta, w wierzchołkach którego znajdują się atomy wodoru,
wszystkie atomy tworzące cząsteczkę zawierają się w jednej płaszczyźnie,
w cząsteczce występuje tylko zdelokalizowane wiązanie podwójne.
Atom węgla numer 2 w cząsteczce 2-metylopentanu jest:
pierwszorzędowym atomem węgla,
drugorzędowym atomem węgla,
trzeciorzędowym atomem węgla,
pięciorzędowym atomem węgla.
Zgodnie z reguła Hückla chmury zdelokalizowanych elektronów π powyżej i poniżej płaszczyzny pierścienia (pierścieni) aromatycznego musi zawierać:
3n+2 elektrony π,
4n+2 elektrony π,
5n+2 elektrony π,
nieparzystą liczbę elektronów π.
Które z opisów dotyczących budowy cząsteczki benzenu są prawdziwe:
cząsteczka benzenu jest płaska - wszystkie atomy węgla i wodoru zawierają się w jednej płaszczyźnie,
cząsteczka benzenu jest bardzo symetryczna - każdy atom węgla leży w wierzchołku sześciokąta foremnego, a każdy kąt między wiązaniami wynosi 120°,
ze względu na wysoki stopień symetrii i charakter aromatyczny cząsteczki - pierścień utworzony z sześciu atomów węgla nie jest trawały,
oprócz trzech orbitali zhybrydyzowanych sp2 każdy z atomów węgla dysponuje jeszcze orbitalem p. Składa się on z dwóch równych pętli - jednej leżącej powyżej, a drugiej poniżej płaszczyzny, w której znajdują się trzy pozostałe orbitale.
Na rysunku przedstawiono w sposób uproszczony budowę przestrzenną:
heksenu,
heksynu,
cykloheksanu,
benzenu.
Zadania
Rozpisz strukturę elektronową atomu chloru o liczbie atomowej 17 (powłoki, orbitale, wzór klatkowy, elektrony walencyjne).
Uzgodnij współczynniki stechiometryczne następującej reakcji chemicznej:
MnO4 - + Fe2+ + H3O+ ↔ Mn2+ + Fe3+ + H2O
Napisz reakcje połówkowe wskaż utleniacz i reduktor.
TEST 2
Pierwiastki o konfiguracji elektronowej powłoki walencyjnej ns2 należą do grupy:
litowców,
berylowców,
grupy 13,
w bloku p układu okresowego pierwiastków.
Długość promienia atomów wraz ze wzrostem liczby atomowej w obrębie jednego okresu układu okresowego pierwiastków:
rośnie,
maleje,
nie zmienia się,
najpierw rośnie dla pierwiastków bloku s, a następnie maleje.
Wartości liczbowe elektroujemności pierwiastków rozmieszczonych w układzie okresowym wykazują następujące kierunki zmian tego parametru w okresach i grupach:
wzrastają w okresie wraz ze zwiększaniem się liczby atomowej pierwiastka i maleją w grupach wraz ze zwiększaniem się liczby powłok elektronowych,
maleją w okresie wraz ze zwiększaniem się liczby atomowej pierwiastka i maleją w grupach wraz ze zwiększaniem się liczby powłok elektronowych,
maleją w okresie wraz ze zwiększaniem się liczby atomowej pierwiastka i wzrastają w grupach wraz ze zwiększaniem się liczby powłok elektronowych,
wzrastają w okresie wraz ze zwiększaniem się liczby atomowej pierwiastka i wzrastają w grupach wraz ze zwiększaniem się liczby powłok elektronowych.
Które stwierdzenie(a) dotyczą opisu budowy etenu:
w wyniku kombinacji czterech orbitali atomowych powstają cztery orbitale zhybrydyzowane,
w całej cząsteczce występują trzy pojedyncze wiązania δ i dwa podwójne wiązania π,
kąty między wiązaniami δ wynoszą po 180°,
wiązanie podwójne powstaje przez nałożenie boczne orbitali s.
Orbitale π są słabiej wiążące niż orbitale δ gdyż:
elektrony wiązania π nie są sparowane,
powstaniu orbitalu π każdorazowo towarzyszy powstanie orbitalu antywiążącego π*,
maksimum ich nakładania znajduje się poza osią łączącą atomy tworzące wiązanie,
w powstaniu wiązania π mają swój udział elektrony rdzeniowe.
Punkt potrójny na diagramie fazowym:
odpowiada takim warunkom, w których w układzie istnieją trzy różne fazy jednocześnie,
jest punktem przecięcia rzutu prostopadłego temperatury krytycznej na oś temperatury,
odpowiada warunkom normalnym,
jest punktem przecięcia dwóch linii równowagi faz.
W reakcji HSO4 - + H2O → SO42- + H3O+ , anion SO42- jest:
solą,
kwasem sprzężonym z zasadą HSO4 -,
utleniaczem,
reduktorem.
Katalizator to substancja, która:
przyspiesza reakcję chemiczną, ale nie ulega przy tym zmianie,
jest substratem reakcji,
rola polega na obniżeniu energii aktywacji,
powstaje jako produkt reakcji heterolitycznego rozpadu wiązania.
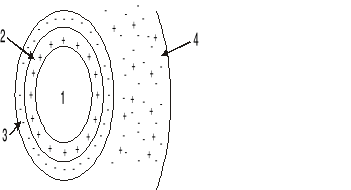
Reakcja
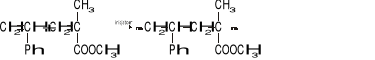
jest przykładem reakcji:
polimeryzacji,
wymiany jonowej,
kopolimeryzacji,
Fentona.
Kwas chlorowy (VII) H2SO4 jest:
mocną zasadą,
słabym elektrolitem,
substancją nie ulegającą procesom dysocjacji,
substancją ulegającą procesom dysocjacji tylko w niewielkim stopniu.
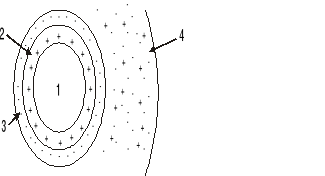
Na rysunku przedstawiono model cząsteczki koloidu.
Cyfry zamieszczone na rysunku oznaczają:
polimolekularne jądro, 2 - zaadsorbowana warstwa przeciwjonów, 3 - zaadsorbowana warstwa jonów potencjałotwórczych, 4 - powłoka dyfuzyjna.
1- polimolekularne jądro, 2 - zaadsorbowana warstwa jonów potencjałotwórczych, 3 - zaadsorbowana warstwa przeciwjonów, 4 - powłoka dyfuzyjna.
1- polimolekularne jądro, 2 - powłoka dyfuzyjna, 3 - zaadsorbowana warstwa jonów potencjałotwórczych, 4 - zaadsorbowana warstwa przeciwjonów,
1+2+3 - granulę, 1+2+3+4 - micelę.
Zdolność wymienna robocza jonitu oznacza:
objętość roztworu jaką można przepuścić przez jednostkową ilość jonitu do momentu przebicia złoża jonowymiennego,
maksymalny przepływ roztworu przez jednostkową ilość jonitu jaki można ustawić bez pogorszenia efektywności procesu wymiany jonowej,
liczba mikrogramorównoważników przeciwjonów, które są wymieniane przez jednostkową ilość jonitu do momentu przebicia złoża jonowymiennego,
objętość roztworu jaką trzeba przepuścić przez złoże jonowymienne w celu jego regeneracji.
Atom węgla numer 4 w cząsteczce 3-etylo-4,4-dimetylooktan jest:
pierwszorzędowym atomem węgla,
drugorzędowym atomem węgla,
trzeciorzędowym atomem węgla,
czwartorzędowym atomem węgla.
Napięcie kątowe Baeyera występuje w cząsteczce:
cyklopropanu,
benzenie,
cyklobutanie,
heksanie.
Zgodnie z nazewnictwem systematycznym wg IUPAC, nazwy alkoholi tworzy się przez dodanie do nazwy odpowiedniego alkanu, stanowiącego strukturę podstawową końcówkę:
-al.,
-on,
en,
-yn.
Przemianie węgla
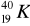
w azot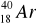
towarzyszy emisja:promieniowania α,
promieniowania β,
promieniowania γ,
fali uderzeniowej.
Zadania
Rozpisz strukturę elektronową atomu żelaza o liczbie atomowej 26 (powłoki, orbitale, wzór klatkowy, elektrony walencyjne).
Uzgodnij współczynniki stechiometryczne następującej reakcji chemicznej (Napisz reakcje połówkowe wskaż utleniacz i reduktor):
J - + Cl2 ↔ Cl- + J2
Napisz wzór na iloczyn rozpuszczalności dla: Ca3(PO4)2
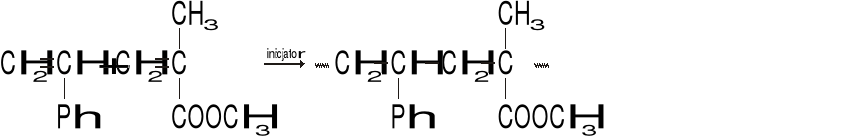
Wyszukiwarka
Podobne podstrony:
testy 1rok egz2, Inżynieria Środowiska PW semestr I, chemia, sesja
11. testy 1rok v4, Inżynieria Środowiska PW semestr I, chemia, sesja
9. testy 1rok v4a, Inżynieria Środowiska PW semestr I, chemia, sesja
10. testy 1rok egz6, Inżynieria Środowiska PW semestr I, chemia, sesja
testy 1rok egz3, Inżynieria Środowiska PW semestr I, chemia, sesja
12. testy 1rok egz4, Inżynieria Środowiska PW semestr I, chemia, sesja
16. egzamin test 1rok, Inżynieria Środowiska PW semestr I, chemia, sesja
13. egzamin 17 09 04, Inżynieria Środowiska PW semestr I, chemia, sesja
SESJA ZIMOWA 2006, Inżynieria Środowiska PW semestr I, chemia, sesja
zestawy 28 pyt Ai B mini, Inżynieria Środowiska PW semestr I, chemia, sesja
wszystkie pytania - ciąg - sciąga - długopisy, Inżynieria Środowiska PW semestr I, chemia, sesja
egzamin test v3, Inżynieria Środowiska PW semestr I, chemia, sesja
sciaga chemia, Inżynieria Środowiska PW semestr I, chemia, sesja
egzamin 2004sciaga, Inżynieria Środowiska PW semestr I, chemia, sesja
więcej podobnych podstron