POLITECHNIKA LUBELSKA |
Temat: Oznaczanie zawartości siarczkowodoru metodą jodometryczną. |
Student:
|
|
LABORATORIUM INŻYNIERII EKOLOGICZNEJ |
|
Grupa: MD102.6b |
Data wyk. 14.03.02r. |
|
|
Data i podpis:
|
Ocena: |
Cel ćwiczenia:
Celem ćwiczenia jest poznanie metody wyznaczania stopnia zanieczyszczenia siarczkowodorem H2S w gazach.
Spis literatury:
WiatrI. Inżynieria ekologiczna wyg. PTIE Warszawa-Lublin 1995r.
Warych J. Oczyszczanie gazów. Procesy i aparatura. WNT Warszawa 1998r.
Praca zbiorowa pod redakcją I. Trzepierczyńskiej -Fizykochemiczna analiza zanieczyszczeń powietrza. Wyd. Politechniki Wrocławskiej, Wrocław 1997.
Przebieg ćwiczenia:
Oznaczanie polega na absorpcji siarczkowodoru w roztworze octanu cynkowego. W wyniku reakcji H2S z octanem cynkowym wytrąca się trudno rozpuszczalny w wodzie siarczan cynkowy ZnS.
![]()
Z kolei osad ZnS rozkłada się za pomocą kwasu HCl, z uwalniany siarczkowodór utlenia się nadmiarem roztworu jodu o znanym stężeniu: ![]()
![]()
Nadmiar jodu miareczkuje się mianowanym roztworem tiosiarczanu sodowego wg reakcji: ![]()
. Stężenie siarczkowodoru w badanym gazie lub powietrzu obliczamy ze wzoru:
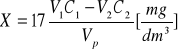
gdzie V1 oznacz objętość roztworu jodu cm3
c1 - stężenie roztworu jodu,
V2 -Objętość roztworu tiosiarczanu sodowego cm3,
c2 -stężenie roztworu tiosiarczanu sodowego ![]()
Vp -objętość gazu pobrana do analizy dm3 (val -ilość substancji w reakcji chemicznej równoważnej 1 molowi elektronów).
Przebieg ćwiczenia.
a). Szkic aparatury pomiarowej.
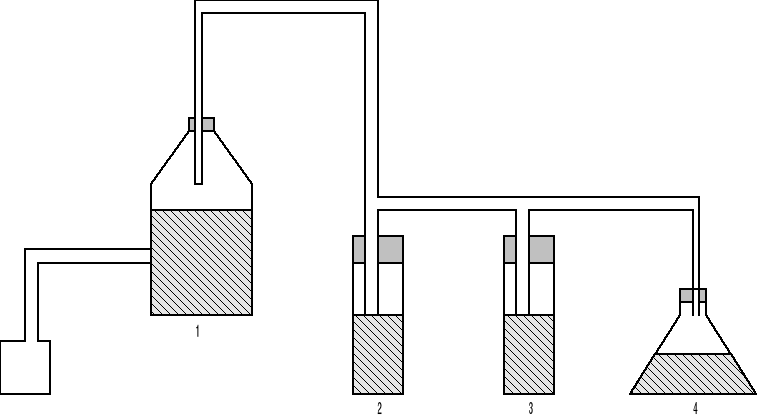
rys1. 1Schemat stanowiska pomiarowego.
1 -butla z bocznym tubusem
2 -zestaw płuczek
4 -stożkowa kolba
5 -biureta duża pipeta miarowana od góry.
Spis roztworów użytych w doświadczeniu:
Kwas solny rozcieńczony 1:1
1% roztwór skrobi.
Roztwór jodu
Roztwór octanu cynkowego
Roztwór tiosiarczanu sodowego.
b). Wykonanie pomiarów.
Na początku ćwiczenia butla z bocznym tubusem 1 wypełniona jest wodą, brak w niej jest siarkowodoru. W każdej z płuczek 2 i 3 znajduje się 50ml octanu cynkowego. Następnie wypuszczamy wodę z butli (powolny proces) przy jednoczesnym nasycaniu siarkowodoru w płuczkach, prowadząc do jego mętnienia. Im bardziej jest on mętny, tym więcej zaabsorbowano siarczkowodoru. W stożkowej kolbie znajduje się wówczas H2O, K2S, H2S. Po zakończeniu pobierania gazu odłączamy płuczki, również rozłączając je od siebie. Do każdej z nich dodajemy dokładnie odmierzoną ilość mianowanego roztworu jodu (20-40)ml. Roztwór zmienił barwę. Następnie do każdej z płuczek dodajemy po 2,5 ml kwasu solnego, mieszamy dokładnie i przenosimy ilościowo zawartość obydwu płuczek do stożkowej kolby. Pozostały po utlenieniu siarczkowodoru jod miareczkujemy roztworem tiosiarczanu, dodając pod koniec miareczkowania 2 ml roztworu skrobi jako indykatora.
Wyniki pomiaru
Vp=1320cm3=1,32dm3
V1=40cm3
V2=26,7cm3
c1=0,01n
c2=0,01n
c1= c2=c
Obliczenie stężenia SH2S
![]()
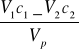
=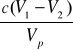
![]()
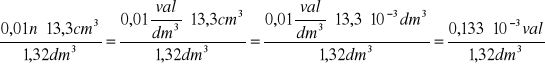
w jednostce masy:
MH2S=34g
SH2S=17.![]()
34g![]()
1712,87 . 10-3g ![]()
x
x=![]()
W jednostkach ppm:
1ppm![]()
10-6m3
y![]()
1128 . 10-3 m3
y=![]()
Wnioski:
W ćwiczeniu tym dokonaliśmy pomiaru stopnia zanieczyszczenia metodą jodometryczną. W metodzie tej butla z bocznym tubusem wypełniona jest wodą, brak w niej jest siarkowodoru. W każdej z płuczek znajduje się 50ml octanu cynkowego. Następnie wypuszczamy wodę z butli (powolny proces) przy jednoczesnym nasycaniu siarkowodoru w płuczkach, prowadząc do jego mętnienia. Im bardziej jest on mętny, tym więcej zaabsorbowano siarczkowodoru. W stożkowej kolbie znajduje się wówczas H2O, K2S, H2S. Po zakończeniu pobierania gazu odłączamy płuczki, również rozłączając je od siebie. Do każdej z nich dodajemy dokładnie odmierzoną ilość mianowanego roztworu jodu (20-40)ml. Roztwór zmienił barwę. Następnie do każdej z płuczek dodajemy po 2,5 ml kwasu solnego, mieszamy dokładnie i przenosimy ilościowo zawartość obydwu płuczek do stożkowej kolby. Pozostały po utlenieniu siarczkowodoru jod miareczkujemy roztworem tiosiarczanu, dodając pod koniec miareczkowania 2 ml roztworu skrobi jako indykatora.
Wyszukiwarka
Podobne podstrony:
Oznaczanie zawartości siarkowodoru (siarczków) metodą jodometryczną”, Inżynieria Ekologiczna, Sprawo
Oznaczanie tlenu rozpuszczonego w wodzie metodą Winklera, Inżynieria Ekologiczna, Sprawozdania
Oznaczanie stopnia zapylenia powietrza atmosferycznego. (2), Inżynieria Ekologiczna, Sprawozdania
Oznaczanie stopnia zapylenia powietrza atmosferycznego, Inżynieria Ekologiczna, Sprawozdania
Oznaczanie mętności (przezroczystości), Inżynieria Ekologiczna, Sprawozdania
Oznaczanie mętności (przezroczystości), Inżynieria Ekologiczna, Sprawozdania
Polarymetryczne oznaczanie zawartości skrobi, Tż, Analiza żywności II, Sprawozdania
Koagulacja(1), Inżynieria Ekologiczna, Sprawozdania
Oznaczenie twardości ogólnej metodą werenianową, inżynieria ochrony środowiska kalisz, Analiza Chemi
Właściwości fizykochemiczne wody, Inżynieria Ekologiczna, Sprawozdania
Oznaczanie zawartości tłuszczu metodą Soxhleta, Studia, UTP Ochrona środowiska, IV rok, Semestr VII,
Koagulacja i sedymentacja jako metody uzdatniania wody i oczyszczania ścieków, Inżynieria Ekologiczn
Koagulacja, Inżynieria Ekologiczna, Sprawozdania
Segregacja odpadów i śmieci, Inżynieria Ekologiczna, Sprawozdania
Oznaczenie stopnia zapylenia powietrza atmosferycznego, Inżynieria Ekologiczna
ILOŚCIOWE OZNACZENIE ZAWARTOŚCI WITAMINY C METODĄ WOLTAMPEROMETRII CYKLICZNEJ
7 Analiza żywności oznaczanie zawartości witaminy C metodą miareczkową
Polarymetryczne oznaczanie zawartości skrobi, Tż, Analiza żywności II, Sprawozdania
więcej podobnych podstron