Politechnika Lubelska Wydział Mechaniczny |
Temat:
„Oznaczanie zawartości siarkowodoru (siarczków) metodą jodometryczną” |
Wykonał:
|
|
Laboratorium Inżynierii Ekologicznej
|
|
Grupa:
MD102.1d
|
Data wykonania: 27.03.2003r.
|
Data: |
Ocena: |
Podpis: |
|
1. Wstęp teoretyczny:
Siarkowodór, H2S, sulfan, siarczek wodoru, jest bezbarwnym gazem (o zapachu przypominającym zgniłe jaja), dobrze rozpuszczalny w wodzie, tworzy wodę siarkowodorową lub - w większych stężeniach - kwas siarkowodorowy. Jrgo temperatura wrzenia wynosi 60,3°C.
Siarkowodór jest reduktorem. Znane są wielo siarkowodory o wzorze H2Sx, gdzie x=2÷8. Siarkowodór ma silne działanie toksyczne.
Można go otrzymać działając kwasami (lub niekiedy wodą) na siarczki. Stosowany jest do produkcji kwasu siarkowego, w laboratorium jako odczynnik chemiczny.
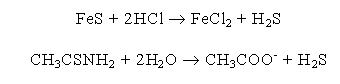
W laboratorium H2S otrzymywany jest zazwyczaj w aparacie Kippa w wyniku działania kwasem solnym na siarczek żelaza (II). Zawiera on często zanieczyszczenia wodorem, ponieważ handlowy FeS otrzymywany jest przez stapianie siarki z opiłkami żelaza i zawiera zwykle nieco nie przereagowanego żelaza, wydzielającego wodór z kwasu solnego. H2S powstaje także podczas hydrolizy amidu kwasu tiooctowego w środowisku kwaśnym lub zasadowym (własność ta wykorzystywana jest podczas oznaczania kationów grupy III i IV (siarkowodór w chwili powstania wytrąca charakterystyczne osady właściwych siarczków).
Najwyższe dopuszczalne stężenie w środowisku pracy wynosi 10 mg/l, a chwilowe 20 mg/l. Siarkowodór wchłania się łatwo przez płuca a jedynie w małym stopniu przez skórę. Wydala się częściowo w postaci nie zmienionej przez płuca, a także, po utlenieniu w organizmie do kwasu siarkowego, wydala się z moczem w postaci wolnych lub sprzężonych siarczanów. Część H2S rozkłada się we krwi i tkankach z wydzieleniem siarki, która z nie rozłożonym siarkowodorem tworzy wielosiarczki.
Siarkowodór wchłania się łatwo przez płuca a jedynie w małym stopniu przez skórę. Wydala się częściowo w postaci nie zmienionej przez płuca, a także, po utlenieniu w organizmie do kwasu siarkowego, wydala się z moczem w postaci wolnych lub sprzężonych siarczanów. Część H2S rozkłada się we krwi i tkankach z wydzieleniem siarki, która z nie rozłożonym siarkowodorem tworzy wielosiarczki.
Powietrze jest mieszaniną gazów o składzie -78% azotu, 21% tlenu oraz 1% to gazy szlachetne , dwutlenek węgla i para wodna. Szacuje się, że w Polsce ogólna emisja zanieczyszczeń gazowych wyniosła w 1994 r. co najmniej 10 mln t, w tym siarkowodoru (H2S) - 9 tyś. ton.
Źródła siarkowodoru:
Naturalne |
Antropogeniczne (działalność człowieka) |
-wulkany (gaz bezbarwny, palny) -rozkład materii organicznej (głównie białek) -naturalne wody siarkowe -gazy fizjologiczne -złoża siarkowe -w niektórych gatunkach ropy naftowej i gazu ziemnego |
-wysypiska śmieci (składowiska odpadów) -kopalnie siarki -przemysł chemiczny -przemysł spożywczy -kopalnie węgla -hodowla zwierząt - motoryzacja i spaliny samochodowe (brak pełnej sprawności katalizatora) |
2. Zasada na podstawie, której oznaczamy siarkowodór
Oznaczenie siarkowodoru metodą jodometryczną polega na absorpcji siarkowodoru H2S w roztworze octanu cynkowego Zn(CH3COOH)2. W wyniku tej reakcji wytrąca się trudno rozpuszczalny w wodzie wielosiarczek cynkowy ZnS.
![]()
Osad ZnS rozkłada się za pomocą kwasu solnego HCl. Uwolniony siarkowodór utlenia się z roztworem jodu, o znanym stężeniu siarkowodoru.
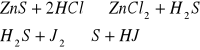
Nadmiar jodu odmiareczkowuje się mianowanym roztworem tiosiarczanu sodowego.
![]()
Stężenie siarkowodoru w badanym gazie odpadowym lub powietrzu obliczamy ze wzoru:
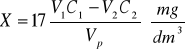
gdzie:
V1- objętość roztworu jodu cm3,
C1- stężenie roztworu jodu ![]()
,
V2- objętość roztworu tiosiarczanu sodowego cm3,
C2- stężenie roztworu tiosiarczanu sodowego ![]()
,
Vp- objętość gazu pobrana do analizy cm3,
3.Wykonanie badania:
Przebieg badania:
Do naczynia wlewamy kwas solny, octan cynkowy, roztwór jodu, roztwór tiosiarczanu sodowego i jedno procentowy roztwór skrobia, (źródłem siarkowodoru jest reakcja miedzy wielosiarczkiem potasu i kwasem octowym).
1.Do płuczek wlewamy 2,5 cm3 wielosiarczku potasu i działamy na to kwasem octowym (2,5 cm3 )
2.Napełniamy płuczki octanem cynkowym po 50 cm3 do każdej z nich.
3. zamykamy szczelnie płuczki i sprawdzamy drożność połączeń
4.pobieramy siarkowodór który się wydzielił podczas reakcji (K2Sn+CH3COOH=H2S+COOK, ilość pobranego siarkowodoru wynosi 500 cm3 )
5.Dodajemy do dwóch płuczek roztwór jodu, po 20 cm3 do każdej, następnie dodajemy po 2,5ml kwasu solnego, mieszamy i odlewamy do jednej z płuczek. (w przypadku za małej ilości jodu, która można poznać po utracie barwy dodajemy drugi raz po 20 cm3 jodu)
6.dodajemy do powstałej mieszaniny jeden ml skrobi i po jednej kropelce tiosiarczanu, aż się zacznie zmieniać kolor z fioletowego na mętny, dla sprawdzenia można dodać roztworu skrobi
7.zauważamy, że jod przereagował z tiosiarczanem i , że zeszło 2,3ml tiosiarczanu
Uwagi: po każdym odczynniku należy przepłukać używane narzędzia
obliczenia
V1= 80cm3=0,08dm3
C1= 0,01![]()
V2=2,3cm3=0,0023dm3
C2=0,01![]()
Vp=500cm3=0,5dm3
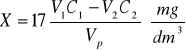
4.Schemat stanowiska
Niezbędne naczynia i urządzenia:
1.zestaw do pobierania i dokładnego odmierzania objętości badanego gazu
2.układ płuczek
3.zestaw do miareczkowania: biureta, pipeta jednomiarowa, pipeta wielomiarowa, kolby stożkowe, tryskawka, statyw z uchwytami
5. Wnioski:
Wnioski:
Nazwa substancji |
Dopuszczalne stężenie zanieczyszczeń w μg/m3 |
|||||
Siarkowodór |
Obszary |
Obszary specjalnie chronione |
||||
|
30min |
24h |
średniorocznie |
30min |
24h |
średniorocznie |
|
30,0 |
5,0 |
1,0 |
4,0 |
1,0 |
0,5 |
Zawartość siarkowodoru w powietrzu podczas pomiaru była o wiele większa, niż w porównaniu z normami w Polsce na stan 12.02.1990r.
1
Wyszukiwarka
Podobne podstrony:
Oznaczanie zawartości siarczkowodoru metodą jodometryczną, Inżynieria Ekologiczna, Sprawozdania
Oznaczanie tlenu rozpuszczonego w wodzie metodą Winklera, Inżynieria Ekologiczna, Sprawozdania
Oznaczanie zawartości laktozy w mleku metodą Bertranda 1, Tż, Analiza żywności II, Sprawozdania
OZNACZANIE ZAWARTOŚCI BIAŁKA W MLEKU METODĄ KJELDAHLA, Chemia analityczna
Oznaczenie zawartości próchnicy w glebie metodą Tiurina, niezbędnik rolnika 2 lepszy, Gleboznawstwo,
Oznaczanie mętności (przezroczystości), Inżynieria Ekologiczna, Sprawozdania
Oznaczanie zawartosci laktozy w mleku metoda Bertranda, Tż, Analiza żywności II, Sprawozdania
Oznaczanie mętności (przezroczystości), Inżynieria Ekologiczna, Sprawozdania
Oznaczanie zawartosci laktozy w mleku metoda Bertranda KSZ, Tż, Analiza żywności II, Sprawozdania
Oznaczanie stopnia zapylenia powietrza atmosferycznego. (2), Inżynieria Ekologiczna, Sprawozdania
Oznaczanie stopnia zapylenia powietrza atmosferycznego, Inżynieria Ekologiczna, Sprawozdania
Oznaczanie zawartosci azotu ogolnego metoda Kofranyi, Tż, Analiza żywności II, Sprawozdania
Oznaczanie zawartosci azotu ogolnego metoda Kofranyi, Tż, Analiza żywności II, Sprawozdania
Ćw 3, AGH, SEMESTR 4, CHEMIA ŚRODOWISKA, 3. Oznaczanie zawartości siarki w węglu metodą Eschki
Koagulacja(1), Inżynieria Ekologiczna, Sprawozdania
Właściwości fizykochemiczne wody, Inżynieria Ekologiczna, Sprawozdania
Koagulacja i sedymentacja jako metody uzdatniania wody i oczyszczania ścieków, Inżynieria Ekologiczn
Koagulacja, Inżynieria Ekologiczna, Sprawozdania
więcej podobnych podstron