Temat: SKAŻENIA RADIOAKTYWNE ŚRODOWISKA
jednostki, pojęcia, wzory, sytuacje w środowisku wpływające na zdrowie człowieka, jakie zmiany powodują
- Izotopy promieniotwórcze występują w skorupie ziemskiej od początku istnienia naszej planety razem z promieniowaniem kosmicznym.
- Historia badań nad promieniotwórczością:
*Becquerel
*Maria Curie Skłodowska i G.C.Schmidt
*Piotr Curie
*Otto Wolknoff
*Franciszek Fojdis
*Soddy Frederick
*Ernest Rutherord
*Fryderyk i Irena Joliot Curie
*Otto Hohn I F.Strassmann
*Enrico Fereni
Zjawisko promieniotwórczości - polega na spontanicznej przemianie jąder atomowych danego pierwiastka na jądra atomowe innego pierwiastka z równoczesnym wypromieniowaniem cząstekα (alfa) na β(beta). Rozpadowi temu towarzyszy najczęściej promieniowanie natury elektromagnetycznej zwane promieniowaniem γ (gamma).
Rozróżniamy 3 typy promieniowania naturalnego:
Promieniowanie α
Jest to emisja jądrowa atomu helu, skutkiem, czego jądro jądro pierwiastka promieniotwórczego przekształca się w jądro innego pierwiastka (szybko poruszając się dwukrotnie zjonizowane jądra helu He o liczbie atomowej Z-2 i masowej A-4 w polu elektrycznym są odchylone w stronę bieguna ujemnego).
![]()
2. Promieniowanie beta β ma charakter złożony:
a) promieniowanie β- emisja elektronów
![]()
W jądrze atomowym zachodzi przemiana neutronu w proton:
b) promieniowanie β+ emisja pozytywna
![]()
W jądrze atomowym zachodzi przemiana protonu w neutron:
![]()
Następuje również emisja cząstek zwanych NEUTRINEM (beta plus) lub ANTYNEUTRINEM (beta minus) .
NEUTRINA- cząsteczki elektryczne obojętne o masie spoczynkowej……….
3. Promieniowanie gamma γ- o dużej przenikliwości nie ulega wpływowi pola elektrycznego. Promieniowanie γ jest promieniowaniem elektromagnetycznym towarzyszącym przemianom (α i β) i nigdy nie występuje samodzielnie. Powstałe porozpadowo α lub β jądra atomowe są najczęściej w stanie wzbudzonym. Nadmiar energii wypromieniowują w postaci kwantu promieniowania promieniowania elektromagnetycznego będącego promieniowaniem γ
![]()
![]()
Zatem foton γ
PODSTAWOWE POJĘCIA
IZOTOP- (gr. izos topos) odmiana atomu pierwiastka chemicznego o liczbie atomowej Z
(równej liczbie protonów), różniąca się liczbą neutronów w jądrze
A=Z+N
AKTYWNOŚĆ- wielkość, która określa liczbę przemian lub rozpadów zachodzących w danej ilości substancji promieniotwórczej.
Jednostką aktywności jest bekerel (Bq)
1Bq- jedna przemiana lub rozpad na sekundę 1Bq=1s
Dawną jednostką aktywności jeszcze dotychczas używaną jest kiur (C)
1Ci=3,7x10 s =3,7x10 Bq=37G Bq
OKRES POŁOWICZNEGO ZANIKU (ROZPADU)- to czas, w jakim rozpadnie się połowa atomów danego radioizotopu. Przyjmuje się, że całkowity rozpad danego izotopu następuje po czasie 5xT ½, czyli gdy jego aktywność spadnie do poziomu 1/32aktywności początkowej. Okres połowicznego rozpadu (zaniku) waha się od ułamka sekundy do miliardów lat.
![]()
T- czas połowicznego zaniku (rozpadu)
Znak”-„ określa ubytek jąder atomu izotopu promieniotwórczego
![]()
N- liczba jąder w chwili t
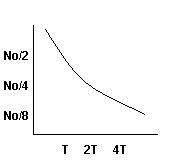
![]()
No - liczba jąder w chwili to
![]()
Wykres funkcji rozpadu promieniotwórczego:
Liczba promieniotwórczych jąder N(+) zmniejsza się w czasie t.
DAWKA EKSPOZYCYJNA- ładunek, który został wytworzony przez promieniowanie jonizujące w jednostce masy danego ciała.
Jest miarą jonizacji, jaka zachodzi w powietrzu pod wpływem promieniowania elektromagnetycznego X lub Y.
X=dQ/dm (Ckg-1)
Gdzie:
dQ - jest bezwzględną wartością sumy ładunków pierwiastków jednego znaku wytworzonych w warunkach równowago elektromagnetycznej.
Stara jednostka - rentgen ( R )
1 R= 2,58x10 Ckg-1
MOC DAWKI EKSPOZYCYJNEJ- stosunek wartości tej dawki do czasu, w którym została otrzymana. Moc dawki jest to wielkość opisująca szybkość napromieniowania.
Px=TA/r2
A-aktywność źródła
T- stała ekspozycyjna
r- odległość od punktowego źródła promieniowania
DAWKA POCHŁONIĘTA- miara pochłaniania promieniowania przez różne materiały; energia, jaką traci promieniowanie, pochłania ośrodek, przez który promieniowanie przechodzi, przypadająca na jednostkę masy tego ośrodka.
P=dE/dm 1Gy=1Jkg-1
dE- średnia promieniowania jonizującego przekazana materii w elemencie objętości o masie dm
stara jednostka - rad (rd)
1rd=,01 Gy
MOC DAWKI POCHŁONIĘTEJ Gy/s lub Gy/h albo rd/h
RÓWNOWAŻNIK DAWKI (Hr)-dawka równoważna, pochłonięta w danej tkance lub narządzie T z uwzględnieniem skutków biologicznych wywołanych przez różne rodzaje promieniowania.R
Hr= HrR1 + HrR2 + … [Sv] 1 Sv = 100 rem
Gdzie:
Wp- współczynnik wagowy promieniowania uwzględniający wielkość niszczącego wpływu biologicznego na tkankę promieniowania określonego rodzaju
DTR - dawka pochłonięta od promieniowania R uśredniona w tkance lub narządzie T.
DEFINICJA DAWKI SKUTECZNEJ (EFEKTYWNEJ) E
Suma wszystkich dawek równoważnych od napromieniowania zewnętrznego i wewnętrznego we wszystkich tkankach i narządach z uwzględnieniem odpowiednich współczynników wagowych narządów lub tkanek, obrazująca narażenie całego ciała.
E= (WT1*H1 + WT2*H2+….)
WT- współczynnik wagowy narządu lub tkanki T, współczynnik określający wrażliwość tkanki lub narządu
DAWKA LETALNA (LD 50)
Jednostkowe dawki promieniowania wywierają na różne organizmy różne skutki. DL określa się dla danej populacji i jest to jednorazowa dawka promieniowania, jaka jest potrzebna do zgonu 50% osobników danej populacji w ciągu 3 dni od napromieniowania.
Np. organizm LD 50/30 (Su)
Człowiek 3-4
Małpa 5-6
Osioł 7-8
Mucha 800
Pantofelek 3000
DAWKA L 100% (LD 100)
Najmniejsza dawka promieniowania powodująca zgon 100% organizmów danej populacji w 3 dni od ekspozycji jednorodnej.
RADIOAKTYWNOŚĆ NATURALNA
- jedna z cech ziemskiego środowiska, ślad ewolucji geochemicznej wszechświata i Układu Słonecznego pierwiastków chemicznych występujących w środowisku jako mieszanina izotopów.
- istnieją 272 stabilne izotopy oraz ok.2000 izotopów promieniotwórczych (radioizotopów), z czego w przyrodzie występuje 88 radioizotopów. Większość izotopów występujących w skorupie ziemskiej to radioizotopy o liczbie masowej A >210.
- biorąc pod uwagę pochodzenie izotopy dzieli się na:
-pierwotne
-wtórne
-kosmogenne
Pierwotne izotopy promieniotwórcze:
-okres połowicznego zaniku T1/2>0,5 mld lat
-powstały razem ze stabilnymi izotopami tworzącymi planety Układu Słonecznego i nie zdążyły się jeszcze rozpaść (tor ).
Wtórne izotopy promieniotwórcze:
-pochodzą z rozpadu izotopów pierwotnych (ponad 30 izotopów), np.: rad, ołów, radon, polon
Kosmogenne izotopy promieniotwórcze:
-ponad 10 izotopów lekkich pierwiastków powstających nieustannie w górnych warstwach atmosfery ziemskiej pod wpływem promieniowania kosmicznego, np.: beryl, wodór, tryt.
-Tryt występuje w środowisku naturalnym jako izotopy naturalne oraz wytworzone w wyniku działalności człowieka, np.: woda, 3H2O, 3HHO, woda trytowa
ZAGROŻENIA RADIOAKTYWNE
-Działalność przemysłowa, powstawanie odpadów
-Wydobycie fosforanów i im podobnych
-Doświadczalne, próbne wybuchy jądrowe
-Produkcja broni jądrowej, energetyka jądrowa
-Awarie powstałe w centrach naukowo badawczych, na okrętach o atomowym …….
-W samochodach przenoszących broń jądrową, czy w czasie transportu drogowego
-Wydobywanie się gazów promieniotwórczych z kopalni uranu
-Procesy regeneracyjne paliwa jądrowego
-Zbiorniki zawierające odpady promieniotwórcze
-Źródło naturalne, np.: prądu działanie techniczne
-Przemysł, którego działanie ciągnie za sobąduże niebezpieczeństwo dla Środowiska naturalnego
ZASTOSOWANIE POSZCZEGÓLNYCH IZOTOPÓW
+wodór
+polon
+rad
+tor
+uran
+sód
+krzem
+fosfor
+potas
+kobalt
RADIOTOKSYCZNOŚĆ (szkodliwość substancji promieniotwórczych dla organizmu) zależy od:
-energii i rodzaju emitowanego przez daną substancję promieniowania
-jego czasu połowicznego rozpadu
-metabolicznego obiegu danego pierwiastka chemicznego
-współczynnika jego wchłaniania do organizmu
-czasu połowicznego półtrwania w organizmie
PODZIAŁ pierwiastków promieniotwórczych wg klasy toksyczności:
I klasa radiotoksyczności- najgroźniejsze substancje, np. alfapromieniotwórcze izotopy wodoru,
II klasa radiotoksyczności- to typowych produktów rozszczepienia skażających środowisko, np. izotopy jodu, cezu
III -IV klasa to mniej szkodliwe substancje
W trakcie badań klas radiotoksyczności określa się maksymalne poziomy zawartości zw. org. Oraz roczne limity wchłonięć.Izotopy radu występujące w przyrodzie (tabela)
Uszkodzenia:
+ Jonizacja- powstanie wolnych rodników powodujących zmianę przebiegu biologicznych procesów w komórce
+Dysocjacja- zmiany tymczasowe- radioliza, polimeryczne utlenianie
Uszkodzenia biologii:
+Zmiana przepuszczalności błon komórkowych
+Pękanie chromosomów
+Działanie
Skutki medyczne:
-zaburzenia w tkance chłonnej, szpiku
-zaburzenia w wydzielaniu hormonów
-zmętnienie w soczewce oka
-trudno gojące się poparzenia i rany
-zapalne zmiany czynnościowe przewodu pokarmowego
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Wyszukiwarka
Podobne podstrony:
Płyn Lugola SKAŻENIE RADIOAKTYWNE !
Góry Sowie - opis kompleksu, IOR nowe, Turystyka
BHP w sprawie szczegółowych zasad ochrony przed promieniowaniem szkodliwym dla ludzi i środowiska, d
11 Skazenie radioaktywne jod plyn Lugola 2011 03 28
Skażenie promieniotwórcze środowiska definicje
07 04 Materialy promieniotworcze i radioaktywne
Ćw mineralizacja, Studia, UTP Ochrona środowiska, IV rok, Semestr VII, Skażenia surowców pochodzenia
Nowe media jako środowisko wychowawcze (Pedagogika społeczna), Pedagogika, Studia stacjonarne I sto
To będzie nasze nowe sprawko xD, Inżynieria Środowiska PŚk, Semestr 2, Inżynieria Elektryczna
Wyznaczanie współczynnika absorpcji , Uczelnia, sem I, fiza, LABORATORIUM, Nowe laborki, promienie
Czarnobyl skazenie srodowiska
Procedury postępowania przy zagrożeniach skażeniami i zakażeniam, Skażenie promieniotwórcze, SKAŻENI
Zanieczyszczenia radioaktywne i ich wpływ na zdrowie człowieka, Studia, 1-stopień, inżynierka, Ochro
instrukcja bhp podczas zajec z opbmr z uzyciem srodkow pozorowania skazen chemicznych i promieniotwo
Skazenie promieniotworcze Polski, promieniowanie naturalne]
analiza skażeń środowiska notatki
skażenie środowiska
więcej podobnych podstron