Arkadiusz Kasprzyk, Artur Kostrzewski
IMCa
Ćwiczenia laboratoryjne z chemii.
Temat: Mieszaniny buforowe.
W celu wytworzenia i utrzymania właściwego stężenia jonów hydroniowych w roztworze stosujemy mieszaniny buforowe: są to mieszaniny słabych zasad lub kwasów z ich solami np. CH3COOH i CH3COOHNa lub NH4OH i NH4CL oraz mieszaniny soli słabych kwasów wieloprotonowych o różnych stopniach neutralizacji np. NaH2PO4 i Na2HPO4 lub Na2HPO4 i Na3PO4.
Mieszaniny buforowe mają określone pH, którego wartość zmienia się nieznacznie po wprowadzeniu do roztworu pewnego nadmiaru jonów H3O- lub OH-. Inaczej mówiąc, mieszaniny te wykazują „działanie buforujące”, tzn. uniemożliwiają gwałtowną zmianę pH roztworu. Podobnie rozcieńczanie czy zwiększanie stężenia roztworów buforowych nie ma wpływu na wartość ich pH. Dla buforu o charakterze kwaśnym np. CH3COONa+CH3COOH, stężenie jonów hydroniowych [H3O+] oblicz się ze wzoru
![]()
gdzie:
Kk- stała dysocjacji słabego kwasu,
Ck- stężenie kwasu,
Cs- stężenie soli.
Mechanizm działania roztworu buforującego jest taki: po dodaniu do mieszaniny buforowej kwasu anion soli zawartej w buforze tworzy z jonem H3O+ słabo zdysocjowany kwas, natomiast po dodaniu zasady jon hydroniowy kwasu zawartego w mieszaninie tworzy z jonem OH- słabo zdysocjowane cząsteczki wody. W skutek powstania słabo zdysocjowanych cząstek kwasu i wody, pH roztworu zmienia się nieznacznie. Po dodaniu do buforu octanowego CH3COOH i CH3COONa kwasu solnego anion CH3COO- z octanu sodu tworzy z jonem H3O+ kwas octowy
![]()
Po dodaniu np. wodorotlenku sodowego NaOH następuje reakcja zobojętnienia między jonami hydroniowymi z kwasu octowego a jonami hydroksylowymi z zasady
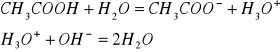
Wprowadzenie kwasu do mieszaniny buforowej powoduje wzrost stężenia słabego kwasu, wprowadzenie zasady wzrost stężenia odpowiedniej soli. Zmiany stężenia składników mieszaniny buforowej wpływają w nieznacznym stopniu na pH roztworu.
Miarą pojemności buforowej jest stosunek dodanej do roztworu ilości kwasu HCl4 lub zasady NaOH wyrażanej w molach jonów wodorowych na 1dm3 do uzyskanej przez to zmiany pH.
Pojemność buforowa wyraża się ułamkiem. W miarę zwiększania ilości dodawanego kwasu lub zasady pojemność buforowa zmniejsza się i staje się równa zero, gdy cała zawarta w roztworze sól zmieni się w słaby kwas lub też cały słaby kwas zostanie przeprowadzony w sól.
Doświadczenie 1.
Związek chemiczny |
Stosunek objętościowy roztworu |
||
0,1 chlorek amonowy |
1 |
1 |
16 |
0,1 wodorotlenek amonowy |
16 |
1 |
1 |
Wartość pH |
8,0 |
7,4 |
6,2 |
0,2 chlorek amonowy |
1 |
1 |
16 |
0,2 wodorotlenek amonowy |
16 |
1 |
1 |
Wartość pH |
8,0 |
7,4 |
6,2 |
Doświadczenie 2.
Kwas octowy |
1 |
4 |
Octan sodowy |
4 |
1 |
Wartość pH |
5,2 |
4,8 |
Doświadczenie 3.
Do probówki wlaliśmy 1/5 objętości chlorku baru i dodaliśmy 5-10 kropli kwasu solnego, a następnie wlewaliśmy małymi porcjami roztwór dwuchromianu(VI) potasu do momentu wytrącenia się osadu. Wymieszaliśmy zawartość probówki i podzieliliśmy na dwie części - pozostawiając jedną jako wzorzec. Do drugiej dodaliśmy 5 cm3 octanu sodowego. Otrzymany osad należało porównać z probówką wzorcową.
![]()
pH<7
![]()
- barwa pomarańczowa
![]()
pH>7
![]()
- barwa żółta
Pod działaniem dwuchromianu(VI) potasu na rozpuszczone sole baru wydzieliły się żółte osady: chromianu barowego ![]()
rozpuszczalnego w kwasie solnym, a nierozpuszczalnego w kwasie octowym.
![]()
![]()
Dwuchromian potasowy ![]()
z roztworów soli barwnych strącił nie dwuchromian, lecz chromian baru(VI). Wyjaśniamy to tym, że ![]()
jest bardziej rozpuszczalny od ![]()
, który rozpuszcza się bardzo trudno.
W środowisku kwasu solnego osad nie strąca się, ponieważ nadmiar jonów hydroniowych zapobiega hydrolizie dwuchromianu potasowego i wówczas stężenie jonów chromianowych jest za małe, aby nastąpiło strącenie ![]()
. Wprawdzie kwas octowy również obniża stężenie jonów ![]()
, ale nie w tym stopniu, aby przeszkodzić wydzielaniu się osadu![]()
. Przy dużych stężeniach kwasu octowego pewne straty baru są możliwe.
Doświadczenie 4.
W zlewce o pojemności 25cm3 przygotowaliśmy bufor octanowy o składzie:CH3COOH i CH3COONa w składzie 1:1. Następnie rozlaliśmy go do 3 próbówek po 2cm3 i rozcieńczyliśmy je (1-dwukrotnie; 2-trzykr; 4-bez zmian). Zawartość próbówek wymieszaliśmy, a następnie dodaliśmy do każdej 5 kropli wskaźnika uniwersalnego.
Wartość pH w każdej próbówce otrzymaliśmy jednakowy.
Doświadczenie 5
Do zlewki z przygotowanym roztworem buforowym pobraliśmy po 2cm3 roztworu do czterech próbówek. Następnie dodaliśmy po 5 kropli wskaźnika uniwersalnego. Dodaliśmy do każdej próbówki kolejno po: 2,4 i 6 kropli 0,1M HCL. Wartość pH także nie ulega zmianie.
Doświadczenie 6
Do zlewki z przygotowanym roztworem buforowym pobraliśmy po 2cm3 roztworu do czterech próbówek. Następnie dodaliśmy po 5 kropli wskaźnika uniwersalnego. Dodaliśmy do każdej próbówki kolejno po 2,4 i 6 kropli 0,1M NaOH. Wartość pH także nie ulega zmianie.
Wyszukiwarka
Podobne podstrony:
Ćw.ch.3, Szkoła, penek, Przedmioty, Chemia, Laboratoria
Ćw.ch.4, Szkoła, penek, Przedmioty, Chemia, Laboratoria
Ćw.ch.4(1), Szkoła, penek, Przedmioty, Chemia, Laboratoria
Ćw.ch.3, Szkoła, penek, Przedmioty, Chemia, Laboratoria
Poprawka Cw 3, Szkoła, penek, Przedmioty, Chemia, Laboratoria
Chemia kataliza, Szkoła, penek, Przedmioty, Chemia, Laboratoria
Roztwory, Szkoła, penek, Przedmioty, Chemia, Laboratoria
KOROZJA1, Szkoła, penek, Przedmioty, Chemia, Laboratoria
Hydroliza, Szkoła, penek, Przedmioty, Chemia, Laboratoria
Szybkość reakcji, Szkoła, penek, Przedmioty, Chemia, Laboratoria
Pierwiastki 2, Szkoła, penek, Przedmioty, Chemia, Laboratoria
Redox2, Szkoła, penek, Przedmioty, Chemia, Laboratoria
Elektroliza, Szkoła, penek, Przedmioty, Chemia, Laboratoria
w03 Dysocjacja elektrolity, Szkoła, penek, Przedmioty, Chemia, Laboratoria
Sprawozdanie 5 ćwiczenia 4 i 5, Szkoła, penek, Przedmioty, Chemia, Laboratoria
Reakcje redoks, Szkoła, penek, Przedmioty, Chemia, Laboratoria
Korozja, Szkoła, penek, Przedmioty, Chemia, Laboratoria
Korozja-now, Szkoła, penek, Przedmioty, Chemia, Laboratoria
więcej podobnych podstron