Kierunek: Biotechnologia
Grupa studencka: Bio/Ch1
Grupa laboratoryjna: 6
Data laboratorium: 24.04.2007
Jakubiak Dominik
Sprawozdanie z laboratorium z Chemii Fizycznej
Temat: „Potencjometryczny pomiar pH”
I. Wstęp teoretyczny
Metal zanurzony w wodzie, w skutek silnie spolaryzowanych cząsteczek wody, w pewnym stopniu rozpuszcza się i określona liczba dodatnich jonów metalu przechodzi do wody. W takiej sytuacji metal będzie wykazywał potencjał ujemny względem wody, która uzyskała ładunki dodatnie. Powstała w ten sposób różnica potencjałów między metalem a wodą powoduje zahamowanie przenikania jonów metalu do wody, gdyż są one przyciągane przez ujemny ładunek metalu. Powstaje w ten sposób stan, w którym jony metalu koncentrują się w sąsiedztwie powierzchni metalu i w stanie ustalonym tyle jonów może przechodzić z metalu do wody, ile ich wraca z wody do metalu. Jest to równowaga dynamiczna. Metal jest nazywany elektrodą, a powstała różnica potencjałów określa tzw. potencjał elektrodowy.
Wartość i znak różnicy potencjałów między danym metalem a roztworem zależy więc od stężenia (ściślej aktywności) jonów danego metalu w roztworze. Można na podstawie tej różnicy potencjałów wyznaczyć wartość stężenia, a raczej aktywności jonów danego metalu w roztworze. Tę różnicę potencjałów między roztworem a elektrodą oznacza się przez E.
![]()
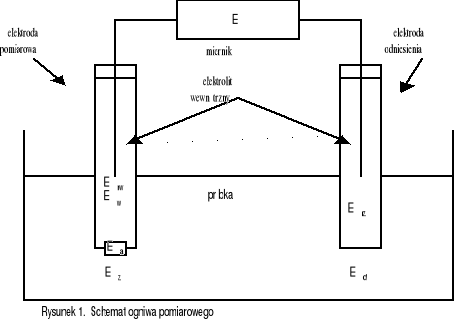
Dla uzyskania stałego potencjału stosuje się elektrodę porównawczą (odniesienia) połączoną z badanym roztworem za pomocą klucza elektrolitycznego. Stosowany w pomiarach jonoselektywnych obwód pomiarowy, najłatwiej jest omówić na przykładzie schematu ogniwa pomiarowego:
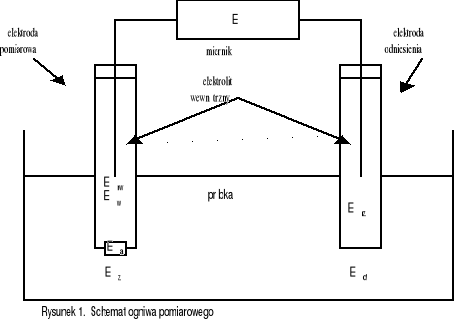
Erw - potencjał wewnętrzny półogniwa
odniesienia
Ew - potencjał wewnętrznej powierzchni
membrany
Ea - potencjał asymetrii membrany
Ez - potencjał zewnętrznej powierzchni
membrany
Ed - potencjał dyfuzyjny łącznika
elektrolitycznego
Erz - potencjał zewnętrznego półogniwa
odniesienia
Podczas pomiaru, rejestrowana przez miernik różnica potencjałów E, jest sumą sześciu zaznaczonych na rysunku różnic potencjałów. Przy zachowaniu odpowiednich warunków prowadzenia pomiaru (np. zachowania stałej siły jonowej próbki), jedynie potencjał powierzchni zewnętrznej membrany jonoselektywnej (Ez), będzie zależał od aktywności jonu oznaczanego w próbce. Zależność ta, określona jest równaniem Nernsta.
II. Przebieg ćwiczenia, dane i obliczenia
1. Przygotowanie roztworu buforowego i pomiar siły elektromotorycznej ogniwa.
Najpierw przygotowaliśmy roztwory wg instrukcji na stanowisku laboratoryjnym które posłużyły do sporządzenia roztworu buforowego o zadanym pH = 3,5.
Na początku odważyliśmy 0,20422g ftalanu potasu w 100 cm3 roztworu, połowę (50 cm3) wlewamy do zlewki i mieszamy z odpowiednią, wyliczoną ilością (7,85 cm3) 0,1 M HCl i dopełniamy wodą do 100 cm3. Następnie zbadaliśmy rzeczywiste pH roztworu za pomocą metody potencjometrycznej za pomocą kompensatora do pomiaru SEM i ogniwa złożonego z elektrody chlorosrebrowej i chinhydronowej. Do zlewki wlaliśmy roztwór buforowy, dodaliśmy 10 mg chinhydronu, a następnie zestawiono ogniwo (elektroda chlorosrebrowa z biegunem (-), elektroda chinhydronowa z (+)), skompensowaliśmy je i dokonaliśmy pomiaru SEM za pomocą kompensatora.
Parametr: |
Wartość: |
Zmierzone SEM |
0,283 (V) |
Potencjał elektrody chinhydronowej |
0,699 (V) |
Potencjał elektrody chlorosrebrowej |
0,199 (V) |
Temperatura w jakiej prowadzono dośw. |
20,50 C = 293,65 K |
2. Obliczenie rzeczywistego pH na podstawie danych pomiarowych
Rolę elektrody wskaźnikowej pełniła elektroda chinhydronowa, w związku z czym jej potencjał nie jest stały i wymaga wyliczenia na podstawie wzoru Nernsta. Drugie półogniwo - elektroda chlorosrebrowa - jest elektrodą porównawczą, w związku z czym jej potencjał jest stały w warunkach stałego stężenia jonów chlorkowych. Możemy zatem przyjąć, iż jej potencjał jest równy potencjałowi normalnemu. Uzyskujemy w ten sposób równanie na SEM ogniwa (E):
![]()
gdzie: E+ - potencjał elektrody dodatniej
![]()
E- - potencjał elektrody ujemnej
![]()
E- zmierzona wartość SEM
Po podstawieniu otrzymujemy:
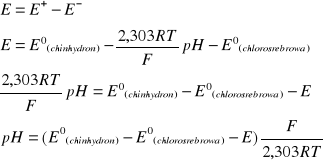
F=96458 C/mol
R=8,3145 J/mol∙K
![]()
3. Cechowanie pH-metru za pomocą buforu wzorcowego
Wstępnie przepłukaliśmy zlewkę 50 ml i elektrodę zespoloną pH-metru sporządzonym roztworem buforowym. Po osuszeniu, umieściliśmy elektrodę na statywie. Napełniliśmy naczynie buforem wzorcowym i włożyliśmy elektrodę. pH-metr został wycechowany wg instrukcji załączonej do stanowiska.
4. Pomiar pH próbki
Elektroda i zlewka pomiarowa została przepłukana za pomocą wody destylowanej. Następnie przystąpiliśmy do właściwego pomiaru pH. Procedura postępowania była identyczna jak w przypadku przygotowania pH-metru do cechowania, z tym że w miejsce buforu wzorcowego zastosowaliśmy roztwór badanej próbki. Po umieszczeniu elektrody zespolonej w roztworze musieliśmy odczekać na ustabilizowanie się wskazań przyrządu i dopiero wtedy mogliśmy odczytać wartość pH. Odczytana wartość pH to 3,64
5. Podsumowanie wyników doświadczenia:
SEM ogniwa pomiarowego [V] |
Teoretyczna wartość pH buforu wzorcowego |
Rzeczywista wartość pH buforu wzorcowego |
Zmierzona wartość pH próbki |
0,283 |
3,5 |
3,72 |
3,64 |
III. Analiza błędów
1. Błąd wyznaczenia pH roztworu buforowego
![]()
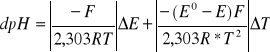
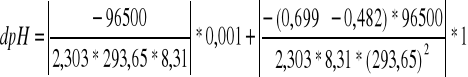
dpH = 0,02985
pH roztworu buforowego:
pH = 3,72 ±0,02985
2. Błąd badania za pomocą pH-metru
Całkowity błąd wskazań pH-metru został obliczony w następujący sposób: do błędu obliczonego metodą różniczki zupełnej dodajemy także dokładność wskazań urządzenia pomiarowego. W ten sposób otrzymujemy błąd:
Błąd pH - metru: 0,01
Błąd końcowy: 0,02985 + 0,01= 0,03985
pH badanej próbki:
pH = 3,64 ±0,03985
IV. Wnioski
Na podstawie załączonej analizy błędów możemy stwierdzić, iż potencjometryczny pomiar pH jest bardzo dokładną metodą analityczną, a ewentualne pomyłki są zaniedbywalne w stosunku do otrzymanej wartości pH (błąd dwa rzędy wielkości mniejszy od otrzymanego wyniku). Co ważne, oprócz dużej dokładności, jest to metoda tania i nie wymagająca zbyt skomplikowanej aparatury laboratoryjnej.
Na błędy wynikłe w doświadczeniu mogła mieć wpływ temperatura pomiaru oraz niedoskonałości konstrukcji pH-metru i kompensatora. Jakość sporządzonego buforu nie miała wielkiego wpływu na przebieg doświadczenia, gdyż służył on tylko do wycechowania pH-metru, odstępstwa od pH teoretycznego mogły zostać spowodowane przez zanieczyszczenie odczynników i szkła laboratoryjnego oraz nieprecyzyjną preparację.
Wyszukiwarka
Podobne podstrony:
Zestaw nr 6, Studia, chemia
Zestaw 7, Studia, chemia
tos2-2013d, Studia, chemia egzaminy
wapno, Budownictwo-studia, chemia
2 kationy, Studia, Chemia, chemia7
Reakcje jądrowe-podstawowe pojęcia, Studia, chemia jądrowa
chf wykład 6, Studia, Chemia, fizyczna, wykłady
ćw7 - Refrakcja i wyznaczanie momentu dipolowego, studia, chemia fizyczna
I Pracownia - zakres materiału, Studia - Chemia kosmetyczna UŁ, II rok, IV semestr, CHEMIA ORGANICZN
KOLOS kwasy tłuszcze 5, STUDIA, Chemia
nieorgany-pytania2, Studia - Chemia kosmetyczna UŁ, II rok, III semestr, CHEMIA NIEORGANICZNA labora
pytania z examinu, Studia, Chemia, ogólna, examin
Doc 12, Studia, Chemia, chemia7
tos2-2014a, Studia, chemia egzaminy
ligandy, Studia POLSL, STUDIA, Chemia nieorganiczna, teoria
Spr.nr 10, Studia, Chemia, chemia7
zagadnienia do egzaminu z Podstaw chemicznych, Studia, Chemia, Podstawy chemiczne nauk o Ziemi - dla
Biotechnologia 2003-sem2, studia, CHEMIA
więcej podobnych podstron