Określenie głównego składnika stopu.
Otrzymaną próbę rozpuściłem w kwasie solnym pod wyciągiem. Reakcja zaszła burzliwie z wydzieleniem ciepła (reakcja egzotermiczna).
Mn + 2HCl ![]()
MnCl2 + H2![]()
Mn0 - 2e ![]()
Mn2+
2H+ + 2e ![]()
H20
Mn + 2H+ + 2Cl- ![]()
Mn2+ + 2Cl- + H2
Mn + 2H+![]()
Mn2+ + H2
Następnie rozcieńczyłem roztwór wodą destylowaną i wykonałem reakcje na wykrycie kationów.
ODCZYNNIK |
RODZAJ REAKCJI |
OBSERWOWANNE |
WNIOSEK |
|
|
ZJAWISKO |
|
1.NaOH 0,2M |
reakcja strącania |
wytrącił się |
Al3+, Zn2+, Pb2+, Mn2+, |
|
|
biały osad ciemniejący |
Mg2+. |
|
r. amfoteryczności |
|
Mn2+, Mg2+. |
NaOH 2M |
|
W probówce nie zaszły zmiany |
|
H2O
|
r.redoks |
wytrącił się brunatny |
Jest to kation Mn2+ |
|
|
osad |
|
2. NH3* H2O |
r.strącania |
biały osad ciemniejący |
Mn2+ |
0,2M |
|
|
|
NH3*H2O 2M |
r. kompleksowania |
nie zachodzą zmiany |
Mn2+ |
3. (NH4)2S |
r.strącania |
cielisty osad |
Mn2+ |
4. KI |
brak reakcji |
|
Mn2+ |
1.probówka:
Mn2+ + 2OH- ![]()
Mn(OH)2
2Mn(OH)2 ![]()
+ H2O2 ![]()
H2MnO3
2.probówka:
Mn2+ + 2NH4OH![]()
Mn(OH)2 ![]()
+ 2NH4
3.probówka:
Mn2+ + S2-![]()
MnS![]()
4.probówka:
KI + Mn2+![]()
brak reakcji
Doświadczenie 3.2 Porównanie szybkości reakcji chemicznej po utworzeniu ogniwa galwanicznego.
Do dwóch probówek odmierzyłem po 3 cm3 kwasu siarkowego o c = 1 mol/dm3 i wrzuciłem po jednej granulce cynku. W tak przygotowanym roztworze nie zaobserwowałem większych zmian. Następnie w jednej probówce granulkę cynkową zetknąłem z drutem miedzianym. Intensywność wydzielania wodoru jest większa w probówce z drutem miedzianym, wydziela się on głównie w miejscu uszkodzenia blaszki.
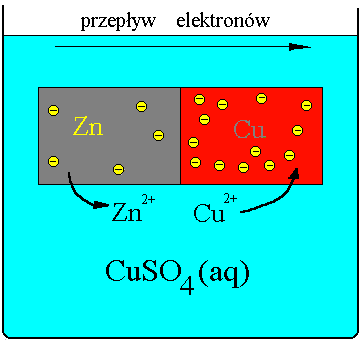
1) Zn + H2SO4 ![]()
ZnSO4 + H2![]()
2) Zn + Cu + H2SO4 ![]()
ZnSO4 + H2 + Cu
A: Zn - 2e ![]()
Zn2+
K: (Cu) 2H+ + 2e ![]()
H2![]()
W probówce tej cynk wypiera wodór, gdyż jest bardziej aktywny. Zachodzi szybkie wydzielanie wodoru, ponieważ jest to układ dwóch metali - ogniwo galwaniczne.
Zn + CuSO4 + H2SO4 ![]()
ZnSO4 + Cu + H2![]()
Na cynku osadza się metaliczna miedź, ponieważ metal mniej szlachetny wypiera bardziej szlachetny z roztworu jego soli. Cynk wypiera miedź, gdyż jest metalem bardziej aktywnym o mniejszym potencjale.
Doświadczenie 3.3. Korozja blach stalowych pokrytych innymi metalami.
Przygotowałem roztwór rozcieńczonego kwasu i heksacyjanożelazianu (III)potasu. Odmierzyłem około 20 cm3 wody destylowanej, dodałem 4 krople H2SO4 o c = 1 mol/dm3 oraz około 1 cm3 roztworu ![]()
. Po wymieszaniu rozdzieliłem na dwie probówki. Do jednej wrzuciłem blaszkę ocynkowaną, a do drugiej ocynowaną. Blaszki mają uszkodzone krawędzie.
Fe2+ + ![]()
![]()
Fe3![]()
2 + 6K+
Zn2+ + ![]()
![]()
![]()
2 + 6K+
A: Zn - 2e ![]()
Zn2+
K: (Fe) 2H+ + 2e ![]()
H2![]()
A: Fe - 2e ![]()
Fe2+
K: (Sn) 2H+ + 2e ![]()
H2![]()
Cynk będzie lepiej zapobiegał korozji. Najpierw korozji ulega cynk, gdyż jest aktywniejszy, cynk jest anodą.
Doświadczenie 3.4.Korozja elektrolityczna pod kroplą elektrolitu.
Blaszkę żelazną oczyściłem papierem ściernym, przemyłem wodą destylowaną i wytarłem bibułą filtrującą do sucha. Na suchą powierzchnię naniosłem kroplę przygotowanego odczynnika, który otrzymano ze zmieszania100 cm3 NaCl o c = 0,1 mol/dm3 z 2 cm3 1% roztworu ![]()
z 0,5 cm3 1% roztworu fenoloftaleiny.
A: Fe - 2e ![]()
Fe2+ żelazo koroduje - barwa niebieska
K: O2 + H2O ![]()
4OH- barwa różowa
Fe2+ + 2OH-![]()
Fe(OH)2
Fe(OH)2 ![]()
Fe(OH)3 ![]()
Fe2O3 - główny składnik rdzy
4Fe(OH)2 + O2 + 2H2O ![]()
4Fe(OH)3
2Fe(OH)3 ![]()
Fe2O3 + 3H2O - barwa żółta
Roztwór NaCl przyspiesza reakcję korozji, fenoloftaleina zabarwia się na różowo w środowisku zasadowym, a heksacyjanożelazian(III) potasu wykrywa jon Fe2+ zabarwia się na żółto. Po około 20 min. wnętrze kropli zabarwia się na niebiesko co świadcz o obecności Fe2+. Kolor różowy świadczy o obecności jonów OH-. Żółte zabarwienie świadczy o utlenianiu się żelaza co powoduje rdzę.
1
Wyszukiwarka
Podobne podstrony:
Korozja (1), Inżynieria Środowiska PŚk, Semestr 1, Biologia
Korozja polega na niszczeniu tworzywa pod wpływem środowiska, Inżynieria Środowiska PŚk, Semestr 1,
KOROZJA, Inżynieria Środowiska PŚk, Semestr 1, Biologia
Samooczyszczanie wód powierzchniowych, Inżynieria Środowiska PŚk, Semestr 1, Biologia
Biocenoza gleby, Inżynieria Środowiska PŚk, Semestr 1, Biologia
Referat Biokorozja, Inżynieria Środowiska PŚk, Semestr 1, Biologia
Środki dezynfekujące dzielimy na, Inżynieria Środowiska PŚk, Semestr 1, Biologia
Referat beztlenowce, Inżynieria Środowiska PŚk, Semestr 1, Biologia
Pierwotniaki, Inżynieria Środowiska PŚk, Semestr 1, Biologia
wykład PŁ, Inżynieria Środowiska PŚk, Semestr 1, Biologia
4 jedrzejów łaczyn, Inżynieria Środowiska PŚk, Semestr 2, Hydrogeologia 1, projekt
projekt 3, Inżynieria Środowiska PŚk, Semestr 2, Hydrogeologia 1, projekt, czyjeś projekty
O6, Inżynieria Środowiska PŚk, Semestr 2, Fizyka, Labo
To będzie nasze nowe sprawko xD, Inżynieria Środowiska PŚk, Semestr 2, Inżynieria Elektryczna
więcej podobnych podstron