1. Prawo Kirchhoffa wyraża równanie:
ΔrH'(T2)= ΔrH'(T1)+![]()
ΔrC'p dT (1)
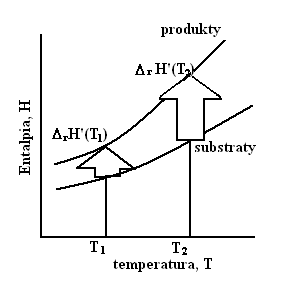
Rys. 1
Graficzne przedstawienie prawa Kirchhoffa
ΔrH'(T2) - standardowa entalpia reakcji w temperaturze T2(szukana przez Nas)[kJ/mol]
ΔrH'(T1) - standardowa entalpia reakcji w temperaturze T1(jest nam znana)[kJ/mol]
T - temperatura, [K]
ΔrC'p - różnica pomiędzy molowymi pojemnościami cieplnymi produktów i substratów w warunkach standardowych z uwzględnieniem ich współczynników stechiometrycznych[J/K*mol]
ΔrC'p = jCp,m - iCp,m (1.a)
produkty substraty
- współczynniki stechiometryczne
Prawo Kirchhoffa wykorzystujemy do obliczenia standardowej entalpii reakcji w interesującej Nas temp. na podstawie znajomości standardowej entalpii reakcji w innej temp. oraz pojemności cieplnych produktów i substratów w tym zakresie temperatur.
Definicje wielkości występujących we wzorze
Entalpia(H) - jest funkcją stanu(tzn. jej zmiana nie zależy od drogi przemiany) zdefiniowana jako:
h=u+pv (2)
Gdzie: u - energia wewnętrzna układu [J]
p - ciśnienie w układzie [N/m2]
v objętość ogólna układu [m3]
gdy p=const i układ nie wykonuje pracy nieobjętościowej :
dh=dq (3)
Funkcje zwaną Entalpią wprowadzamy, gdy układ może wykonać pracę zmiany objętości. W takich warunkach część energii dostarczonej do układu na sposób ciepła wraca do otoczenia więc: du<dq
Dostarczone ciepło w takich warunkach jest równe zmianie Entalpii, czyli:
dh=dq przy p=const i gdy układ nie wykonuje pracy nieobjętościowej.
Dla wielkości mierzalnych:
Δh=qp , qp - ciepło mierzone pod stałym ciśnieniem (4)
Pojemność cieplna (Cp) przy p=const jest zdefiniowana :
Cp=(∂H/∂T)p (5)
H-entalpia
T-temperatura[K]
Nachylenie wykresu entalpii jako funkcji temperatury, gdy p=const nazywamy Pojemnością cieplna pod stałym ciśnieniem(Rys.2)
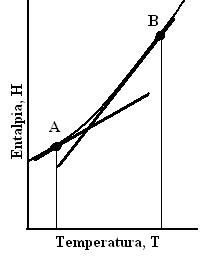
Rys. 2
Wykres pojemności cieplnej pod stałym ciśnieniem(linia gruba). Pojemność cieplna zależy od temperatury, dlatego jak to widać na wykresie pojemności w punktach A i B są różne.
Pojemność cieplna układu pod stałym ciśnieniem jest zmianą Entalpii układu w procesie izobarycznym odniesiona do zmiany temperatury układu w tym procesie.
Pojemność cieplna zależy od temperatury i w niskiej maleje. Dla niewielkich zakresów temp.(temp. pokojowa i wyższa)w przybliżonych obliczeniach przyjmujemy że jest niezależna od temperatury.
2. Wyprowadzenie Prawa Kirchhoffa:
Za pomocą wzoru nr (5) wiążemy zmianę Entalpii ze zmianą temperatury.
Dla nieskończenie małych zmian temperatury.
dH=CpdT (6)
całkując w granicach T1 - T2 (zakres temperatur w których ogrzewamy substancje), otrzymujemy:
H(T2)=H(T1) +![]()
Cp dT (7)
(zakładamy ze w temperaturze ot T1 do T2 nie zachodzą przemiany fazowe)
Równanie jest słuszne dla każdego z reagentów, wiec standardowa entalpia reakcji zmienia się od temperatury T1 do T2 tak jak wyraża to równanie Kirchhoffa (1)
Entalpia standardowa reakcji ΔrH' - jest zmianą Entalpii, w której substraty w swoich stanach standardowych ulegają przemianie w produkty w stanie standardowym. Jest ona ściśle powiązana z równaniem stechiometrycznym:
ΔrH'=ΣυH'm - ΣυH'm
υ-współczynniki stechiometryczne
H'm-standardowe entalpie produktów produktów substratów
Stan standardowy- substancji w danej temp. odpowiada jej czystej postaci pod ciśnieniem 1bar (temp. jest dowolna)
3. Zastosowanie prawa Kirchhoffa:
Standardowa entalpia tworzenia H2O(c) w temp.298K wynosi -285,83 kJ/mol.Oblicz tę wielkość w temp.363K.
OBLICZENIA: korzystamy z prawa Kirchhoffa:
ΔrH'(T2)= ΔrH'(T1)+![]()
ΔrC'p dT
Występuje tu ΔrC'p wyrażona równaniem 1.a
Równanie reakcji chemicznej to: H2 + 1/2O2= H2O
Współczynniki stechiometryczne:ν(H2)=1
ν(O2)=1/2O2
ν(H2O)=1
dla naszego przypadku równanie 1.a przyjmuje więc postać:
ΔrC'p= C'p,m(H2O,c)-{C'p,m(H2,g)+1/2C'p,m(O2,g)} (8)
Molowa pojemność cieplna produktów i substratów zależy od temp. Więc korzystamy z przybliżonego wzoru empirycznego :
C'p,m= a + bT + c/T2[J/mol*K] (9)
Gdzie a,b,c-parametry doświadczalne niezależne od temperatury,niektóre ich wartości podano w tabeli nr 1.
|
a |
b/(10-3 K-1) |
c/(105 K2) |
C (s) |
16.86 |
4.77 |
-8.54 |
CO2 (g) |
44.22 |
8.79 |
-8.62 |
H2O (c) |
75.29 |
0 |
0 |
N2 (g) |
28.58 |
3.77 |
-0.5 |
H2 (g) |
27.28 |
3.26 |
0.5 |
O2 |
29.96 |
4.18 |
-1.67 |
Podstawiając do wyrażenia (8) równanie nr (9) otrzymujemy całkę:
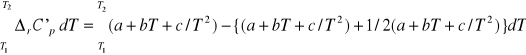
Całkę sumy możemy przedstawić jako sumę całek i liczyć poklei.Każda z tych całek jest taka sama więc całkując w granicach T1 T2 jedną z nich otrzymujemy wyrażenie ogólne:
Całka 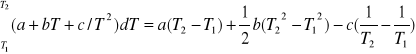
(10)
Dla (H2O,c) C'p,m po podstawieniu wartości liczbowych odpowiednich a,b,c do wyrażenia(10) otrzymujemy:
C'p,m(H2O,c)= 4893,85 [J/mol]
Podobnie postępujemy dla H2 i O2 podstawiając wartości a,b,c z tabelii 1 odpowiednie dla H2 i O2 do równania(10)otrzymując wartości molowych pojemności cieplnych w zakresie temp.298-363K dla tych substancji :
C'p,m(H2 ,g)= 1873,23 [J/mol]
C'p,m(O2 ,g)= 1936,99 [J/mol]
Z tego obliczamy :ΔrC'p= ![]()
ΔrC'p=2052,13 [J/mol]
Ostatecznie więc po podstawieniu danych liczbowych do równania(1)ΔrH'(363K) wynosi:
ΔrH'(363K)= -285,83 +2,052= -283,78 [kJ/mol]
Odp. Entalpia tworzenia H2O w stanie ciekłym w temp.363K wynosi -283,78 [kJ/mol].
W przypadku gdy możemy założyć niezależność pojemności cieplnej od temp. W danym zakresie temp. korzystamu z ogólnego prawa Kirchhoffa wyrażonego wzorem
ΔrH'(T2)= ΔrH'(T1) +(T2-T1)ΔrC'p (11)
Jednak w takim przypadku uzyskujemy wyniki bardzo niedokładne.
4. Załącznik.
Temperatura(T)- definiowana jako parametr określający kierunek przepływu energii na sposób ciepła. Jeśli energia przepływa od ciała A do B stwierdzamy że ciało A ma wyższą temperaturę niż B. [K]
Energia wewnętrzna(u)- suma całkowitej energii kinetycznej i potencjalnej cząsteczek tworzących układ. [J]
Jest funkcją stanu zależy jedynie od aktualnego stanu układu a nie od drogi na jakiej ten stan został osiągnięty.
Nie można mierzyć U tylko jej zmianę, która jest różnicą energii wewnętrznej układu w stanie końcowym i początkowym:
Δu=uk-up
W ogólnym przypadku zmiana energii wewnętrznej dana jest wzorem:
du=dq+dwobj.+dwe
dq- ciepło dostarczone do układu [J]
dwobj- praca zminy objętości wykonana na układ [J]
dwe-dodatkowa praca wykonana przez układ np. elektryczna [J]
Gdy układ utrzymywany jest w stałej objętości i nie wykonuje innego rodz. pracy to:
du = dqv
Objętość(v)- stosunek masy substancji do jej gęstości :
v = m/d [m3]
m- masa substancji [g]
d- gęstość substancji [g/m3]
Ciśnienie(p)- zdefiniowane jako normalna składowa siły do powierzchni na którą działa:
p = F/A [N/m2]
F- siła [N]
A- powierzchnia [m2]
[N]=[![]()
]
Wyszukiwarka
Podobne podstrony:
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
więcej podobnych podstron