Grupa: 23 Zespół: 8 |
Ćwiczenie: 6 |
Data: 30.05.2000 |
1.Kmieć Radosław 2.Prokurat Michał |
Wyznaczanie stałej równowagi reakcji |
Ocena: |
Część teoretyczna.
W układzie składającym się z dwóch niemieszających się cieczy A i B oraz z trzeciej substancji C rozpuszczalnej zarówno w jednej jak i w drugiej cieczy zachodzi ustalenie stanu równowagi ilościowo opisanego równaniem Nernsta:
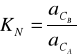
gdzie:
![]()
, ![]()
- aktywność składnika C w fazie A i B.
W stałej temperaturze lewa strona wyrażenia jest wielkością stałą. Wielkość ta oznacza zazwyczaj KN, nazywana jest współczynnikiem podziału.
Równanie może być stosowane jako przybliżone jedynie w przypadku roztworów bardzo rozcieńczonych, szczególnie ostrożnie w odniesieniu do roztworów elektrolitów, których współczynniki aktywności różnią się wyraźnie od jedności już dla stężeń rzędu 10-2. Poważne odchylenia od prawa podziału wystąpią także w przypadku substancji asocjujących. Dodanie trzeciej substancji B do dwóch praktycznie nie mieszających się rozpuszczalników spowoduje wzrost ich wzajemnej rozpuszczalności, a więc współistniejące fazy są roztworami trójskładnikowymi o zmieniających się zawartościach A i C .
Prawo podziału nie będzie również zachowane, gdy w jednej z faz stężenie substancji rozpuszczonej określane jest dodatkowo reakcjami równowagowymi przebiegającymi w tej fazie. Odchylenia te mogą być podstawą do wyznaczenia stałej równowagi takiej reakcji. Reakcja:
![]()
przebiega jedynie w roztworze wodnym, nie zachodzi natomiast w fazie organicznej. Stałe równowagi powyższej reakcji wyraża się wzorem:
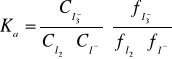
W przypadku gdy roztwór jest rozcieńczony, można przyjąć że współczynnik aktywności fi≅1
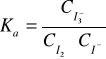
, zatem Ka≅Kc.
Jeżeli faza wodna, w której ustala się powyższa równowaga znajduje się w kontakcie z fazą organiczną np. CCl4, wówczas stężenie równowagowe I2 określone jest również współczynnikiem podziału:
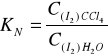
Jeżeli znana jest wartość współczynnika podziału KN wówczas stężenie równowagowe jodu w roztworze wodnym możemy obliczyć na podstawie wartości stężenia jodu w fazie organicznej, wyznaczonej przez miareczkowanie fazy organicznej roztworem Na2S2O3. Jednocześnie całkowite stężenie jodu w fazie wodnej (w postaci I2 oraz I-) może być wyznaczone analogicznie poprzez miareczkowanie warstwy wodnej. Wówczas:
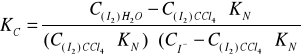
![]()
![]()
![]()
Rys. Schemat układu złożonego z dwóch faz ciekłych: wodnej (r-ru KI) i CCl4 (nasyc. r-ru I2).
Ćwiczenie ma na celu umożliwić nam wyznaczenie stałej KC dla dwóch różnych temperatur dla reakcji: ![]()
.
Wykonanie pomiaru
Do kolby stożkowej o poj. 250 cm3 wprowadza się 100 cm3 0.1 molowego roztworu KI oraz 20 cm3 roztworu I2 w CCl4. Zawartość wytrząsa się w temperaturze otoczenia przez ok. 30 min. Następnie pobiera się po dwie próbki z każdej fazy i oznacza się miareczkowo 0.01 molowym roztworem Na2S2O3 stężenie I2. Następnie kolbę umieszcza się w termostacie i ogrzewa do temp. 40 oC, po czym oznaczanie I2 powtarza się.
Część obliczeniowa.
Warunki pomiaru:
T1 = 20.0 oC
T2 =40.0 oC
Oznaczenia:
Vfazy (H2O) lub (CCl4) - objętość próbki warstwy H2O lub CCl4;
VNa2S2O3 - objętość 0.01 molowego Na2S2O3 zużyta w czasie miareczkowania;
CI2 (H2O) lub (CCl4) - stężenie I2 w warstwach (gdy H2O, to suma ![]()
przeliczona na I2);
![]()
- stężenia równowagowe;
CI2, CNa2S2O3 - stężenia analityczne;
![]()
- stałe podziału Nernsta w odpowiednich temperaturach;
![]()
- stałe stężeniowe.
Wyniki:
|
|
H2O |
H2O |
CCl4 |
CCl4 |
|
Vfazy [cm3] |
5 |
5 |
2 |
2 |
20oC |
VNa2S2O3 [cm3] |
1.30 |
1.10 |
0.60 |
0.50 |
|
CI2 w fazie |
1.30⋅10-3 |
1.10⋅10-3 |
1.50⋅10-3 |
1.25⋅10-3 |
|
Vfazy [cm3] |
20 |
20 |
3 |
3 |
40oC |
VNa2S2O3 [cm3] |
4.30 |
4.35 |
1.10 |
1.05 |
|
CI2 w fazie |
1.07⋅10-3 |
1.08⋅10-3 |
1.83⋅10-3 |
1.75⋅10-3 |
Średnie wartości:
dla 20 oC - CI2 (H2O) - 1.20⋅10-3, CI2 (CCl4 - 1.37⋅10-3
dla 40 oC - CI2 (H2O) - 1.07⋅10-3, CI2 (CCl4 - 1.79⋅10-3
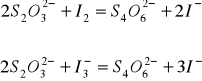
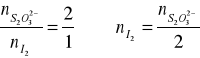
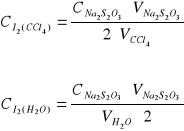
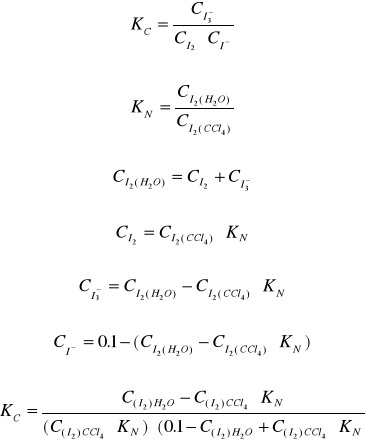
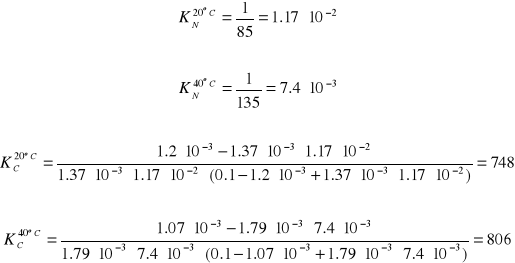
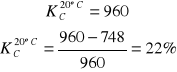
Wnioski:
Jak widać z obliczeń wraz ze wzrostem temperatury wzrasta wartość stałej reakcji. Równowaga reakcji przesuwa się coraz bardziej w stronę tworzenia produktu. Pomiędzy entalpiami swobodnymi tej reakcji zachodzi zależność: ![]()
. Z doświadczenia tego wynika też, że reakcja ![]()
jest endotermiczna, ΔHr>0 (→ izobara Van't Hoffa).
Barwa roztworu I2 w CCl4 (niepolarny rozpuszczalnik) jest fiołkowa, czyli identyczna z zabarwieniem jodu gazowego, natomiast roztworu wodnego brunatna. Wynika stąd, że jod w rozpuszczalniku polarnym ulega pewnym przemianom, powodującym zmianę jego widma absorbcyjnego (→ kompleksy z przeniesieniem ładunku).
Wyznaczanie stałej równowagi reakcji ![]()
metodą podziału
- 4 -
H2O
CCl4
Wyszukiwarka
Podobne podstrony:
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
więcej podobnych podstron