WOJSKOWA AKADEMIA TECHNICZNA
-------------------------------------------------------------------------------------------------------
LABORATORIUM FIZYCZNE
Grupa szkoleniowa C-21 Podgr. 1 płk. Walczak
stopień i nazwisko
prowadzącego
st. szer. pchor. Jarosław FIUT
kpr. pchor. Dariusz CHMIELEWSKI
(stopień, imię i nazwisko słuchacza)
ocena końcowa ocena przygot.
do ćwiczenia
SPRAWOZDANIE
Z
PRACY LABORATORYJNEJ Nr 31
Wyznaczanie stałej Rydberga i stałej Plancka
z widma liniowego wodoru
WSTĘP TEORETYCZNY
Dostarczając energię do atomu można doprowadzić do jego wzbudzenia. Wzbudzony atom charakteryzuje się tym, że jego elektrony znajdują się na orbitach bardziej oddalonych od jądra niż w stanie podstawowym. Po pewnym czasie elektrony wracają na swe stałe orbity powodując przy tym emisję promieniowania elektromagnetycznego. Dla każdego pierwiastka promieniowanie jest inne. Widma mogą przyjąć postać układu linii o różnych długościach fali. Jest to widmo liniowe.
Trzy postulaty Bohra:
Istnieją stacjonarne stany atomu, w których elektrony nie emitują promieniowania ( poruszają się po stałych orbitach)
Podaje sposób obliczania orbit elektronowych, odpowiadających stanom stacjonarnym. Elektron porusza się tylko po orbitach, dla których moment pędu elektronu L jest wielokrotnością ħ ( „kreślonej” stałej Plancka ).
Ln = n* ħ ; n = 1, 2, 3...
Dla orbit kołowych:
Ln = me*Vn*rn
gdzie: me - masa elektronu,
Vn - orbitalna prędkość elektronu
rn - promień orbity
Stąd:
n* ħ = me*Vn*rn
Dotyczy energii emitowanej przy przechodzeniu przez atom ze stanu wzbudzonego ( En )do stanu mniejszej energii ( Em ). Energia fotonu jest równa:
E = En - Em
Wiadomo, że:
E = h*ν
Stąd:
En - Em = h*ν
Korzystając z postulatów Bohra możemy wyliczyć promienie orbit stacjonarnych oraz wartość energii atomu. Na elektron działają siły: odśrodkowa ( Fo ) oraz przyciągania elektromagnetycznego ( Fe ).
Fo = Fe
Stąd:
Stąd:
Energia całkowita atomu ( E ) jest równa sumie energii kinetycznej elektronu ( Eke ) oraz jądra ( Ekj ) oraz energii ich wspólnego oddziaływania U.. Możemy przyjąć, że jądro jest w spoczynku. Więc:
Stąd:
Stąd:
Ujemny znak energii oznacza, że elektron znajduje się w jamie elektrostatycznego potencjału jądra. Można stwierdzić, że wartości energii mogą przyjmować jedynie wartości dyskretne:
Liczbę n nazywamy główną liczbą kwantową.
Jak wynika ze wzoru, wraz ze zwiększeniem głównej liczby kwantowej n, energia atomu rośnie ( maleje jej wartość bezwzględna ). Dla n = ∞ energia atomu równa jest zero.
Skwantowane wartości energii atomu można przedstawić za pomocą poziomów energetycznych. Odległość między poziomami maleje wraz ze zwiększaniem wartości liczby kwantowej n. Stan dla n = 1 nazywamy stanem podstawowym atomu.
Żeby przejść do stanu wzbudzonego atom musi otrzymać energię z zewnątrz. Czynnik wzbudzający może posiadać energię dowolnie dużą, ale atom będzie zawsze pobierał od niego energię porcjami, odpowiadającymi różnicom między poziomami energetycznymi. Obliczymy wartość ΔE zmiany energii atomu związanej z przejściem elektronu z orbity o energii E(n) na E(k).
ΔE = E(n) - E(k)
Stąd:
Wiemy, że:
ΔE = h*ν
I:
gdzie: c - prędkość światła
λ - długość fali
Otrzymujemy:
Badania wykazały, że linie w widmie tworzą grupy, zwane seriami. Dal wodoru wszystkie serie możemy zapisać jako:
gdzie RH - stała Rydberga:
Możemy zapisać:
Seriom widmowym atomu wodoru nadano nazwy:
- k = 1, n = 2,3,4... - seria Lymana;
- k = 2, n = 3,4,5... - seria Balmera;
- k = 3, n = 4,5,6... - seria Paschena;
- k = 4, n = 5,6,7... - seria Brackette'a;
- k = 5, n = 6,7,8... - seria Pfunda;
Przykładowo seria Balmera:
Zawiera cztery linie widzialne ( czerwona, niebieska, dwie fioletowe )
WYNIKI POMIARÓW:
HEL:
Nr linii |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
Dł. fali [ nm ] |
667.8 |
587.6 |
504.8 |
492.2 |
471.3 |
--- |
447.1 |
438.8 |
Barwa |
czerwony |
żółty |
zielony |
zielony |
niebieski |
niebieski |
fiolet |
fiolet |
Intensywność |
silny |
słaby |
słaby |
silny |
słaby |
słaby |
średni |
silny |
S ( od siebie ) |
669 |
590 |
504 |
493 |
470 |
--- |
445.8 |
435.2 |
S ( do siebie ) |
668.5 |
592 |
503 |
492 |
472 |
--- |
448.9 |
437 |
S średnie |
668.75 |
591 |
503.5 |
492.5 |
471 |
--- |
447.35 |
436.1 |
WODÓR:
Nr linii |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
Dł. fali [ nm ] |
667.8 |
587.6 |
504.8 |
492.2 |
471.3 |
--- |
447.1 |
438.8 |
Barwa |
czerwony |
żółty |
zielony |
zielony |
niebieski |
niebieski |
fiolet |
fiolet |
Intensywność |
silny |
słaby |
słaby |
silny |
słaby |
słaby |
średni |
silny |
S ( od siebie ) |
668 |
589 |
504 |
496 |
489 |
--- |
444 |
436 |
S ( do siebie ) |
666 |
588 |
503 |
494 |
488 |
--- |
445 |
437.5 |
S średnie |
667 |
588.5 |
503.5 |
495 |
488.5 |
--- |
444.5 |
436.75 |
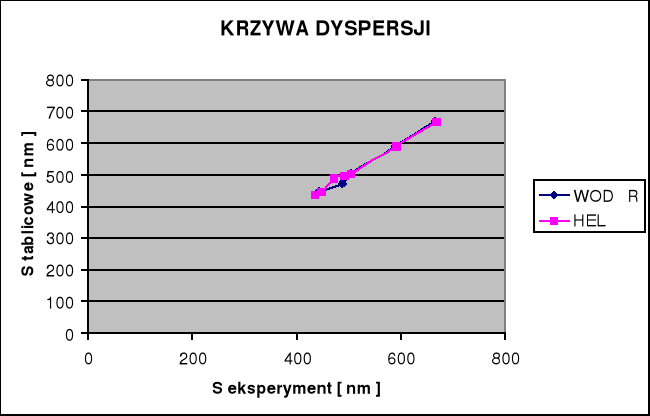
Długości fal dla:
Hα ► λα = 660 [ nm ]
Hβ ► λβ = 465 [ nm ]
Hγ ► λγ = 436 [ nm ]
WYZNACZAMY STAŁĄ RYDBERGA:
RHα = a / λα = 0.0109
RHβ = a / λβ = 0.0114 [ nm-1 ]
RHγ = a / λγ = 0.0109
RH = 0.0111 = 1.11 * 107 [ m-1 ]
WYZNACZAMY STAŁĄ PLANCKA:
H = 6.06 * 10-34 J*s
BŁĘDY WZGLĘDNE:
Δλ / λ = ΔS / Sśr = 17.2 / 488.5 = 0.035
ΔRH / RH = 7.27*10-7 / 0.0333 = 2.32*10-5
Δh / h = 1/3 * ΔRH / RH = 0.333*2.32*10-5 = 7.73*10-6
WNIOSKI:
Wyszukiwarka
Podobne podstrony:
5895
5895
5895
5895
5895
5895
więcej podobnych podstron