Przewodnictwo molowe mocnych elektrolitów przyjmuje znaczne wartości i w roztworach bardzo rozcieńczonych zmienia się liniowo w funkcji pierwiastka kwadratowego ze stężenia, osiągając wartość maksymalną Λ0 w roztworze nieskończenie rozcieńczonym. Zatem, przewodnictwo graniczne roztworów mocnych elektrolitów można wytłumaczyć przez ekstrapolację danych doświadczalnych do c=0 zgodnie ze wzorem empirycznym zaproponowanym przez Kohlrausch:
![]()
gdzie: a- stała doświadczalna
Roztwory słabych elektrolitów wykazują odmienny charakter zależności przewodnictwa molowego od stężenia. Z uwagi na niecałkowitą dysocjację elektrolitu przewodnictwo molowe jest niskie i szybko wzrasta ze wzrostem rozcieńczenia roztworu. Wartość przewodnictwa granicznego oblicza się na podstawie prawa niezależnej wędrówki jonów Kohlrauscha które głosi, że w roztworze nieskończenie rozcieńczonym przewodnictwo molowe jest sumą przewodnictw jonowych. Postać matematyczna tego prawa jest następująca:
![]()
gdzie: ![]()
, ![]()
- graniczne przewodnictwa jonowe kationów i anionów, ![]()
, ![]()
liczba jonów ujemnych i dodatnich, na które dysocjuje dany elektrolit.
Pomiary przewodnictwa znajdują wiele zastosowań, między innymi do wyznaczania stałych dysocjacji słabych elektrolitów. Proces dysocjacji elektrolitycznej słabego elektrolitu np. kwasu octowego w roztworze wodnym można przedstawić za pomocą równania:
CH3COOH + H2O ↔CH3COO- + H+
Stałą równowagi tego procesu zwaną termodynamiczną stała dysocjacji Ka wyraża wzór:
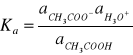
W roztworach rozcieńczonych wartości współczynników aktywności jonów cząsteczek niezdysocjowanych zbliżone są jedności i dlatego aktywności występujące w wyrażeniu na stałą dysocjacji można zastąpić odpowiednimi stężeniami. Uzyskuje się wówczas stężeniową stała dysocjacji Kc .
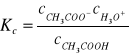
gdzie: ![]()
,![]()
, ![]()
- równowagowe molowe stężenia jonów oraz niezdysocjowanych cząsteczek kwasu octowego.
Stężenia jonów powstałych w procesie dysocjacji kwasu octowego są sobie równe i wynoszą ![]()
=![]()
=cα, gdzie α oznacza stopień dysocjacji elektrolitu natomiast c- całkowite stężenie roztworu. Stężenie niezdysocjowanego kwasu wynosi c-cα=c(1-α). Podstawienie powyższych wartości do wzoru zwanego prawem rozcieńczeń Ostwalda:
![]()
Zgodnie z teorią Arrheniusa, stopień dysocjacji słabego elektrolitu α można wyrazić poprzez stosunek przewodnictw molowych:
![]()
Otrzymuje się wówczas inną postać zależności:
![]()
Wyszukiwarka
Podobne podstrony:
Fizyczna27m, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna u
Sprawozdanie damiana nr 1, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i
poprawa II 25, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna
Chfizyczna5, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna u
moje 4, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna uł, Ch
wfizyczna9, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna uł
chemia fizyczna-ćwiczenie 22, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczn
fizyczna 20, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna u
fizyczna25, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna uł
Wstęp teoretyczny, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i anality
poprawa, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna uł, C
fIZYCZNA5, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna uł,
13 fiza word, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna
fizyczna nr 17 moja, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i anali
moje 18, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna uł, C
iza 25, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna uł, Ch
sprawozdanie 35 wstep, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i ana
więcej podobnych podstron